利用SELDI技术检测大鼠肝纤维化组织的实验研究
周 怡,廖 明,何 敏
(广西医科大学医学科学实验中心,广西 南宁530021)
SELDI-TOF-MS是一个高通量、高灵敏度的比较蛋白组学技术,通过对待测样品(如血液、组织或细胞裂解液、尿液、脑脊液、关节腔滑液、支气管洗脱液和各种分泌物等)蛋白指纹图谱的分析,在疾病的早期诊断、鉴别诊断、预后判断和疗效观察方面有一定的应用价值[1]。在各种可选的待测样品中,组织样品因能直接反映病灶的实质倍受研究者的青睐。然而,由于SELDI技术实验条件复杂,不适宜操作导致的结果偏差常常限制组织样本的科研应用。因此,各环节的质量控制和优化工作就成为亟待解决的问题[2,3]。本研究通过对组织样本制备、组织裂解液选择、上样浓度控制、实验仪器校准、实验结果重复性验证等方面技术优化,初步建立SELDI技术检测大鼠肝组织纤维化的方法。
1 材料与方法
1.1 材料 HPLC水,浓盐酸,pH3~10两性电解质,蛋白酶抑制剂,CHAPS,DTT,UREA,Tris,TFA,ACN,NaAc等均购自Sigma公司;基质(SPA,芥子酸)购自Biorad公司。CM1O蛋白质芯片和all-in-one校正芯片购自Ciphergen公司。质谱仪为美国CBI(Ciphergen Biosystems Inc)PBSⅡC型表面增强激光解析/电离飞行时间质谱仪。采用Ciphergen proteinchip 3.2.1版本的分析软件自动采集数据。
1.2 实验方法
1.2.1 裂解液的配制 分别制备下列三种不同组分的裂解液,裂解液Ⅰ(7mol/L urea+2mol/L 硫脲+2%w/v CHAPS+40mmol/L Tris+1%w/v DTT);裂解液Ⅱ(8mol/L Urea+4%w/v CHAPS+40mmol/L Tris+1%w/v DTT,每25 ml加入蛋白酶抑制剂1片);裂解液Ⅲ(9mol/L urea+4%w/v CHAPS+40mmol/L Tris+1%w/v DTT+0.8%pH 3~10两性电解质,每25ml加入蛋白酶抑制剂1片)。
1.2.2 样本采集和处理 建立大鼠肝纤维化模型,方法参见文献[4]。将肝纤维化组和对照组大鼠取肝脏组织分别用液氮研磨和匀浆机匀浆破碎,采用上述三种裂解液抽提组织蛋白,定量后分装于-80℃备用。
1.2.3 all-in-one芯片校准质谱仪 操作按 Ciphergen公司all-in-one芯片说明书中提供的方法和程序进行。
1.2.4 CM10芯片捕获组织样本中的蛋白:芯片预湿后,将组织蛋白样本与CM10结合缓冲液按体积分数(1∶10、1∶5、1∶2.5、1∶1)混匀,采用CM10芯片捕获蛋白后上机测定。每个样本在不同批次CM10芯片的芯池中重复加样三次。
1.2.5 SELDI检测 激光强度230,检测敏感度9,优化分子质量范围为2 000-20 000,最高分子量为50 000。用 Ciphergen proteinchip 3.2.1和 Biomarker Wizard软件对各检测样本所得图谱进行比对分析。
2 结果
2.1 仪器的校准 如图1所示,all-in-one芯片含血管加压素(1 083.6Da)、牛胰岛素β链(3 496.3 Da)、人胰岛素(5 808.2Da)和水蛭素(7 033.8Da)等蛋白标准品,仪器由Calibration功能进行多点校准后,在all-in-one芯片上检测到的单电荷蛋白峰的质核比与标准品对应的分子量相符。
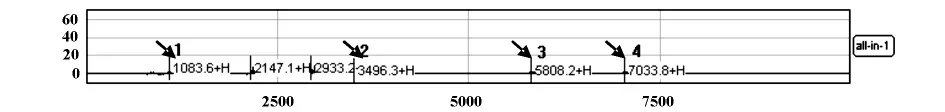
图1 仪器校准的图谱
2.2 不同裂解方案对组织样本的处理效力 液氮研磨法/匀浆法破碎后的组织分别用裂解液Ⅰ、Ⅱ、Ⅲ处理,蛋白浓度测定显示,液氮研磨法的产物浓度(18.75±1.76μg/ul)较匀浆法者(11.98±2.56μg/ul)均一且浓度较高;采用CM10芯片捕获分别经裂解液Ⅰ、Ⅱ、Ⅲ处理后的组织蛋白,发现裂解液Ⅲ处理后的组织样本蛋白质峰强度明显高于裂解液Ⅰ、Ⅱ的产物,且对应芯片上检测到的蛋白质峰也较多,结果见图2。
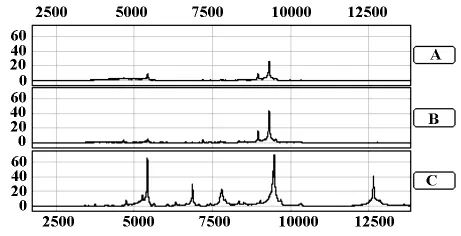
图2 不同组织裂解液的比较
2.3 上样样品的浓度 采用液氮研磨法和裂解液Ⅲ处理后的组织样本,浓度保持在17-20μg/ul水平,将其与CM10结合缓冲液按体积分数1∶2.5混合上样(即上样浓度约为5μg/ul)时,CM10芯片捕获的蛋白质峰数量和峰强度明显优于1∶10和1∶5混合上样;当以1∶1混合上样时,尽管CM10芯片捕获蛋白质的峰强度尚可,但基线略漂移且蛋白峰渐现融合趋势,表现为平头峰而非高尖峰,结果见图3。
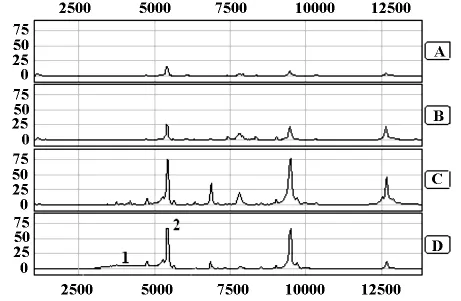
图3 上样样品浓度控制的比较
2.4 样本的重复性验证 将大鼠肝纤维化组和对照组各4例样本按上述优化条件处理后,依次结合在芯片上,平行点三张芯片,采用Biomarker Wizard软件,分别对各个检测样本2 000-20 000KD质量范围内的质谱峰进行统计,计算出三张芯片上各样本每个质谱峰的平均峰强度和方差,由此得到每个质谱峰的CV值和每组的平均CV值,如表1所示。两组平均CV值均在20%之内,显示出良好的重现性。
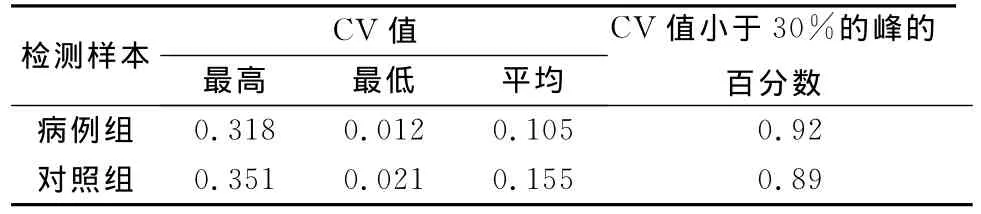
表1 各检测样本质谱峰CV值比较
2.5 两组间的差异蛋白比较 大鼠肝纤维化和对照共8份样品经SELDI-TOF-MS(CM10芯片)共检测到292个蛋白峰,其中差异表达蛋白(P<0.05)54个。与正常组织相比,16种蛋白在纤维化组上调,而另38种蛋白则下调。
3 讨论
近年来,经由SELDI-ProteinChip系统,各国的研究者利用各种体液筛选生物标记物或疾病相关靶,并取得卓越成就。但也有研究人员认为,尽管各种体液的获取过程常具有经济简便和损伤性小的特点,但体液中往往含有全身各细胞、组织、器官的分泌物,只能代表生物体的“整体模式”,并不能通过这类样本知晓具体组织的实际状态;组织则不同,不仅能直接反映病灶的实质还提供了病灶微环境的信息,而一些疾病,尤其是在初期本身可能就只影响了局部。回顾SELDI技术中组织样本的应用情况,我们发现目前国内外对组织标本研究都不是很多,主要有宫颈癌、肺癌和结肠癌等,如美国南加州癌症研究中心的科学家应用SELDI技术,采集肺组织样本研究肺癌和癌前病变的蛋白组变化等[5][6]。这可能是由于组织样本中除外病变细胞,还存在炎细胞、结缔组织细胞等混杂细胞的干扰,近来激光显微捕获(LCM)被应用到组织样本的制备中来,可以很好的解决组织中异质细胞的问题[7]。
本研究以大鼠肝纤维化组织为主要研究对象,通过对组织样本制备、组织裂解液选择、上样浓度控制、实验仪器校准、实验结果重复性验证等方面技术进行优化,将为利用SELDI技术检测各类组织样本奠定良好基础。在研究的过程中,病例和对照共两组样本检测到292个蛋白峰,其中差异表达蛋白54个,在肝纤维化组中表达上调16个,表达下调38个。对两组样本重复检测3次,蛋白丰度的平均变异系数(CV值)分别为0.105和0.155,说明实验的重复性佳。后续,我们将结合影像学检查与病理活检资料完成人肝纤维化组织样本的收集和疾病标志物的进一步筛选工作,为乙型肝炎肝纤维化的早期诊断提供理论依据。
[1]Seibert V,Wiesner A,Buschmann T,et al.Surface-enhanced laser desorption ionization time-of-flight mass spectrometry (SELDI TOF-MS)and ProteinChip technology in proteomics research[J].Pathol Res Pract,2004,200(2):83.
[2]Traum AZ,Wells MP,Aivado M,et al.SELDI-TOF-MS of quadruplicate urine and serum samples to evaluate changes related to storage conditions[J].Proteomics,2006,6(5):1676.
[3]Albrethsen J,Bogebo R,Olsen J.Preanalytical and analytical variation of surface-enhanced laser desorption ionization time-offlight mass spectrometry of human serum [J].Clin Chem Lab Med,2006,44(10):1243.
[4]马学惠.肝纤维化动物模型的造模方法[J].中华肝脏病杂志,1996,4(4):58.
[5]Zhukov TA,Johanson RA,Cantor AB,et al.Discoverv of distinct protein profiles specific for lung tumors and pre-malignant lung lesions by SELDI mass spectrometry[J].Lung Cancer,2003,40(3):267.
[6]Chen G,Gharib TG,Huang CC,et al.Proteomic analysis of lung adenocarcinoma identification of highly expressed set of proteins in tumors[J].Clin Cancer Res,2002,7(8):2298.
[7]王贵玉,王锡山.SELDI技术结合LCM技术分析结肠癌细胞蛋白质组学构成[J].哈尔滨医科大学学报,2006,40(2):131.

