青蒿琥酯对人肝癌HepG2细胞增殖和凋亡的影响及联合化疗药物的抗肝癌效应*
刘志龙, 曹明溶△, 李 强, 高 明, 蒋建伟
(暨南大学1附属第一医院普通外科,2医学院生化教研室,广东 广州510632)
青蒿琥酯(artesunate,ART)是青蒿素的主要衍生物之一,近年来研究发现其在体内外对肝癌均有抑制作用。研究[1]发现青蒿琥酯对正常肝细胞毒性小,而对P53野生型及突变型肝癌细胞均有抑制作用。王勤等[2]给荷瘤鼠口服青蒿琥酯后,亦能明显抑制肝癌的生长。但目前有关青蒿琥酯和抗肿瘤药物合用的报道较少。我们观察了青蒿琥酯在体外对人肝癌细胞系HepG2的生长抑制与诱导凋亡作用,并对其与临床常用抗肿瘤药物合用后的效果进行了研究。
材料和方法
1 主要材料及仪器
人肝癌HepG2细胞由暨南大学生物化学教研室惠赠。ART化学对照品,分子式:C19H28O8,分子量:384.43,棕色小瓶装,生产批号为100200-200202,购自中国药品生物制品检定所;新生牛血清(newborn calf serum),生产批号为071222,购自杭州四季青生物工程材料有限公司;DMSO、胰蛋白酶(trypsin,1∶250)、Hoechst 33258、碘化丙啶、台盼蓝(typan blue)均购自Sigma;RPMI-1640培养液购自Gibco;Annexin V-PI双染试剂盒购自北京宝赛生物技术公司;CCK-8(cell count kit-8)细胞计数试剂购自同仁化学研究所。
2 方法
2.1 CCK-8法检测细胞增殖抑制率 在细胞对数生长期,将人肝癌HepG2细胞悬液调成5×107cells/L接种于96孔培养板,每孔100 μL,即每孔细胞约为5 000个,置37℃、5%CO2培养箱12 h后加药,每孔加入药物后终体积为150 μL/well(不足体积以不含血清RPMI-1640培养液补齐),对照组以不含血清RPMI-1640培养液补齐,每组设3个复孔,ART作用 HepG2细胞终浓度为 200 μmol/L、100 μmol/L、80 μmol/L、50 μmol/L、25 μmol/L、12.5 μmol/L,置37 ℃、5%CO2培养48 h后,每孔加入10 μL CCK-8试剂,继续培养1 h,酶标仪检测吸光度值(A)(测定波长450 nm,参比波长655 nm),计算各组增殖抑制率,该实验重复3次。增殖抑制率(%)=(1-A实验组/A对照组)×100%。
2.2 克隆形成实验 将HepG2细胞悬液调成3×105cells/L接种于12孔培养板,1 mL/well,每组设3个复孔,培养12 h后加药,每孔加入药物后终体积为1 500 μL/well(不足体积以不含血清RPMI-1640培养液补齐),ART 作用终浓度为 10 μmol/L、5 μmol/L、2.5 μmol/L,培养 7 d 后,吸去培养液,PBS 洗涤 2次后,甲醇∶冰醋酸(3∶1)固定液固定10 min后晾干,吉姆萨染色15 min后流水冲洗,倒置显微镜下计数细胞克隆(>20个细胞记1个克隆)并拍照,克隆形成抑制率=(1-实验组细胞克隆数/对照组细胞克隆数)×100%,该实验重复3次。
2.3 Hoechst 33258染色观察凋亡细胞形态学变化将HepG2细胞悬液调成1×108cells/L接种于6孔培养板,2 mL/well,每组设2个复孔,培养12 h后加药,每孔加入药物后终体积为2 500 μL/well(不足体积以不含血清RPMI-1640培养液补齐),ART作用终浓度为25 μmol/L,培养48h后消化收集细胞:(1)以1 000 r/min离心6 min,弃上清;(2)PBS重悬细胞,离心洗涤2次;(3)留少许上清,用微量加样器吸取细胞在洁净载玻片上涂片,室温自然干燥;(4)甲醇∶冰醋酸 (3∶1)固定液固定15 min;(5)晾干后于暗处用Hoechst 33258染色工作液(10 mg/L)避光染色10 min;(6)双蒸水冲洗5 min,甘油封片,荧光显微镜观察并拍照(紫外光340nm波长)。
2.4 PI单染检测亚二倍体率和细胞周期 将HepG2细胞悬液调成1×108cells/L接种于6孔培养板,2 mL/well,每组设3个复孔,培养12 h后加药,每孔加入药物后终体积为2 500μL/well(不足体积以不含血清RPMI-1640培养液补齐),ART作用终浓度为 50 μmol/L、25 μmol/L、12.5 μmol/L,培养48 h后消化收集细胞,预冷的PBS洗涤细胞2次后,先用600 μL PBS液重悬细胞,再加入无水乙醇1.4 mL(最终乙醇体积分数为70%),4℃固定过夜,离心去上清,预冷的PBS洗涤细胞1次后,加入PI染色液(含 RNase酶),终浓度50 mg/L,避光染色30 min,300目尼龙网过滤后上流式细胞仪分析细胞DNA含量,每个样本随机分析12 000个细胞,得各组细胞亚二倍体率和细胞生长周期比例,BD FAC Sort Cell Quest软件分析处理结果,该实验重复3次。
2.5 Annexin V-PI双染测定细胞凋亡比例 将HepG2细胞悬液调成1×108cells/L接种于6孔培养板,2 mL/well,每组设2个复孔,培养12 h后加药,每孔加入药物后终体积为2 500 μL/well(不足体积以不含血清RPMI-1640培养液补齐),ART作用终浓度为 50 μmol/L、25 μmol/L、12.5 μmol/L,培养 48 h后消化收集细胞,预冷PBS洗涤3次,吸尽上清,加入200 μL试剂盒提供的结合缓冲液,重悬细胞后,分别加入 FITC 标记的10 μL Annexin V 和5 μL PI,轻轻混匀,4℃避光反应30 min,再加入300 μL结合缓冲液,上机检测。Annexin V-FITC阳性且PI阴性的细胞群(即LR细胞群)为早期凋亡细胞群,该实验重复3次。
2.6 药物敏感性实验 将HepG2细胞悬液调成5×107cells/L接种于96孔培养板,每孔100 μL,即每孔细胞约为5 000个,培养12 h后加药,每孔加入药物后终体积为150 μL/well(不足体积以不含血清RPMI-1640培养液补齐),每组设3个复孔,对每一种药物均设:对照组、单独化疗药物组、化疗药物与ART组、单独 ART组。ART终浓度为3.5 μmol/L,5-氟尿嘧啶(5-fluorouracil,5-FU)终浓度为16 mg/L、8 mg/L、4 mg/L、2 mg/L、1 mg/L、0.5 mg/L、0.25 mg/L、0.125 mg/L,卡铂终浓度为 6 mg/L、3 mg/L、1.5 mg/L、0.8 mg/L、0.4 mg/L、0.2 mg/L,表柔比星终浓度为0.2 mg/L、0.1 mg/L、0.05 mg/L、0.025 mg/L。培养48 h后每孔加入CCK-8试剂10 μL,继续培养1 h,酶标仪检测吸光度值,计算各组增殖抑制率及IC50,该实验重复3次。
根据抑制率计算金正均q值来判断化疗药物与ART联合使用的效果:q=Ea+b/(Ea+Eb-Ea×Eb),Ea和Eb分别为单用ART和单用化疗药物的抑制率,Ea+b为合并用药的抑制率。式中分子代表“实测合并效应”,分母是“期望合并效应”,q值是两者之比,q<0.85为拮抗效应,0.85≤q<1.15为相加效应,q≥1.15为协同效应。
3 统计学处理
结 果
1 CCK-8法检测细胞增殖抑制率
不同浓度ART作用HepG2细胞48 h后,与对照组相比细胞较为稀疏,细胞间隙大,有较多的细胞变圆,体积小,贴壁慢,部分细胞不贴壁或贴壁不牢,易被消化离壁;细胞增殖受到抑制,差异显著(P<0.01),随着药物浓度的升高,抑制率逐渐升高,IC50为19.2 μmol/L,说明ART以剂量依赖的方式抑制HepG2细胞的增殖。
2 ART对HepG2细胞克隆形成的影响
随着浓度增加,各组ART作用HepG2细胞7 d后,与对照组相比较克隆形成数量明显减少,且克隆逐渐变小,青蒿琥酯浓度为2.5 μmol/L 、5 μmol/L 、10 μmol/L时,克隆形成抑制率分别为:(13.80±2.22)% 、(25.84±2.93)%、(50.37±4.52)%,各实验组细胞克隆形成数与对照组相比均差异显著(P <0.01)。
3 Hoechst 33258染色观察凋亡细胞形态学变化
ART组与对照组细胞相比可见明显凋亡细胞,如核固缩、边聚、裂解、凋亡小体形成等凋亡形态学变化。
4 PI单染流式细胞仪检测细胞周期和亚二倍体百分率
ART组细胞周期比例与对照组细胞相比,随ART浓度升高,G2期细胞比例明显上升(P<0.01),G1细胞减少。提示ART可能延缓了HepG2由G2期向M期的过渡,见图1。
ART组与对照组相比,ART组细胞出现明显的亚二倍体凋亡峰,随着ART浓度的增大,HepG2细胞的亚二倍体率增加。对照组、ART 12.5 μmol/L组、ART 25 μmol/L 组和 ART 50 μmol/L 组各组的亚二倍体百分率分别为:(4.86±0.38)%、(20.40±0.60)%、(24.90±0.20)%、(28.70±0.72)%,ART各组与对照组相比均有显著差异(P<0.01)。
5 Annexin V-PI双染流式细胞仪检测结果
各组药物作用人肝癌HepG2细胞48 h后,用Annexin V/PI双染流式细胞仪检测细胞早期凋亡率,左下限(LL)为正常细胞群,右下限(RL)为早期凋亡细胞群,右上限(RU)为晚期凋亡细胞及坏死细胞群,见图2。ART各组细胞早期凋亡率与对照组相比均有显著差异(P<0.01)。
6 药物敏感性实验
6.1 ART联合5-FU对HepG2的增殖抑制作用单独5-FU作用人肝癌 HepG2细胞48 h,IC50为8.59 mg/L,与3.5 μmol/L 的 ART联合作用后,IC50为2.58 mg/L,增敏倍数为3.33。其中0.125 mg/L 5-FU与3.5 μmol/L ART联合为协同作用,q值为1.17,见表 1。
6.2 ART联合卡铂对HepG2的增殖抑制作用 单独卡铂作用人肝癌 HepG2细胞48 h,IC50为2.63 mg/L;与 3.5 μmol/L ART 联合作用后,IC50为 1.30 mg/L,增敏倍数为2.02。其中0.2 mg/L卡铂及0.4 mg/L卡铂与3.5 μmol/L ART联合为协同作用,q值分别为1.18和1.28,见表2。
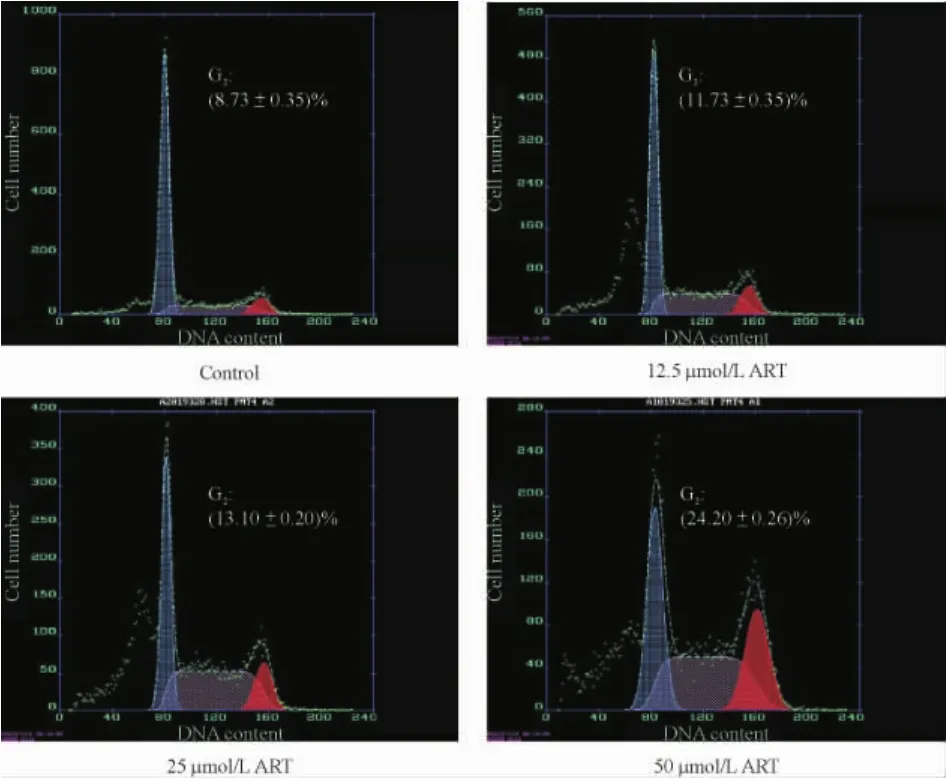
Figure 1.PI staining showed characteristic features of apoptosis in ART-exposed cells.The percentage of cells in G2 phase increased compared with the control group.±s.n=3.图1 PI单染流式细胞仪检测ART对HepG2细胞的细胞周期改变
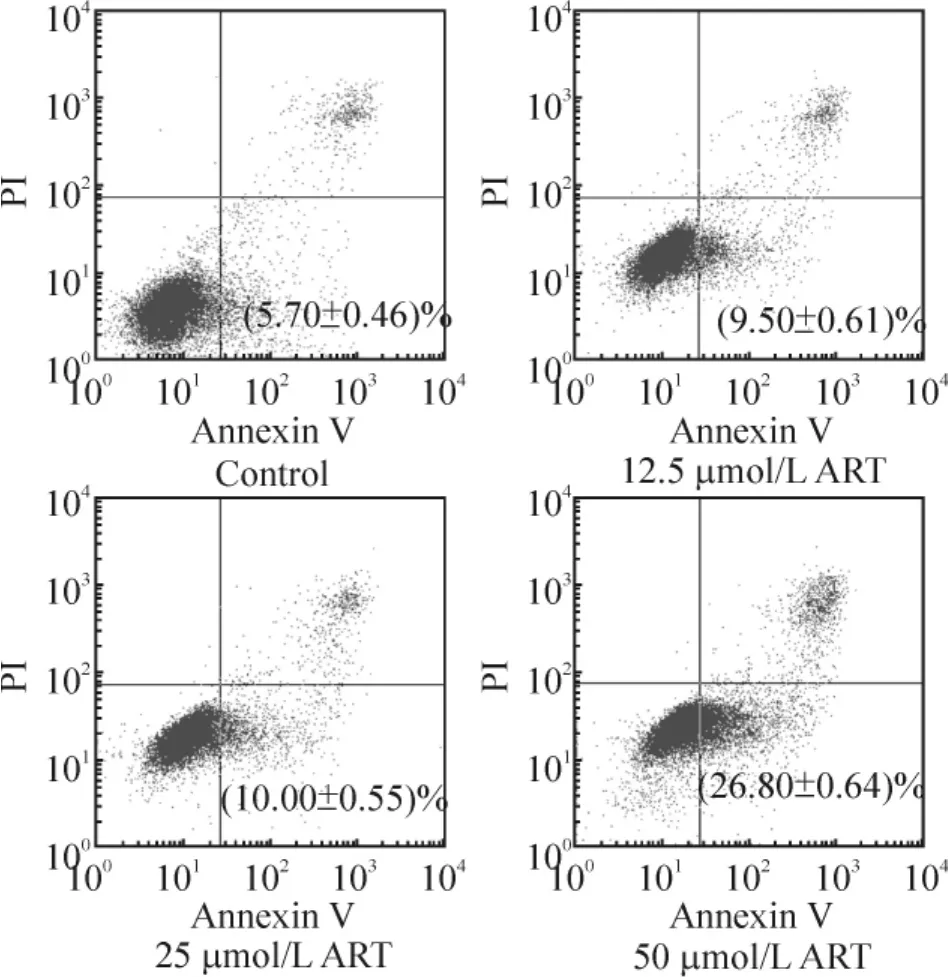
Figure 2.Staining cells with Annexin V-FITC and PI were used to distinguish and quantitatively determine the percentage of apoptotic cells.The apoptotic rate increased in a dose-dependent manner.±s.n=3.图2 Annexin V/PI双染流式细胞仪检测结果代表图
表1 5-FU联合3.5 μmol/L ART对HepG2细胞的增值抑制作用Table 1.Effects of ART on HepG2 cell growth inhibition in combination with 5-FU(±s.n=3)

表1 5-FU联合3.5 μmol/L ART对HepG2细胞的增值抑制作用Table 1.Effects of ART on HepG2 cell growth inhibition in combination with 5-FU(±s.n=3)
5-FU 5-FU combined with 3.5 μmol/L ART Concentration(mg/L)qvalue Inhibitory rate(%)5-FU concentration(mg/L)Inhibitory rate(%)0 0 0 19.46±4.00…0.125 3.59±2.21 0.125 26.33 ±2.82 1.17 0.25 15.48±4.62 0.25 28.99 ±8.04 0.91 0.5 25.02±2.81 0.5 29.54 ±7.90 0.75 1.0 30.69±3.64 1.0 32.66 ±6.77 0.74 2.0 43.88±2.46 2.0 48.33 ±4.60 0.88 4.0 46.12±2.70 4.0 56.29 ±3.59 0.99 8.0 48.06±0.68 … … …16.0 56.89±3.31… … …
表2 卡铂联合3.5 μmol/L ART对HepG2细胞的增殖抑制作用Table 2.Effects of ART on HepG2 cell growth inhibition in combination with carboplatin(±s.n=3)
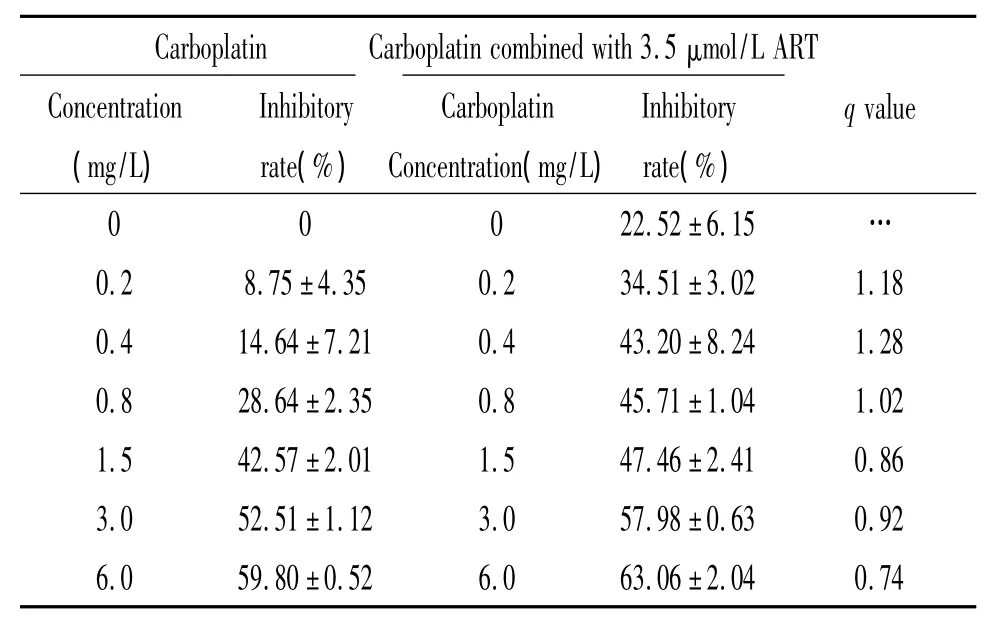
表2 卡铂联合3.5 μmol/L ART对HepG2细胞的增殖抑制作用Table 2.Effects of ART on HepG2 cell growth inhibition in combination with carboplatin(±s.n=3)
Carboplatin Carboplatin combined with 3.5 μmol/L ART Concentration(mg/L)Inhibitory rate(%)0 0 0 22.52±6.15 Inhibitory rate(%)Carboplatin Concentration(mg/L)qvalue…0.2 8.75±4.35 0.2 34.51 ±3.02 1.18 0.4 14.64±7.21 0.4 43.20 ±8.24 1.28 0.8 28.64±2.35 0.8 45.71 ±1.04 1.02 1.5 42.57±2.01 1.5 47.46 ±2.41 0.86 3.0 52.51±1.12 3.0 57.98 ±0.63 0.92 6.0 59.80±0.52 6.0 63.06 ±2.04 0.74
6.3 ART联合表柔比星对HepG2的增殖抑制作用 单独表柔比星作用人肝癌HepG2细胞48 h,IC50为0.12 mg/L;与3.5 μmol/L ART 联合作用后,IC50为0.07 mg/L,增敏倍数为1.71。其中0.025 mg/L表柔比星与3.5 μmol/L ART联合为协同作用,q值为1.17,见表3。
表3 表柔比星联合3.5 μmol/L ART对HepG2细胞的增殖抑制作用Table 3.Effects of ART on HepG2 cell growth inhibition in combination with epirubicin(±s.n=3)
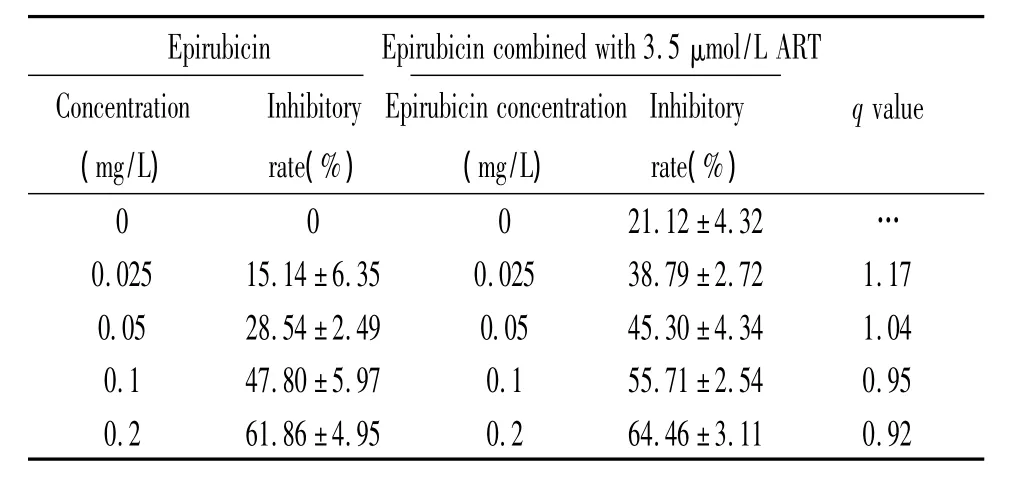
表3 表柔比星联合3.5 μmol/L ART对HepG2细胞的增殖抑制作用Table 3.Effects of ART on HepG2 cell growth inhibition in combination with epirubicin(±s.n=3)
Epirubicin Epirubicin combined with 3.5 μmol/L ART Concentration(mg/L)Inhibitory rate(%)Inhibitory rate(%)Epirubicin concentration(mg/L)qvalue 0 0 0 21.12±4.32…0.025 15.14±6.35 0.025 38.79 ±2.72 1.17 0.05 28.54±2.49 0.05 45.30 ±4.34 1.04 0.1 47.80±5.97 0.1 55.71 ±2.54 0.95 0.2 61.86±4.95 0.2 64.46 ±3.11 0.92
讨 论
青蒿素被列入治疗疟疾的基本药物已多年,安全可靠[3]。近年来研究发现,这类药物尚有广谱抗癌活性。范钰等[4]研究发现青蒿琥酯能够有效抑制乳腺癌MCF-7细胞增殖、侵袭及转移,且呈浓度和时间依赖性。Efferth等[5]报道青蒿琥酯对55株肿瘤细胞的体外抑瘤作用,结果显示青蒿琥酯对白血病、结肠癌和非小细胞肺癌、黑色素瘤、乳腺癌、卵巢癌、前列腺癌、中枢神经肿瘤和肾癌细胞株均有效果。Hou等[1]将青蒿琥酯作用于肝癌细胞系HepG2(P53野生型)、Huh-7和 BEL-7404(P53突变型)、Hep3B(P53缺失型)及一种正常肝细胞,结果发现,4种肝癌细胞均发生增殖抑制,出现明显凋亡细胞,而正常肝细胞的生长没有发生明显变化,同时青蒿琥酯能够增强肝癌细胞对吉西他滨的敏感性。张星等[6]报道青蒿酯钠能抑制肝癌细胞系BEL-7402增殖,诱导肝癌细胞凋亡。本实验结果与上述报道一致,经青蒿琥酯处理后,肝癌细胞增殖受到明显抑制,出现了较多典型的凋亡细胞,亚二倍体率及凋亡细胞比例都显著上升,进一步证实了青蒿琥酯能抑制肝癌细胞增殖,诱导其凋亡。
随着诊疗技术的进步以及高危人群的普查和重点随访,早期肝癌和小肝癌的检出率和手术根治切除率逐年增加,加上肝动脉化疗栓塞、放疗、射频消融、氩氦刀、微波凝固、化疗、生物和免疫治疗等综合治疗的应用,肝癌的治疗效果有所提高。但大部分肝癌起病隐匿,早期缺乏典型症状,待诊断明确时大多属中晚期,再加上我国肝癌患者多数有慢性乙型肝炎病史,肝功能及全身情况较差,丧失了手术切除的机会,而在临床上肝癌对放化疗并不十分敏感。在体外实验中我们发现,青蒿琥酯与常用化疗药物,如5-FU、卡铂和表柔比星联合作用以后,化疗药物的IC50值较单独应用时明显降低,增敏倍数分别为3.33、2.02和1.71,并且当较低浓度化疗药物与3.5 μmol/L青蒿琥酯联合时,计算出q值大于1.15,说明二者联合后有协同作用。有报道[7]将青蒿琥酯联合β射线作用于人脑胶质瘤细胞CHG-5,发现青蒿琥酯能够增强β射线对肿瘤细胞的抑制作用,这提示青蒿琥酯可以作为肝癌放化疗过程中的辅助治疗措施,以提高肝癌对放化疗的敏感性。
我国肝癌患者大多具有病毒性肝炎-肝硬化-肝癌的发展过程,已有报道指出青蒿琥酯具有抗乙型肝炎病毒[8]、改善组织纤维化[9]的作用,提示青蒿琥酯有可能成为在肝癌预防及治疗各个阶段都可以发挥作用的有效药物。
[1] Hou J,Wang D,Zhang R,et al.Experimental therapy of hepatoma with artemisinin and its derivatives:in vitro and in vivo activity,chemosensitization,and mechanisms of action[J].Clin Cancer Res,2008,14(17):5519-5530.
[2] 王 勤,吴理茂,李爱媛,等.青蒿琥酯抗肝癌作用的实验研究[J].中国中药杂志,2001,26(10):707-708.
[3] Meshnick SR,Thomas A,Ranz A,et al.Artemisinin(qinghaosu):the role of intracellular hemin in its mechanism of antimalarial action[J].Mol Biochem Parasitol,1991,49(2):181-189.
[4] 范 钰,郑 树,赵 刚.青蒿琥酯对乳腺癌MCF-7细胞抗失巢凋亡的影响[J].中国病理生理杂志,2006,22(4):748-751.
[5] Efferth T,Dunstan H,Sauerbrey A,et al.The anti-malarial artesunate is also active against cancer[J].Int J Oncol,2001,18(4):767-773.
[6] 张 星,杨小平,潘启超.青蒿酯钠抗人肝癌(BEL-7402)与诱导凋亡[J].中草药,1998,29(7):467-469.
[7] 董俊清,赵妍妍,姚 琦,等.青蒿琥酯增加人脑胶质瘤细胞CHG-5对β射线的敏感性[J].第三军医大学学报,2010,32(6):588-592.
[8] Romero MR,Efferth T,Serrano MA,et al.Effect of artemisnin/artesunate as inhibitors of hepatitis B virus production in an“in vitro”replicative system[J].Antiviral Res,2005,68(2):75-83.
[9] 戴夕超,韩正祥,杜秀平,等.双氢青蒿素对大鼠照射后早期肺组织病理形态学的影响[J].徐州医学院学报,2008,28(12):779-783.

