当归补血汤对动脉粥样硬化兔内皮祖细胞及血清VEGF、SDF-1的影响*
秦 臻, 黄水清
(广州中医药大学,广东广州510405)
动脉内皮细胞的损伤和功能失调是动脉粥样硬 化(atherosclerosis,AS)发生发展的关键因素,内皮祖细胞(endothelial progenitor cells,EPCs)在血管内皮损伤再生和修复中起着主要作用,血管内皮生长因子(vascular endothelial growth factor,VEGF)及基质细胞衍生因子1(stromal cells derived factor 1,SDF-1)在EPCs的调节机制中具有重要作用。当归补血汤(Danggui Buxue decoction,DBD)具有较好的调血脂和抗氧化作用[1],并能抑制相关炎症因子来保护AS中受损血管内皮。本文将探讨当归补血汤对AS病程中EPCs的相关影响及可能作用机制。
材料和方法
1 主要试剂与仪器
M199培养液(M199 medium,Gibco),胎牛血清(PAA),淋巴细胞分离液(天津灏洋生物科技有限公司),FITC标记荆豆凝集素1(FITC-labeled Ulex europaeus agglutinin,FITC - UEA -1,Sigma),DiI标记的乙酰化低密度脂蛋白(DiI-labelled acetylated low-density lipoprotein,DiI-ac-LDL,Invitrogen),血管内皮生长因子 (vascular endothelial growth factor,VEGF,PeproTech),碱性成纤维细胞生长因子 (basic fibroblast growth factor,bFGF,PeproTech),Transwell小室(Corning),体外血管生成试剂盒(Corning),辛伐他汀(杭州默沙东公司),荧光显微镜(Leica)。
2 方法
2.1 制备当归补血汤水煎液 药材经广州市药检所鉴定为道地药材,按原方中黄芪(甘肃)和当归(甘肃)5∶1配伍比例称取生药,每克生药加水6 mL浸泡30 min,煮沸后再文火慢煎40 min,趁热过滤,滤液自然滴尽,二煎每克生药加水4 mL,煎法同前,合并滤液,60℃水浴浓缩成含1 kg/L生药的水煎液。密封,-20℃保存备用。
2.2 模型复制[2]新西兰兔10只,雌雄各半,由广州中医药大学动物中心提供,合格证号为0014280,体重2.0~3.0 kg,普通饲料喂养1周后分为2组,每组5只。正常组予以普通饲料喂养,模型组予以牛血清白蛋白(250 mg/kg)一次性耳缘静脉注射,每天喂以每2 kg含1 g胆固醇的高脂饲料,连续4周后空气栓塞处死动物,取主动脉弓部,HE染色,观察主动脉动脉粥样硬化斑块情况;并于心脏房室沟直下方每隔0.3 cm 作一横切面,共切3块,每块厚约0.25~0.3 cm,均作脂肪染色。动脉粥样硬化按管腔阻塞程度分为4级:斑块阻塞管腔在25%以下者为1级,斑块阻塞管腔在25% ~50%者为2级,斑块阻塞管腔在51%~75%者为3级,斑块阻塞管腔在75%以上甚至使管腔完全闭塞者为4级。
2.3 动物分组及取材 新西兰兔25只,雌13、雄12只,广东省实验动物中心提供,合格证号为0072402,体重1.8 ~2.2 kg,全部动物按2.2 方法造模结束后,按体重随机分为模型组、辛伐他汀组、当归补血汤高、中、低剂量组,每组5只。按动物与人等效剂量折算,当归补血汤高、中、低剂量分别予以当归补血汤 6 g/kg、3 g/kg、1.5 g/kg 灌胃,辛伐他汀组予以辛伐他汀水悬液1.7 mg/kg,模型组予以等量蒸馏水,灌胃2周,每周测体重1次以调整给药剂量。灌胃结束禁食12 h后,腹腔麻醉动物,腹主动脉采血,真空负压管采取6 mL新鲜血及30 mL EDTA抗凝血。
2.4 EPCs的培养 抗凝血用PBS按1∶1稀释,稀释后的抗凝血按1∶1缓慢加入淋巴细胞分离液上层,2 500 r/min离心25 min,吸出单个核细胞层,然后用PBS以1 500 r/min×5 min洗涤2次。用M199全培养基(含 20%FBS,1×105U/L青、链霉素,10 μg/L VEGF和 bFGF)重悬后计数,以 5×109cells/L接种于纤维连接蛋白包被的24孔板中,培养至第4 d换液1次,收集培养第7 d的细胞检测。
2.5 EPCs的鉴定[3]贴壁细胞弃上清,加入含2.4 mg/L DiI-ac-LDL的M199培养液孵育1 h后,PBS浸洗,4%多聚甲醛固定20 min,再加入10 mg/L FITC-UEA-1,孵育1 h后再次用PBS浸洗,避光干燥封片,荧光显微镜下观察细胞吞噬乙酰化低密度脂蛋白及结合荆豆凝集素1的能力。
2.6 增殖能力测定 0.25%胰酶消化收集各组细胞,重悬计数,将等量EPCs接种于96孔板,细胞贴壁后,每孔加入5%MTT 20 μL,继续培养4 h后,吸弃上清,每孔加入二甲基亚砜150 μL,振荡10 min,置酶标仪读取A值。实验重复3次。
2.7 黏附能力测定[4]将等量的 EPCs接种于96孔板上,每组设3个复孔,孵育30 min后移去上清及未贴壁细胞,加入PBS,倒置显微镜下随机选取5个视野(×200)计数贴壁细胞。
2.8 迁移能力测定 将等量的EPCs加入Transwell小室的上室,下室加入含50 μg/L VEGF培养基,培养24 h,棉签擦去上室中的细胞,4%多聚甲醛固定,吉姆萨染色,倒置显微镜下随机选择5个视野(×200)计数迁移至下层的细胞。实验重复3次。
2.9 形成小管能力测定 将ECMatrix胶液和ECM 10×稀释液置于4℃冰箱过夜,使之融化。每900 μL ECMatrix胶液加入 ECM 10×稀释液100 μL,将混匀液加入96孔板,每孔50 μL,孵育1 h凝固成胶,将各组细胞以5 000 cells/well接种于胶上,每组设3个复孔,37℃培养24 h后,倒置显微镜每孔随机选取5个视野(×200)计数长度为宽度4倍以上的细胞。
2.10 ELISA法检测VEGF及SDF-1 6 mL兔血室温静置2 h,以3 000 r/min离心15 min后取上清,按试剂盒说明操作检测,每个样本重复3次,取平均值。
3 统计学处理
结 果
1 动物模型复制
正常家兔主动脉内膜等结构完整,内皮下无脂质沉积或斑块形成,心脏切片均未发现冠状动脉粥样硬化斑块;模型组主动脉内膜增厚,形成明显的粥样斑块,可见大量泡沫细胞,心脏切片均可见到冠状动脉内膜有粥样硬化斑块形成,斑块经油红O染色证实是大量脂质沉着,脂肪染色管腔阻塞程度模型组为2级或3级,见图1。

Figure 1.The pathological sections of rabbit coronary artery(oil red O staining,×200).A:control group;B:AS group.图1 兔冠状动脉病理切片
2 EPCs的鉴定
贴壁细胞经DiI-ac-LDL和FITC-UEA-1处理后,荧光显微镜下DiI-ac-LDL和FITC-UEA-1双染色阳性细胞为正在分化的EPCs,见图2。

Figure 2.Identification of EPCs(×200).A:adherent cells with DiI-ac-LDL(red);B:cells binding FITC-UEA-1(green);C:double positive cells were differentiating EPCs.图2 EPCs的鉴定
3 当归补血汤对兔EPCs功能及血清VEGF、SDF-1表达的影响
汤高剂量组及中剂量组间作用效果无明显差异,见表1、图3。
与模型组比较,当归补血汤高、中剂量组及辛伐他汀组兔血清VEGF和SDF-1浓度水平增高(P<0.05),且EPCs增殖、黏附、迁移和形成小管能力均有增强(P<0.05),低剂量组血清VEGF、SDF-1浓度及EPCs功能无明显变化;辛伐他汀组、当归补血
讨 论
动脉血管内皮的损伤与修复始终贯穿于AS病程,内皮细胞的损伤和功能失调是AS形成最重要的一步,内皮在修复与损伤间的动态变化,将最终决定着AS的病变发展,因此内皮再生显得尤为重要。研究发现[5-8]EPCs可参与血管内皮损伤后的再生与修复,EPCs活性维持在高水平可渐弱多重危险因素的致AS作用。然而,EPCs的数量及功能却在AS相关疾病中受到明显损害:在确诊的冠心病患者中发现其EPCs的数量和非老化EPCs的数量显著减少,并与冠状动脉粥样钙化积分和股动脉中膜厚度呈负相关,进一步发现EPCs的数量和活性在稳定的冠心病患者中与冠脉的狭窄程度密切相关,提示EPCs的数量降低和活性抑制加速AS进展。因此,通过移植正常功能或基因修饰的EPCs,或通过改善循环血中EPCs的数量及功能来修复内皮一直是近年研究的热点。
表1 当归补血汤对兔EPCs功能及血清VEGF、SDF-1水平的影响Table 1.Effects of DBD on functions of EPCs and serum levels of VEGF and SDF-1(±s.n=5)

表1 当归补血汤对兔EPCs功能及血清VEGF、SDF-1水平的影响Table 1.Effects of DBD on functions of EPCs and serum levels of VEGF and SDF-1(±s.n=5)
*P <0.05,**P <0.01 vs AS group.
Group VEGF(ng/L) SDF-1(μg/L) Proliferation(A) Adhesion(cells,×200) Migration(cells,×200)Angiogenesis(cells,×200)AS 27.98±16.22 2.01 ±0.48 0.19 ±0.07 132.7 ±37.8 217.0±35.9 11.0±2.2 Simvastatin 64.96±15.23* 2.96±0.39* 0.30±0.09* 249.6±78.3* 373.8±33.3** 19.6±4.2*High-dose DBD treatment 61.28±21.87* 2.84±0.42* 0.28±0.04* 224.9±75.4* 283.2±52.0* 16.8±4.7*Middle-dose DBD treatment 61.36±20.90* 2.71±0.46* 0.30±0.10* 232.4±39.4* 278.8±18.1* 16.6±6.2*Low -dose DBD treatment 34.45±11.03 2.23±0.41 0.22±0.05 152.4±43.1 232.6±38.9 8.6±2.1
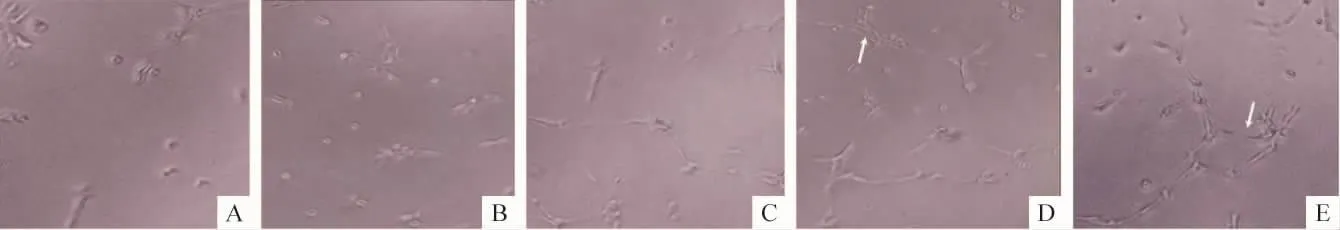
Figure 3.Angiogenesis of EPCs in vitro(×100).A:tubule number is small in AS group;B:low -dose DBD treatment group;C,D,E:tubule number increased in middle-dose of DBD,high-dose of DBD and simvastatin groups.Obvious tube-like structure formation was found in D and E.图3 EPCs的体外形成小管能力
AS作为一种缓慢发展的血管内膜炎性病变,其中医主要病机为气血不足,血脉瘀阻。当归补血汤由黄芪5份及当归1份组成,是益气活血的经典名方,已证实具有良好的血管内皮保护作用,能明显改善兔AS模型主动脉粥样硬化斑块的面积及厚度[1],可同时调控NF-κB及p38MAPK信号通路来抑制相关炎症因子对内皮的损伤[9-10]。由于AS发展中存在着EPCs的耗竭,导致EPCs依赖性的动脉内皮缺乏修复,从EPCs这一角度来阐述当归补血汤的内皮保护作用,将作为其保护机制的重要补充,并为临床应用提供更有力的理论依据。
研究表明家兔EPCs数量及功能在AS病理状态下均受到严重损害[11],辛伐他汀[12]及益气活血方药补阳还五汤[13]均可明显改善正常家兔外周血EPCs的功能,促进EPCs的分化。本文对AS病理状态下EPCs进行研究,结果显示当归补血汤及辛伐他汀均可保护AS中受损的EPCs相关功能,同时也初步探讨了其可能作用机制:VEGF和SDF-1在EPCs的调节中具有重要作用[14-15],内皮损伤后释放的VEGF和SDF-1分别与EPCs表面的特异性受体VEGF-R1、VEGF-R2和CXCR-4结合,诱导EPCs的增殖;而释放的SDF-1能在骨髓和受损内皮间形成一个由高到低的浓度梯度,使EPCs逆着SDF-1浓度梯度到达受损内皮;VEGF亦可引起受损缺血部位EPCs的聚集,促进血管新生,同时 SDF-1和VEGF也是影响EPCs向内皮细胞分化的主要因子。研究表明当归补血汤及辛伐他汀组兔血清VEGF、SDF-1较模型组维持在较高水平,这提示当归补血汤可能通过维持循环VEGF和SDF-1水平来参与EPCs活性的调控,但这仍需进一步体外研究验证。
尽管他汀类药物能在短时间内动员EPCs修复损伤内皮,但长时间药物治疗可导致 EPCs的枯竭[16],长时间应用当归补血汤是否也会有同种弊端,益气活血方药能否稳定有效地维持EPCs的活性仍值得进一步探究。
[1]黄水清,王 斌,王 剑,等.当归补血汤抗家兔动脉粥样硬化形成的实验研究[J].北京中医药大学学报,2005,28(5):38 -40.
[2]汪 谦 主编.现代医学实验方法[M].第1版.北京:人民卫生出版社,1998.955 -956.
[3]Vasa M,Fichtlscherer S,Adler K,et al.Increase in circulating endothelial progenitor cells by statin therapy in patients with stable coronary artery disease[J].Circulation,2001,103(24):2885 -2890.
[4]George J,Herz I,Goldstein E,et al.Number and adhesive properties of circulating endothelial progenitor cells in patients with in - stent restenosis[J].Arterioscler Thromb Vasc Biol,2003,23(12):e57 - e60.
[5]崔 斌,黄 岚,武晓静,等.内皮祖细胞移植对血管内膜修复的影响[J].中国病理生理杂志,2007,23(4):625-628.
[6]Lev EI,Leshem -Lev D,Mager A,et al.Circulating endothelial progenitor cell levels and function in patients who experienced late coronary stent thrombosis[J].Eur Heart J,2010,31(21):2625 -2632.
[7]Wang HY,Gao PJ,Ji KD,et al.Circulating endothelial progenitor cells,C-reactive protein and severity of coronary stenosis in Chinese patients with coronary artery diseases[J].Hypertens Res,2007,30(2):133 - 141.
[8]Hughes AD,Coady E,Raynor S,et al.Reduced endothelial progenitor cells in European and South Asian men with atherosclerosis[J].Eur J Clin Invest,2007,37(1):35 -41.
[9]孙 娟,黄水清,马文静,等.当归补血汤对ox-LDL激活RAW264.7细胞核转录因子-κBp65蛋白表达的影响[J].北京中医药大学学报,2009,32(9):608 -610,648.
[10]黄水清,沈小燕,韩 凌,等.当归补血汤含药血清对ox-LDL激活单核细胞p38 MARK的作用[J].中药新药与临床药理,2010,21(5):458 -461.
[11]李 蕾,张怀勤,尹 娟,等.黄芪对动脉粥样硬化兔骨髓内皮祖细胞生长的影响[J].实用医学杂志,2011,27(7):1154-1156.
[12]周丽昉,康治臣,高长斌.辛伐他汀对兔外周血内皮祖细胞增殖、迁移、黏附能力的影响[J].中国老年学杂志,2011,31(8):1387 -1389.
[13]刘 锟,李 坤,董国华,等.补阳还五汤对外周血内皮祖细胞数量和功能的影响[J].中国组织工程研究与临床康复,2011,15(6):1044 -1049.
[14]Lapidot T,Dar A ,Kollet O.How do stem cells find their way home?[J].Blood,2005,106(6):1901 -1910.
[15]Hristov M,Erl W,Weber PC.Endothelial progenitor cells:mobilization,differentiation,and homing[J].Arterioscler Thromb Vasc Biol,2003,23(7):1185 -1189.
[16]Hristov M,Fach C,Bcker C,et al.Reduced numbers of circulating endothelial progenitor cells in patients with coronary artery disease associated with long-term statin treatment[J].Atherosclerosis,2007,192(2):413-420.

