人Gax基因转染对血管平滑肌细胞增殖、迁移和细胞周期的影响*
郑 辉, 薛 松, 连 锋, 胡振雷, 汪永义
(上海交通大学医学院附属仁济医院心胸外科,上海200127)
冠状动脉旁路移植术(coronary artery bypass grafting,CABG)是目前冠心病治疗的主要手段,但是术后静脉桥再狭窄严重影响了桥血管的远期通畅率,已成为临床上越来越棘手的问题。静脉桥再狭窄的关键病变是内膜增生[1],涉及多种因素,其中血管平滑肌细胞(vascular smooth muscle cells,VSMCs)过度增殖并从中膜向内膜迁移是重要的病理基础,抑制VSMCs增殖和迁移是预防静脉桥再狭窄发生的策略之一。随着分子生物学及其技术的发展,基因治疗逐渐成为防治静脉桥再狭窄的焦点。生长终止特异性同源异型盒基因(growth arrest-specific homeobox gene,Gax)是近年来发现具有调节细胞生物学行为的核转录因子基因,属于同源异型盒基因家族,其通过与启动子或增强子序列相结合,激活或抑制靶基因的表达,实现细胞生长、分化和迁移的基因调控作用[2]。有研究表明Gax基因在VSMCs中的表达模式类似于gas基因(growth arrest-specific gene)、gadd基因(growth arrest and DNA damage-inducible gene),而gas/gadd基因家族对VSMCs增殖和迁移呈负性调节,Gax(hGax)基因这种特殊的表达特性渐渐受到人们的关注,成为血管成形术后再狭窄防治的新靶点。本研究以人Gax(hGax)基因为靶点,构建其重组腺病毒载体并感染兔VSMCs,观察hGax基因过表达对血清刺激后VSMCs增殖、迁移和细胞周期的影响,为静脉桥再狭窄基因治疗提供实验基础。
材料和方法
1 材料
兔血管平滑肌细胞、pEGFP-N1-hGax、大肠杆菌DH5α由本实验室保存,pDC318-mCMV质粒和pPE3质粒由上海第二军医大学钱其军教授惠赠;脂质体Lipofectamine 2000TM和Trizol均购自Invitrogen;限制性内切酶购自NEB;DMEM培养液和胎牛血清购自Gibco;Taq酶和T4 DNA连接酶购自TaKaRa;病毒DNA抽提试剂盒、PCR回收试剂盒和DNA片段纯化试剂盒均购自Qiagen;鼠抗人Gax单克隆抗体购自Abnova;MTT购自Sigma;PI购自上海生工试剂公司;所有引物均由上海博尚生物公司合成。
2 方法
2.1 高表达hGax的腺病毒载体的构建与感染 采用限制性内切酶NheⅠ和Hind III对pEGFP-N1-hGax质粒进行双酶切反应,将酶切产物进行1.5%琼脂糖凝胶电泳,回收并纯化hGax目的基因(片段大小为927 bp);然后将hGax基因片段与经SpeⅠ和Hind III双酶切消化后的pDC318-mCMV质粒通过T4 DNA连接酶进行连接构建成pDC318-mCMV-hGax质粒;转化DH5α大肠杆菌感受态细胞,用氨苄青霉素LB培养基平板进行筛选,孵育过夜后,挑取阳性克隆菌落,摇菌后用碱裂解法提取质粒,分别进行Hinc II和Kpn I、Sac I和Xho I双酶切鉴定;酶切鉴定正确的克隆送至上海博尚生物技术公司进行DNA测序,将完全正确的质粒命名为pDC318-mCMV-hGax;然后将穿梭质粒pDC318-mCMV-hGax与骨架质粒pPE3通过Lipofectamine 2000TM脂质体共转染HEK293细胞以获得含hGax基因的复制缺陷型腺病毒载体,用病毒DNA抽提试剂盒提取腺病毒DNA,PCR法鉴定重组腺病毒载体是否含有hGax基因。hGax基因上游引物 5'-ATGGAACACCCGCTCTTTGGC -3',下游引物 5'- TCATAAGTGCGCATGCTCTGAG -3'。经PCR鉴定正确的重组腺病毒载体命名为Ad5-hGax,即携带人Gax基因的5型复制缺陷型腺病毒重组载体。经扩增、纯化后用Ad5-hGax感染VSMCs,并设阴性对照组(即Ad5-EGFP感染VSMCs)和空白对照组(即PBS感染VSMCs)。
2.2 RT-PCR检测转染VSMCs hGax mRNA的表达 病毒感染细胞48 h后应用Trizol法提取总RNA,测定RNA浓度和A260/A280值,按常规行RTPCR。引物序列:hGax正义链 5'-ACCACCATCACCACCATCATC-3',反义链 5'- TGGAAGAGTTGGAGCACAGG-3',扩增序列长度为174 bp;GAPDH正义链5'-GAACATCATCCCTGCCTCCAC -3',反义链 5'-GCCTGCTTCACCACCTTCTTG -3',扩增序列长度为183 bp。PCR反应条件:95℃预变性3 min,95℃ 45 s,55℃ 1 min,72℃ 2 min,35个循环,72℃ 10 min。PCR产物以1.5%琼脂糖凝胶电泳、显像、拍照。
2.3 免疫荧光染色法检测转染VSMCs hGax蛋白的表达 Ad5-hGax转染VSMCs 48 h后,固定细胞并按常规免疫荧光染色方法进行,Ⅰ抗为1∶400鼠抗人Gax蛋白单克隆抗体,4℃孵育过夜后PBS洗涤。Ⅱ抗为1∶1 000 FITC标记羊抗鼠IgG,37℃避光孵育1h,PBS洗涤后置荧光显微镜下观察。
2.4 Ad5-hGax转染对血清刺激VSMCs增殖的影响 按8×103cells/well接种于96孔板,细胞贴壁后进行干预,分别加入 Ad5-hGax、Ad5-EGFP和PBS液,转染4 h后用PBS液漂洗细胞去除病毒液,然后加入含1%FBS的 DMEM孵育12 h,换成含10%FBS的DMEM,使血清刺激VSMCs。分别于血清刺激 24 h、48 h、72 h、96 h 时,加入 20 μL MTT(5 g/L),37℃继续培养4 h后吸弃孔内培养液,每孔加入150 μL DMSO,振荡10 min使甲瓒结晶完全溶解,酶标仪上以波长570 nm检测各孔吸光度(A值)。抑制率(%)=(1-实验组平均A值/空白对照组平均A值)×100%。
2.5 Ad5-hGax转染对血清刺激VSMCs迁移的影响 取对数生长期VSMCs接种于培养皿,调整细胞浓度以致第2 d覆盖达到约90%,实验分组和病毒感染过程如上述,在培养皿底部做一直线标记,用无菌枪头在无菌条件下沿标记线作划痕,PBS液漂洗后加入含1%FBS的DMEM,孵育12 h后重新加入含10%FBS的DMEM,置37℃、5%CO2孵箱培养,分别于24 h、48 h、72 h后各组镜下随机选取10个视野进行拍摄,测量两边细胞迁移边缘之间的距离即划痕宽度,取均值。
2.6 Ad5-hGax转染对血清刺激VSMCs周期的影响 将VSMCs接种于培养皿,实验分组、病毒感染和血清刺激方法同MTT实验部分。血清刺激72 h后,消化并收集各组细胞,用4℃ 70%乙醇固定,RNA酶37℃下消化30 min,PI避光染色,300目筛网过滤后样本加入流式细胞仪分析细胞周期。
3 统计学处理
结 果
1 含hGax基因的复制缺陷型腺病毒重组载体的鉴定
经Sac I和 Xho I双酶切,pDC318-mCMV-hGax质粒切出319 bp、791 bp和3 728 bp 3条片段,与预期的酶切结果完全相符,见图1。经Hinc II和Kpn I双酶切,pDC318-mCMV-hGax质粒切出401 bp、596 bp、1 846 bp 和1 995 bp 4 条片段,与预期结果完全相同,见图2。DNA测序结果示pDC318-mCMV-hGax质粒中的人Gax基因序列与GenBank中公布的基因序列基本一致。PCR产物凝胶电泳图示在927 bp的位置上出现特异性条带,与预期的hGax基因片段大小相符,见图3。说明成功构建了含hGax基因的复制缺陷型腺病毒重组载体。
2 RT-PCR分析
琼脂糖凝胶电泳图示,Ad5-hGax转染的VSMCs中hGax mRNA表达呈阳性条带(174 bp),而Ad5-EGFP转染组无相应阳性条带,表明在mRNA水平上目的基因hGax成功转染入VSMCs,见图4。
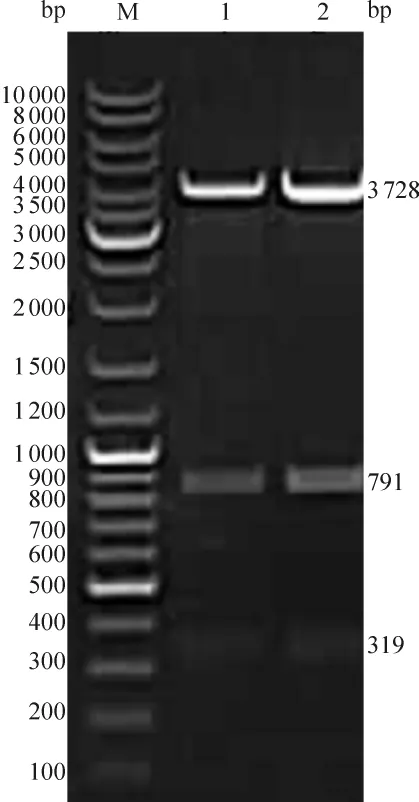
Figure 1.The double digestion identification of pDC318-mCMV- hGax.M:DNA marker;Lane 1,2:Sac I and Xho I digestion.图1 pDC318-mCMV-hGax质粒的Sac I和Xho I双酶切鉴定
3 免疫荧光染色分析
Ad5-hGax转染48 h后,免疫荧光染色结果示VSMCs内呈红色阳性表达,尤以胞核为主,即为hGax蛋白,而对照组细胞内未见相应的染色,提示VSMCs经Ad5-hGax转染后有外源性hGax蛋白过表达,见图5。

Figure 4.RT-PCR result of the hGax mRNA expression.M:DNA marker;Lane 1:Ad5-EGFP-transfected cells;Lane 2:Ad5-hGax-transfected cells.图4 hGax mRNA表达的RT-PCR检测结果
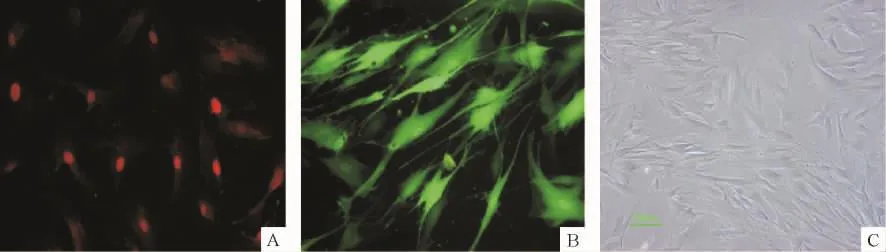
Figure 5.The hGax protein expression in the Ad5-hGax-transfected cells.A:hGax protein expression in the cells 48 h after Ad5-hGax transfection under fluorescent microscope(×100);B:EGFP protein expression in the cells 48 h after Ad5-EGFP transfection(negative control group)under fluorescent microscope(×100);C:VSMCs 48 h after PBS treatment(blank control group)under inverted microscope(×100).图5 hGax蛋白在Ad5-hGax转染后的细胞中表达
4 细胞增殖分析
MTT法结果表明(表1),Ad5-hGax转染组中血清刺激后VSMCs体外增殖受到明显抑制,与阴性对照组和空白对照组(各时点为0)相比有显著差异(P<0.05),且随培养时间的延长细胞生长抑制率升高,见图6,而阴性对照组和空白对照组之间无显著差异,说明hGax基因过表达能显著抑制血清刺激后兔VSMCs增殖。
表1 hGax蛋白对血清刺激后VSMCs增殖的影响Table 1.Effect of hGax protein expression on the proliferation of serum-induced VSMCs in different groups at different time points(±s.n=5)
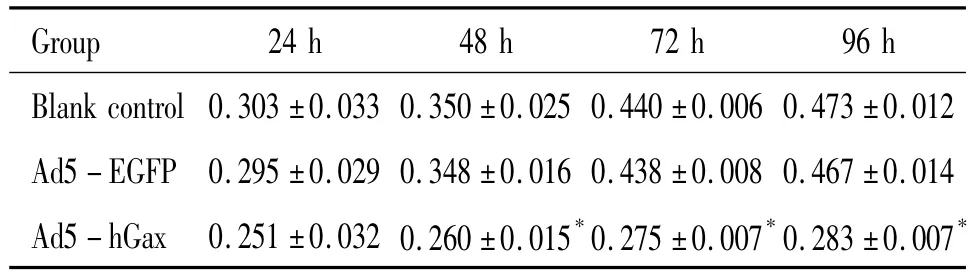
表1 hGax蛋白对血清刺激后VSMCs增殖的影响Table 1.Effect of hGax protein expression on the proliferation of serum-induced VSMCs in different groups at different time points(±s.n=5)
*P<0.05 vs blank control group and Ad5-EGFP group.
Group 24 h 48 h 72 h 96 h Blank control 0.303 ±0.033 0.350 ±0.025 0.440±0.006 0.473 ±0.012 Ad5 -EGFP 0.295 ±0.029 0.348 ±0.016 0.438 ±0.008 0.467 ±0.014 Ad5 -hGax 0.251 ±0.032 0.260 ±0.015*0.275 ±0.007*0.283 ±0.007*

Figure 6.Effect of hGax overexpression on proliferation inhibitory rates of serum-induced rabbit VSMCs at different time points.±s.n=3.*P<0.05 vs 24 h.图6 hGax基因过表达对血清刺激后兔VSMCs生长抑制率的影响
5 细胞迁移分析
划痕法检测结果显示(表2),0 h时划痕宽度均为(450.81 ±7.17)μm,空白对照组中划痕宽度在不同时点上与阴性对照组相比差异无显著,Ad5-hGax转染组的划痕宽度较对照组明显延长(P<0.05),即该组细胞的迁移能力显著减弱,说明hGax基因过表达能显著抑制血清刺激后兔VSMCs迁移。
表2 hGax基因过表达对血清刺激后兔VSMCs迁移的影响Table 2.Effect of hGax gene overexpression on the migration of serum-induced rabbit VSMCs(μm.±s.n=10)

表2 hGax基因过表达对血清刺激后兔VSMCs迁移的影响Table 2.Effect of hGax gene overexpression on the migration of serum-induced rabbit VSMCs(μm.±s.n=10)
*P<0.05 vs blank control group and Ad5-EGFP group.
Group 24 h 48 h 72 h Blank control 265.548 ±12.498 225.582 ±7.961167.385 ±9.790 Ad5 -EGFP 260.548 ±11.498 222.582 ±8.761 164.385 ±7.790 Ad5 -hGax 361.643 ±9.730* 317.582 ±9.901*289.385 ±10.783*
6 流式细胞仪分析
流式检测结果显示,血清刺激72 h后,Ad5-hGax转染组中G0/G1期VSMCs比例增高,G2/M+S期细胞减少,与空白对照组和阴性对照组相比差异显著;而阴性对照组和空白对照组之间无显著差异,见表3、图7。
表3 hGax基因过表达对血清刺激后兔VSMCs细胞周期分布的影响Table 3.The effects of hGax gene overexpression on cell cycle distribution of serum-induced rabbit VSMCs(%.±s.n=3)

表3 hGax基因过表达对血清刺激后兔VSMCs细胞周期分布的影响Table 3.The effects of hGax gene overexpression on cell cycle distribution of serum-induced rabbit VSMCs(%.±s.n=3)
*P<0.05 vs blank control group and Ad5-EGFP group.
Group G0/G1 G2/M+S Blank control 44.17 ±2.0555.83 ±2.05 Ad5 - EGFP 42.57 ±2.4557.43 ±2.45 Ad5 - hGax 66.65 ±3.75*33.35 ±3.75*

Figure 7.Effect of adenovirus- mediated hGax gene transfection on cell cycle of induced rabbit VSMCs.图7 Ad5-hGax转染对血清刺激后兔VSMCs细胞周期的影响
讨 论
静脉桥再狭窄实质上是自体大隐静脉为适应动脉循环中的压力而发生的血管重塑。Manabe等[3]研究表明VSMCs是新生内膜的主要成分之一,其异常增殖和迁移在移植血管病理性重塑过程中起重要作用。胎牛血清作为一种复合型的营养物质,主要含有血小板源生长因子、碱性成纤维生长因子和溶血磷脂酸等成分,血小板源生长因子作为VSMCs的促丝分裂剂和趋化剂,对血管增殖性病变起重要作用[4];碱性成纤维生长因子可刺激血管内皮细胞和VSMCs增殖。本实验应用血清刺激体外培养的VSMCs模型来模拟部分体内过程,对于防治静脉桥再狭窄的研究具有重要意义。
同源盒基因在核苷酸序列水平上含有一段约180 bp的高度保守序列,编码60个氨基酸,称为同源结构域,其中含有的螺旋-转角-螺旋结构可识别以5’-TAAT-3’为核心10~12 bp的 DNA序列,并且与DNA形成特异性结合,而其N-末端臂与DNA小沟的接触能起到稳定结合的作用。同源盒基因编码的蛋白通过这种结合方式对下游靶基因的表达进行调节,从而控制细胞生长、分化。Gax基因是Gorski等[5]在1993年克隆出1个主要存在于心血管系统的同源盒基因,其编码蛋白是一种转录因子。除保守的同源结构域外,Gax蛋白含有特殊的CAX重复结构,其对细胞增殖和分化的调节具有重要作用。Gax基因高表达于静止期血管内皮细胞和VSMCs。Liu等[6]研究发现血管外膜成纤维细胞正常状态下表达Gax蛋白,并且Gax基因过表达可显著减少S期细胞,增加G0-G1期细胞,从而抑制其增殖;经研究验证在丝裂原刺激或血管损伤后VSMCs中的 Gax 基因表达迅速下降[5,7],表明 Gax 基因在维持非增殖状态VSMCs中起重要调节作用;Yamashita等[8]研究表明Gax是血管紧张素Ⅱ和C型钠尿肽调节VSMCs增殖信号转导通路中的共同转录因子,前者表现为促进VSMCs增殖,后者则抑制VSMCs增殖;此外,细胞表型转化是血管增生性疾病中VSMC增殖和迁移的关键起始步骤[9],因而维持收缩型 VSMCs显得至关重要,Markmann等[10]报道Gax是调节VSMCs收缩型与合成型之间相互转化的重要调节基因之一。
为明确Gax基因对血清刺激后VSMCs增殖、迁移和周期的影响,通过过表达Gax基因,检测细胞增殖、迁移和周期的变化是可行的有效方法,这将为以Gax基因作为候选基因,进行静脉桥再狭窄基因治疗提供一定的实验依据。同时,基于复制缺陷型腺病毒载体的优势和对VSMCs具有高亲和性[11],作为介导血管系统的过表达载体比较理想。通过复制缺陷型腺病毒介导的Gax基因可能是静脉桥再狭窄防治的有效方法。本研究中,通过含hGax基因复制缺陷型腺病毒过表达载体转染 VSMCs,转染48 h后,hGax在mRNA水平上和蛋白水平上均有显著表达,说明转染成功,导入的目的基因hGax在VSMCs内成功表达。
本实验通过MTT法检测各组血清刺激后VSMCs的增殖活性,结果显示,Ad5-hGax转染组中的VSMCs生长速度明显减慢,与对照组相比具有统计学差异,并且随着血清刺激时间的延长而降低。Gorski等[12]研究表明Gax基因可通过激活细胞周期蛋白激酶抑制剂P21活性来抑制人脐静脉内皮细胞增殖。细胞增殖是由细胞周期控制的[13]。本实验应用流式细胞仪检测转染72 h后细胞周期变化的结果显示,Ad5-hGax转染组中G0/G1期细胞显著多于对照组,G2/M+S期明显减少,统计学上差异显著,提示Gax基因过表达可能通过细胞周期限制点使VSMCs处于静止期来抑制细胞增殖。
本研究的划痕实验结果显示hGax基因过表达可明显抑制血清刺激后VSMCs迁移,与对照组比较有统计学差异,而阴性对照组和空白对照组之间无显著差异。VSMCs迁移涉及细胞表型转化、局部黏附激酶、细胞骨架蛋白等多种因素。Witzenbichler等[14]研究发现 Gax 基因通过抑制整合素 αγβ3、αγβ5表达来调节化学趋化因子诱导的 VSMCs迁移。但是Gax基因对VSMCs迁移抑制效应所通过的信号转导通路目前尚无定论,仍需更深一步研究。
总之,本研究将含hGax基因的重组腺病毒载体感染兔VSMCs,获得过表达hGax基因的VSMCs。通过对细胞增殖、迁移和细胞周期的研究发现:腺病毒介导的hGax基因过表达能有效抑制血清刺激后VSMCs的增殖和迁移;这可能通过阻滞细胞周期进展来实现。
[1]Muto A,Model L,Ziegler K,et al.Mechanisms of vein graft adaptation to the arteria circulation:insights into the neointimal algorithm and management strategies[J].Circ J,2010,74(8):1501-1512.
[2]Patel S,Leal AD,Gorski DH.The homeobox gene Gax inhibits angiogenesis through inhibition of nuclear factorκB - dependent endothelial cell gene expression[J].Cancer Res,2005,65(4):1414 -1424.
[3]Manabe I,Nagai R.Regulation of smooth muscle phenotype[J].Curr Atheroscler Rep,2003,5(3):214 -222.
[4]Li J,Huang SL,Guo ZG.Platelet derived growth factor stimulated vascular smooth muscle cell proliferation and its molecular mechanism[J].Acta Pharmacol Sin,2000,21(4):340-344.
[5]Gorski DH,Lepage DF,Patel CV,et al.Molecular cloning of a diverged homeobox gene that is rapidly down-regulated during the G0/G1transition in vascular smooth muscle cells[J].Mol Cell Biol,1993,13(6):3722 -3733.
[6]Liu P,Zhang C,Feng JB,et al.Cross talk among Smad,MAPK,and integrin signaling pathways enhances adventitial fibroblast functions activated by transforming growth factor- β1 and inhibited by Gax[J].Aterioscler Thromb Vasc Biol,2008,28(4):725 -731.
[7]Weir L,Chen D,Pastore C,et al.Expression of Gax,a growth arrest homeobox gene,is rapidly down-regulated in the rat carotid artery during the proliferative response to balloon injury[J].J Biol Chem,1995,270(10):5457-5461.
[8]Yamashita J,Itoh H,Ogawa Y,et al.Opposite regulation of Gax homeobox expression by angiotension II and C-type natriuretic peptide[J].Hypertension,1997,29(1 Pt 2):381 -387.
[9]周志斌,张志珺.溶血磷脂酸与血管平滑肌细胞表型转化[J].中国病理生理杂志,2009,25(6):1228-1231.
[10]Markmann A,Rauterberg J,Vischer P,et al.Expression of transcription factors and matrix genes in response to serum stimulus in vascular smooth muscle cells[J].Eur J Cell Biol,2003,82(3):119 -129.
[11]Kremer EJ,Perricaudet M.Adenovirus and adeno-associated virus mediated gene transfer[J].Br Med Bull,1995,51(1):31 -44.
[12]Gorski DH,Alejandro J,Leal BS.Inhibition of endothelial cell activation by the homeobox gene Gax[J].J Surg Res,2003,111(1):91 -99.
[13]Tanner FC,Yang ZY,Duckers E,et al.Expression of cyclin - dependent kinase inhibitors in vascular disease[J].Circ Res,1998,82(3):396 -403.
[14]Witzenbichler B,Kureishi Y,Luo Z,et al.Regulation of smooth muscle cell migration and integrin expression by the Gax transcription factor[J].J Clin Invest,1999,104(10):1469-1480.

