丹参酮ⅡA对豚鼠肥厚心肌延迟整流钾通道的影响*
唐 昱, 盛国太, 葛郁芝, 王云霞, 曹乾强, 周裔忠, 张繁之
(1江西省人民医院心内科,2江西省心血管病研究所,江西南昌330006)
肥厚心脏不仅表现在心脏结构的改变,还可存在明显的电生理特性改变,因此,探究心肌中其主导地位的钾离子通道间的相互作用,在认识心肌细胞电生理和进行心律失常治疗方面具有重大意义[1]。丹参酮ⅡA(tanshinoneⅡA)是我国传统中药丹参的水溶性衍生物,具有抑制血小板黏附聚集、抗血栓形成、改善微循环、抗心肌缺血缺氧等功效,临床上主要用于冠心病的治疗,而有关抗心律失常作用的报道较少。本实验通过采用全细胞膜片钳技术,研究丹参酮ⅡA对肥厚心肌细胞快激活延迟整流钾电流(the rapidly activating component of the delayed rectifier K+current,IKr)和慢激活延迟整流钾电流(the slowly activating component of the delayed rectifier K+current,IKs)的影响,旨在从离子通道水平探讨丹参酮ⅡA的抗心律失常作用机制,为肥厚心肌心律失常的防治提供新的理论依据。
材料和方法
1 材料
1.1 动物与试剂 60只健康雄性豚鼠,体质量250~300 g(由南昌大学医学院实验动物中心提供)。丹参酮ⅡA磺酸钠注射液(武汉生化药业有限公司,批号为080520),缬沙坦(北京诺华制药有限公司)。
1.2 仪器 彩色多普勒超声诊断仪(惠普公司);倒置显微镜(北京科乐公司);膜片钳仪微电极(上海奥尔科特生物科技有限公司);电极拉制仪(华科大仪博生命科学仪器有限公司);Axopatch 200B膜片钳放大器(Axon);DigiData 1200B型数/模(或模/数)转换器(Axon)。
1.3 溶液配制 (1)台式液(mmol/L):NaCl 136、KCl 5.4、MgCl21.0、NaH2PO40.33、CaCl21.8、HEPES 10、glucose 10,用 NaOH 调节 pH 至7.4。配制时不加CaCl2即为无钙台氏液。(2)KB液(mmol/L):KCl 40、KH2PO425、MgSO43.0、KOH 80、L-谷氨酸 50.3、牛磺酸 20、HEPES 10、glucose 10、EGTA 0.5,用KOH调节pH至7.4。记录IKr时的细胞外液即为台氏液。(3)记录IKs时的细胞外液(mmol/L):NaCl 135、KCl 3.0、MgCl21.0、NaH2PO40.33、CaCl21.8、HEPES 10、glucose 10,用 NaOH 调节 pH 至7.4。(4)电极内液(mmol/L):天门冬氨酸钾120、KCl 20、HEPES 5、MgCl21.0、K2-ATP 4、EGTA 10、磷酸肌酸二钠2.0,用KOH调pH到7.3。
2 方法
2.1 模型制作 分离腹主动脉和肾动脉后,在肾动脉上方约1 cm处的腹主动脉,用7号注射针头紧贴腹主动脉,平行放置,结扎,抽出注射针头逐层缝合肌肉及皮肤。其中12只行假手术,分离腹主动脉后不结扎。
2.2 血压的测量 将实验豚鼠装入固定盒内固定,尾部通过加压套插入至接近尾根部,使鼠尾刚好处于脉搏传感器的“脉搏信号传感片”上方,调节鼠尾压迫片使传感片紧贴鼠尾下方的尾动脉,待脉搏稳定后进行血压测量。
2.3 实验分组及给药方式 12只行假手术的豚鼠为假手术组(A组)。48只成功建立心肌肥厚模型的豚鼠在术后4周随机分为4组:未治疗的肥厚模型组(B组)、低剂量丹参酮ⅡA组(10 mg·kg-1·d-1,C 组)、高剂量丹参酮ⅡA 组(20 mg·kg-1·d-1,D 组)和缬沙坦组(10 mg·kg-1·d-1,E 组),每组各12只。给药方式:采用腹腔注射,其中未治疗的肥厚模型组和假手术组分别以等体积的蒸馏水腹腔注射。
2.4 心肌细胞分离 药物干预8周后,开胸行在体主动脉插管,在通氧(95%O2,5%CO2)和保持37℃恒温的条件下进行Langendorff灌流。用无钙台氏液[KCl 5.5、MgCl20.4、NaCl 140、NaH2PO40.33、HEPES 5、glucose 5.5(pH 7.4,NaOH)]逆行灌流3 ~5 min(压力70 mmHg),再用含0.4 g/L I型胶原酶、0.2 g/L蛋白酶 E、0.25 g/L小牛血清蛋白和80 μmol/L Ca2+的台氏液循环灌流15 min后,然后用无钙Tyrode液冲洗。剪去心房,用无酶的无钙液终止酶解后取心室肌称重,计算心室/体重比率(ventricle/weight ratio,VWR);再将心室肌在 KB液(KCl 40、KOH 70、KH2PO420、MgCl23、HEPES 10、EGTA 0.5、glucose 10、L-glumatic acid 50及 0.5%牛血清白蛋白)中室温留置2 h备用。
2.5 膜片钳全细胞记录 选取纹理清晰、杆状和大小适中的细胞在室温下(22~25℃)应用标准全细胞膜片钳进行电生理数据收集。微电极经垂直拉制仪拉制而成,充灌电极内液后使电极阻抗保持在2~5 MΩ。采用微电极操纵器将电极缓慢推向细胞,同时给电极加约10 cmH2O正压,当电极贴紧细胞膜后给电极加10~20 cmH2O负压,吸引数秒钟使电极尖端与细胞膜表面形成1 GΩ以上高阻封接,信号经Ag/AgCl电极引导,由膜片钳放大器放大。在电流稳定后开始记录实验数据。记录的电流值以电流密度(pA/pF)表示以消除细胞间误差。
3 统计学处理
结 果
1 各实验组血压测定
建立心肌肥厚模型组4周后测定血压,本实验发现,与假手术组血压(123±8)mmHg相比较,各手术模型组的血压波动于(160±10)mmHg,具有统计学意义(P<0.01),各手术模型组间血压无显著差异(P >0.05)。
2 肥厚心肌病理生理改变
与A组相比,B、C、D和E组心室重量/体重比(ventricular weight/body weight,VW/BW)、左心室重量(left ventricular weight,LVM)和左室游离壁厚度(left ventricular free wall,LVFW)均升高(P <0.01);与B组相比,C、D和E组VW/BW、LVM和LVFW下降(P <0.01),见表1。
3 各实验组心肌细胞电生理变化
与A组相比,B组动作电位时程(action potential duration,APD)明显延长;而 C、D、E组的心肌细胞APD较肥厚组明显缩短(P<0.01);与A组相比,B组膜电容(membrane capacitance,MC)增加;而与B组相比,C组、D和E组的心肌细胞MC降低(P<0.01),见表 2。
表1 各实验组左心室重量、左室游离壁厚度和心室重量/体重的比较Table 1.The LVM,LVFW and VW/BW in each experimental group(±s.n=12)
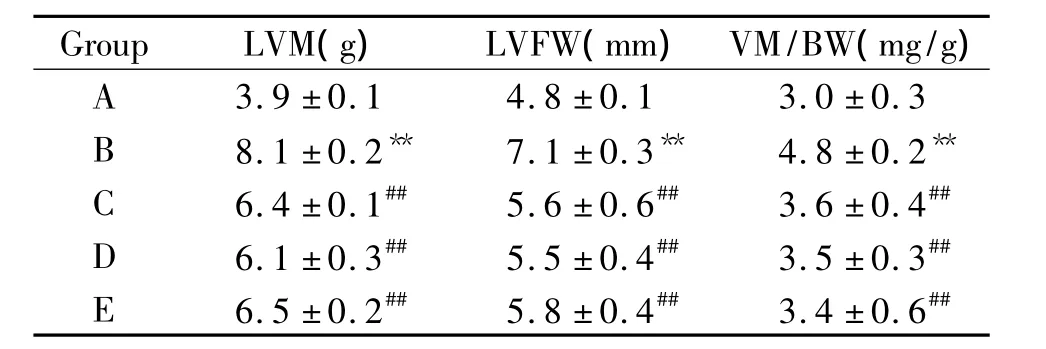
表1 各实验组左心室重量、左室游离壁厚度和心室重量/体重的比较Table 1.The LVM,LVFW and VW/BW in each experimental group(±s.n=12)
**P<0.01 vs group A;##P <0.01 vs group B.A:control;B:model;C:tanshinone ⅡA 10 mg·kg-1·d-1;D:tanshinoneⅡA 20 mg·kg-1·d-1;E:valsartan 10 mg·kg-1·d-1.
Group LVM(g) LVFW(mm)VM/BW(mg/g)A 3.9 ±0.1 4.8 ±0.1 3.0 ±0.3 B 8.1 ±0.2** 7.1 ±0.3** 4.8 ±0.2**C 6.4 ±0.1## 5.6 ±0.6## 3.6 ±0.4##D 6.1 ±0.3## 5.5 ±0.4## 3.5 ±0.3##E 6.5 ±0.2## 5.8 ±0.4## 3.4 ±0.6##
表2 各实验组的动作电位时间和膜电容变化Table 2.The action potential duration and membrane capacitance in each experimental group(±s.n=12)

表2 各实验组的动作电位时间和膜电容变化Table 2.The action potential duration and membrane capacitance in each experimental group(±s.n=12)
##P <0.01 vs group A;△△P <0.01 vs group B.
Group APD25(ms) APD50(ms) APD75(ms) APD90(ms) MC(pF)A 6.2 ±0.1 15.8 ±2.4 20.4 ±4.6 38.6 ±2.9 246 ±17 B 16.9 ±1.8## 75.7 ±3.0## 90.3 ±10.5## 123.7 ±12.8## 391 ±14##C 9.2 ±0.4△△ 20.8 ±3.6△△ 43.2 ±3.7△△ 50.8 ±7.9△△ 279 ±10△△D 7.1 ±0.3△△ 17.6 ±2.5△△ 31.3 ±4.0△△ 40.6 ±4.2△△ 258 ±11△△E 9.4 ±0.3△△ 20.2 ±1.9△△ 40.1 ±5.8△△ 51.2 ±6.4△△ 280 ±16△△
4 IKr及其尾电流 IKr-tail的测定
为排除干扰电流的影响,细胞外液中加入5 μmol/L硝苯地平 (ICa-L,特异性阻断剂)和 30 μmol/L二乙酰醇293B(IKs特异性阻断剂)以阻断Ica-L和 IKs。钳制电位(holding potential,HP)为-50 mV,去极化至-10 mV,5 000 ms的去极化脉冲,分别记录各实验组的IKr及IKr-tail电流(n=5)。与A组相比较,B 组 IKr及 IKr-tail电流均增强,而 C、D 和 E 组IKr及 IKr-tail电流比 B 组显著降低(P <0.05),C、D、E组间无显著差异(P>0.05),见图1、表3。
5 IKs及其尾电流 IKs-tail的测定
细胞外液中加入 5 μmol/L 硝苯地平(ICa-L,特异性阻断剂)和100 μmol/L多菲利特(IKr特异性阻断剂)以阻断ICa-L和IKr。从-40 mV去极化至 +80 mV,5 000 ms的去极化脉冲,分别记录各实验组的IKs及 IKs-tail电流(n=5)。与 A 组相比较,B 组 IKs及IKs-tail电流均增强,C、D 和 E 组心肌细胞 IKs及 IKs-tail比B组显著降低(P<0.05),见图2、表3。
讨 论
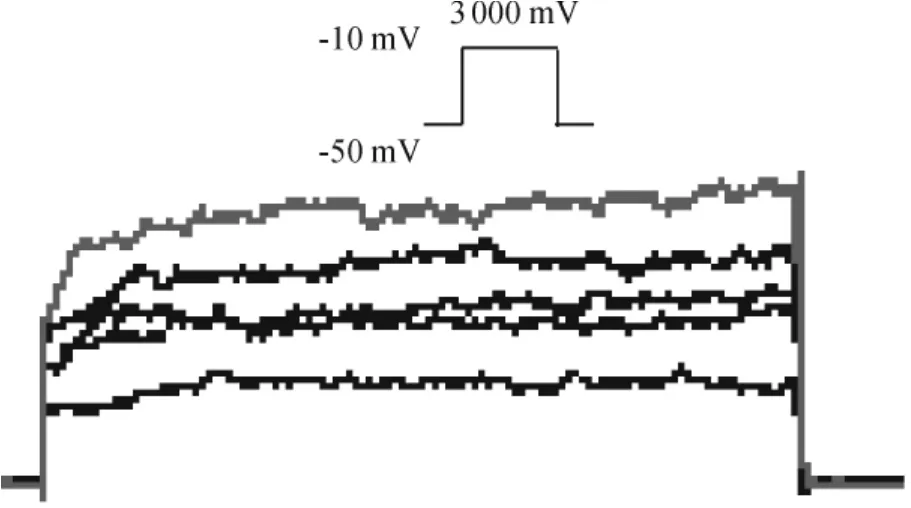
Figure 1.The IKrchanges of cardiomyocytes in each experimental group.图1 各实验组IKr的变化
心肌肥厚是心肌细胞对各种内在和外在刺激引起的负荷过重的一种适应和代偿性反应。当负荷超过一定界限时,心脏结构、功能和离子通道均可发生变化,不仅心肌细胞肥大和间质成分发生改变,还可导致心肌细胞膜上多种跨离子电流的异常改变,其APD延长,诱发严重的心律失常和心源性猝死[2-3]。本研究通过结扎腹主动脉制作心肌肥厚模型,证实肥厚心肌LVM、LVFW和VM/BW升高,APD明显延长,这与文献报道一致[4]。

Figure 2.The IKschanges of cardiomyocytes in each experimental group.图2 各实验组IKs的变化
表3 各实验组IKr、IKs及其尾电流的变化Table 3.The changes of IKr,IKs,IKr-tailand IKs-tail in each experimental group(pA/pF.±s.n=12)

表3 各实验组IKr、IKs及其尾电流的变化Table 3.The changes of IKr,IKs,IKr-tailand IKs-tail in each experimental group(pA/pF.±s.n=12)
*P <0.05 vs group A;△P <0.05 vs group B.
Group IKr IKr-tail IKs I Ks-tail A 1.28 ±0.09 1.49 ±0.20 5.98 ±1.09 0.69 ±0.14 B 1.89 ±0.10* 2.14 ±0.16* 11.59 ±1.11* 1.13 ±0.13*C 1.45 ±0.12△ 1.71 ±0.19△ 7.85 ±1.05△ 0.88 ±0.13△D 1.39 ±0.11△ 1.67 ±0.14△ 7.76 ±1.04△ 0.81 ±0.12△E 1.46 ±0.13△ 1.73 ±0.20△ 7.87 ±1.08△ 0.90 ±0.16△
心肌细胞动作电位的形成是细胞膜上多种离子通道顺序开关综合作用的结果,任何离子通道电流的异常均可影响正常动作电位的形成,导致各种心律失常的发生[5]。IKr是钾通道基因编码的延迟整流钾电流的快成分,开放时间非常短,而关闭的时间则相对较长,对调节心肌细胞动作电位2相平台期的终止及3相复极化具有重要的意义[6]。IKs是动作电位复极的重要组成部分,其基因表达异常可使得外向复极电流减少,细胞动作电位时程延长[7]。IKr和IKs对调节心肌细胞动作电位平台期和复极化具有重要意义[8-9]。研究表明,病变心肌 IKr和 IKs明显增强,可由折返机制形成快速性心律失常,易发生心室纤颤,增加心源性猝死的危险性。本实验观察到与假手术组相比较,肥厚心肌IKs和IKs及其尾电流均增大,具有致心律失常性离子通道病变的基础[10]。
心肌钾离子通道在电生理学研究方面取得了许多新进展,人们开始怀疑钾离子通道能否成为抗心律失常药物有益的作用靶点。于锋等[11]采用L-甲状腺素诱发豚鼠心肌病模型,发现盐酸小檗碱明显阻断肥厚心肌细胞中异常增大的IKr和IKs,为药物研发和临床应用提供了有利的依据。中医药学具有我国的传统和特色,人们在长期的临床实践中,发现许多中药具有抗心律失常及潜在的预防猝死作用。丹参酮IIA是中药丹参的提取物,具有异搏停L型钙通道阻断作用,清除自由基,抗动脉粥样硬化,降低心肌耗氧量,抑菌和抗肿瘤等作用[12]。王照华等[13]报道丹参酮能够在抗心肌肥厚的同时通过减少ICa和恢复Ito钾离子通道的活性,起到预防心律失常的作用。本实验发现丹参酮ⅡA和缬沙坦都能显著缩短肥大心肌细胞动作电位时间的延长,抑制肥厚心肌细胞上增大的IKr和IKs电流密度。但不同剂量丹参酮之间无统计学意义,这可能与本实验观测的时点有关,具体还需要深入研究加以证实。心肌动作电位形成是多种离子通道共同参与的过程,决定复极过程的时程通道电流,主要有Ito、ICa、IKr和 IKs等。本实验研究结果提示丹参酮对动作电位时程的影响,可能比较复杂,可能通过多通道阻断整合发挥作用。研究表明血管紧张素Ⅱ1型受体拮抗剂如缬沙坦等药物可通过降低上游损失从而减轻与心肌重构和跨膜信号转导通路系统异常等相关的离子通道病[14]。但是丹参酮ⅡA是否通过类似的机制的对肥厚心肌动作时程的整合作用,有待进一步研究。
[1] Lakdawala NK,Givertz MM.Dilated cardiomyopathy with conduction disease and arrhythmia[J].Circulation,2010,122(5):527-534.
[2] Furushima H,Chinushi M,Iijima K,et al.Ventricular tachyarrhythmia associated with hypertrophic cardiomyopathy:incidence,prognosis,and relation to type of hypertrophy[J].J Cardiovasc Electrophysiol,2010,21(9):991-999.
[3] Moon J,Rim SJ,Cho IJ,et al.Left ventricular hypertrophy determines the severity of diastolic dysfunction in patients with nonvalvular atrial fibrillation and preserved left ventricular systolic function[J].Clin Exp Hypertens,2010,32(8):540-546.
[4] 张振英,刘秀华,孙 胜,等.C/EBP同源蛋白介导的内质网应激相关凋亡途径参与腹主动脉狭窄致大鼠心肌肥厚[J].生理学报,2009,61(2):161-168.
[5] Fatkin D,Otway R,Richmond Z .Genetics of dilated cardiomyopathy[J].Heart Fail Clin,2010,6(2):129-140.
[6] Stengl M,Ramakers C,Donker DW,et al.Temporal patterns of electrical remodeling in canine ventricular hypertrophy:focus on IKsdownregulation and blunted β-adrenergic activation [J].Cardiovasc Res,2006,72(1):90-100.
[7] Li Y,Lu ZY,Xiao JM,et al.Effect of imidapril on heterogeneity of slow component of delayed rectifying K+current in rabbit left ventricular hypertrophic myocytes[J].Acta Pharmacol Sin,2003,24(7):681-686.
[8] Osteen JD,Sampson KJ,Kass RS.The cardiac IKschannel,complex indeed[J].Proc Natl Acad Sci U S A,2010,107(44):18751-18752.
[9] 王 冰,曹颜秀,洪 远,等.心脏复极储备电流IKs在糖尿病QT间期延长性别差异中的作用[J].中国病理生理杂志,2011,27(1):124-128.
[10] Ehrlich JR.Cardiac delayed rectifiers--together as one?A patho-physiologically relevant interaction between IKrand IKs[J].Heart Rhythm,2010 ,7(7):981-982.
[11] 于 峰,林木森,张伟东.盐酸小檗碱对甲状腺素性豚鼠心肌细胞中IKr、IKs和Ik1的抑制作用[J].中国药科大学学报,2009,40(3):244-249.
[12] 杨 征,邱 敏.丹参酮ⅡA的心血管作用及机制研究进展[J].中国动脉硬化杂志,2011,19(4):372-374.
[13] 王照华,郑 智,梁黔生,等.丹参酮对肥厚心肌中电生理异常的干预[J].中华急诊医学杂志,2008,17(10):1039-1044.
[14] 梁振涛,王宪沛,曾秋棠,等.厄贝沙坦对电压依赖性的Kv1.3和Kv1.5通道电流的阻断作用[J].中国心脏起搏与心电生理杂志,2008,22(5):427-430.
——从一道浙江选考生物学试题谈起

