“种植窗”时期人类子宫内膜组织差异蛋白质表达谱的初步研究*
谭 真,李 洁,黎明涛,刘 炜,于文娟#,夏婷婷
(中山大学1附属第一医院生殖医学中心,2中山医学院研究中心蛋白质组学,广东广州510080)
“种植窗”时期子宫内膜形态与功能的及时转换是胚胎着床与母胎界面形成的关键。长期以来,临床工作中主要通过超声测定内膜厚度与形态以及血清激素水平评价子宫内膜的功能状态。然而血清雌、孕激素水平与子宫内膜发育并不完全同步,内膜的厚度与形态也不能准确说明其形态学改变。既往研究报道的子宫内膜上皮细胞吞饮泡、整合素αVβ3、白血病抑制因子、血管内皮生长因子的表达可以部分地反映子宫内膜对胚胎的接受性[1-2]。但至今为止,还未能找到更完整的、能动态反映子宫内膜对胚胎接受性变化的方法。
近年来基因芯片技术在人类子宫内膜研究的结果表明:“种植窗”时期存在多个基因表达的上调和下调[3-5]。然而关于功能基因蛋白质组群的表达和研究还未见报道。我们选择正常生育能力妇女,采用荧光差异凝胶电泳(two-dimensional fluorescence difference gel electrophoresis,2D -DIGE)和基质辅助激光解吸/电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF-MS)为主的蛋白质组学技术、Western blotting技术鉴定和分析子宫内膜组织蛋白质表达的变化,并查找文献进行差异表达蛋白质功能的聚类分析,从整体水平、连续、动态地探讨子宫内膜对胚胎接受性转化过程中的分子生物学基础。
材料和方法
1 材料来源
2005年9月~2006年2月募集有正常生育能力的女性志愿者4名并签署知情同意书,年龄分别为30、30、32、33岁。采用经阴道超声检测卵泡发育结合血、尿黄体生成素(luteinizing hormone,LH)激素测定。以血清LH>20 IU/L或基础值4倍确定为LH峰值日。分别于同一妇女同一月经周期“种植窗”前期(LH+2 d)和“种植窗”时期(LH+7 d),采用Wallace endometrial sampler先后进行2次微创组织活检,获取子宫腔前、后壁内膜组织约0.2~0.4 g作为自身对照实验材料。一部分组织行HE染色进行组织形态学和雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)测定评估,根据Noveys标准确定组织学分期。另一部分组织经裂解、匀浆、离心、纯化、浓度测定后用于蛋白质组学差异表达和Western blotting半定量分析。
2 方法
2.1 2D-DIGE 荧光染料CyDyes标记样品蛋白(荧光标记试剂盒,Amersham Biosciences),进行一向等电聚焦电泳和二向十二烷基磺酸钠-聚丙烯酰胺凝胶电泳。激光扫描仪扫描成像,DeCyder软件进行图像分析,定量蛋白丰度差异,确定差异表达蛋白质斑点。根据以下3个标准:(1)比较LH+2 d和LH+7 d蛋白斑点的差异,进行t-test,P<0.05;(2)灰度差异>1.40倍;(3)同一蛋白在12个蛋白表达谱中出现≥10次,选取斑点作为入选的差异斑点。进一步删除三维图中无凸起、脱尾、与局部未入选斑点比较变化趋势相同的斑点后确认将进入质谱分析的差异表达斑点,并在2张制备胶选中和标记相应斑点,建立切点目录。
2.2 质谱分析 将切点目录输入全自动斑点处理工作站,进行斑点切割、冲洗、干燥、酶解消化、加入基质和质谱靶点样等操作后,使用MALDI-TOFMS测定其在胶内酶降解后的肽质量指纹图谱,并到本地和在线蛋白质数据库验证。
2.3 差异蛋白资料分析 登陆ExPASy网站寻找相关蛋白质的资料,在PubMed查阅相关文献进行蛋白质功能聚类分析并探讨其与胚胎着床关系。
2.4 Western blotting验证蛋白质组学结果 选择annexin IV作为目的蛋白,参照Western blotting(Cell Signaling)说明书操作。Western blotting显影结果扫描定量分析目的条带积分吸光度值(A值)。
3 统计学处理
结 果
1 子宫内膜组织时相和功能的确定
结果显示,LH+2 d和LH+7 d子宫内膜分别呈现分泌早期和中期组织学改变,ER和PR表达符合正常黄体期子宫内膜组织的变化趋势,提示子宫内膜时相正常,见表1。
表1 LH+2 d和LH+7 d子宫内膜形态和ER、PR检测Table 1.The histological changes and expression of ER and PR in LH+2 d and LH+7 d(%.±s.n=4)

表1 LH+2 d和LH+7 d子宫内膜形态和ER、PR检测Table 1.The histological changes and expression of ER and PR in LH+2 d and LH+7 d(%.±s.n=4)
Phase Histological change ER PR Epithelia Stroma cells Epithelia Stroma cells LH+2 d Early secretory phase 92.5 ±2.9 52.5 ±26.3 88.8 ±6.3 70.0 ±21.6 LH+7 d Mid -secretory phase 50.0 ±21.6 37.5 ±18.9 37.5 ±32.0 62.5 ±15.0
2 2D-DIGE图谱
每张2D-DIGE凝胶经3种不同波长的激光扫描可得到3个分别由Cy2、Cy3和Cy5标记的不同蛋白质样品图像及合并的胶内差异图像,见图1,Decyder软件分析检测到(2 555±98)个蛋白质斑点。

Figure 1.2D -DIGE images of endometrial proteins during the implantation window.Individual proteins of endometrial LH+2 d,LH+7 d samples and a pooled internal standard were labeled with CyDyes Cy3,Cy5 and Cy2,and were mixed and separated on a 2D gel using 24 cm pH 3~10 NL strips in the first dimension and 10%SDS-PAGE gels in the second dimension.Gels were scanned to obtain single images of the internal standard(Cy2,red)(A),LH+2 d proteins(Cy3,green)(B)and LH+7 d proteins(Cy5,blue)(C).An overlay of the three dyes(Cy2,Cy3,Cy5)(D)is shown.图1 “种植窗”时期子宫内膜蛋白质的2D-DIGE凝胶图像
3 MALDI-TOF-MS鉴定
根据实验方法中判断差异表达斑点的3个筛选标准获得入选斑点167个,确认差异表达斑点81个进入MALDI-TOF-MS PMF法鉴定,并通过美国国家生物技术信息中心(NCBI)和Swissprot在线检索鉴定,查找和确认差异表达蛋白质共31个,其中17个上调表达,14个下调表达。
图2~5显示在2D-DIGE图谱编号为2 033、pI约5.8、分子量约36的差异蛋白斑点的2D-DIGE斑点图、三维图、MS鉴定图和Swissport在线检索结果。该斑点经鉴定为annexin IV,LH+7 d蛋白质表达量为LH+2 d的2.12倍。
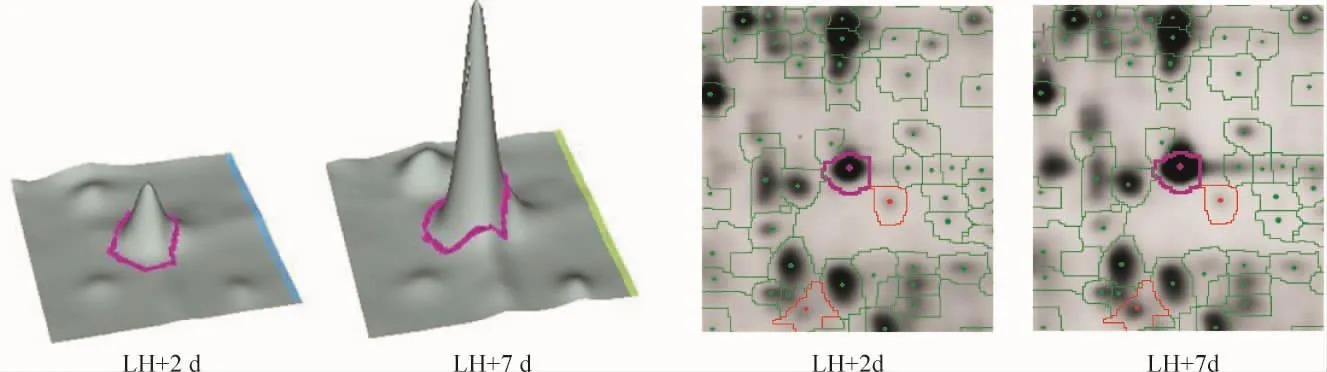
Figure 2.Three-dimensional view and spot map of annexin IV.图2 AnnexinⅣ在LH+2 d和LH+7 d的差异表达图

Figure 3.Graph view of annexin IV.图3 AnnexinⅣ在LH+2 d/+7 d的差异表达图

Figure 4.Mass spectral identification of annexin IV.图4 AnnexinⅣ的质谱鉴定

Figure 5.The searching result of peptide mapping fingerprint by Swissprot database was annexinⅣ.图5 肽指纹图谱经Swissprot数据库搜索结果为AnnexinⅣ
4 差异蛋白资料分析
登陆ExPASy网站寻找相关蛋白质的资料,在PubMed查阅相关文献发现上述31个差异表达的蛋白质功能涉及到细胞迁移与融合、酶活性改变、信号转导和基因调控、血管生成和凝血纤溶等6大功能组,见表2。
5 Western blotting测定annexin IV差异表达
图6结果表明annexin IV在LH+2 d和LH+7 d A值分别为46.249±32.376和249.507±31.959,P<0.01,提示LH+7 d子宫内膜组织annexin IV表达量较LH+2 d显著增加。Western blotting结果与蛋白质组学分析annexin IV表达趋势一致,证实蛋白质组学方法的准确性。

表2 31个“种植窗”时期人类子宫内膜组织差异表达的蛋白质Table 2.31 differentially expressed proteins identified in endowing the endometrium with receptivity
讨 论
人类胚胎种植的低效率至今依然是生殖生物学领域中最大的挑战。文献报道这种低种植率现象与子宫内膜-胚胎发育不同步,临床缺乏预测与评估胚胎发育潜能和子宫内膜对胚胎接受性的客观方法密切相关。由于人类子宫内膜对胚胎接受性存在时、空的短暂性,即胚胎着床活动受到“种植窗”时期的限制,“种植窗”的启动常常发生在内源性LH峰第4 ~5d,关闭发生在第9 ~10d[5]。因此探讨在“种植窗”时期子宫内膜组织的分子生物学变化及其机制是一个亟待解决的重要课题。

Figure 6.Annexin IV and β -actin levels were determined by Western blotting in LH+2 d(group A,A1-A4)and LH+7 d(group B,B1-B4)tissues.图6 Western blotting检测LH+2 d和LH+7 d annexin IV表达和目的条带积分吸光度值
子宫内膜是一种形态、功能都高度依赖激素调节的组织,增殖期子宫内膜向接受态的转化严格受到雌、孕激素和目前还未知因素的调控。排卵后子宫内膜及时向接受态转化,出现组织重建、细胞按一定的时、空顺序分泌相关蛋白或/和局部因子,以期识别胚胎形成具有接受胚胎着床能力的子宫内膜。既往的研究由于被研究因子的独立与局限、研究方法缺乏时、空连续性以及多因子表达的同期比较,其结果不足以真实地反映代表围“种植窗”时期子宫内膜形态与功能转化过程中局部因子的网络联系和调节机制。近年来基因芯片技术在该领域的应用结果已经证实“种植窗”时期出现了数十个与胚胎着床相关基因的上调或下调表达,并对小部分特异基因进行了筛选、分析和克隆研究[3-5]。但是基因表达的结果并不能完全预测蛋白质的表达、修饰与功能变化。而子宫内膜对胚胎接受性的功能改变是一个多基因、多步骤和多阶段的过程,由不同功能的蛋白质在时间与空间上有序协同作用的结果。因此我们选用了能够描述基因调节,对基因表达的蛋白质水平进行相对定量测定的、反映蛋白质组分整体变化的蛋白质组学方法进行研究。
对复杂组织表达的多种蛋白质进行研究面临的主要问题是生物学变异,包括个体差异和组织时相的差异。我们选择正常生育能力的妇女,于同一月经周期LH+2 d和LH+7 d子宫内膜取材,挑选组织时相符合分泌早期和分泌中期配对的子宫内膜,从而减少了由于个体和组织时相差异导致的假阳性结果。“种植窗”时期子宫内膜处于高度血管化状态,单纯使用PBS冲洗不能有效去除血清蛋白,可能导致胶内特定区域分辨率下降,掩盖非血清蛋白。本研究选择Berendt等[6]报道的饱和蔗糖缓冲液(含104IU/L肝素)方法冲洗子宫内膜组织10 min,大幅降低血清蛋白,实验结果显示蛋白质图谱未见明显的血清蛋白点,进一步证实该方法的可行性。
本研究采用2D-DIGE是双向电泳的重要创新,该方法使用荧光标记物预先标记蛋白样品,采用多重分析方式,利用所有样本中的蛋白质斑点同内标比较分析其差异值,能够消除凝胶之间的偏差,减少实验误差,保证所检测到蛋白丰度变化的精确度,且荧光检测灵敏度高,检测范围广,与传统的双向电泳相比有重复性好,准确性高、标准化和高效的优点[7]。从2D-DIGE图谱中可见(2 555±98)个蛋白质斑点,该结果灵敏度与Marouga等[8]报道结果类似。参考本校蛋白质组学系统标准,采用2DDIGE方法可检测到差异大于10%的蛋白质,为提高分辨率我们以差异>1.4倍作为标准,选择在12个蛋白表达谱中表达≥10次(P<0.05)的斑点167个,确认差异表达斑点81个进行质谱鉴定。并通过NCBI和Swissprot在线检索,查找和确认差异表达蛋白质共31个。Berendt等[6]报道pH 4~7和pH 7~9 IPG胶条进行同一小牛子宫内膜样本IEF,分别获得1180和350个蛋白斑点,提示本研究使用宽范围的IPG胶条(pH 3~10)进行IEF。观察2D-DIGE图谱可见碱性端蛋白斑点密集,提示扩大等电点范围电泳将有利于获得更多的蛋白质斑点,针对该问题,今后研究可采用分离碱性蛋白质的IPG胶条(pH 6~11,8~11,9~12)以扩大获得的差异蛋白质数量。
本研究获得“种植窗”时期正常生育能力妇女子宫内膜组织差异表达蛋白质31个,包括膜蛋白、蛋白酶和肽、钙离子结合蛋白、转录因子、细胞信号转导因子、细胞黏附分子等,其中17个表达上调,14个表达下调。首次报道21个“种植窗”时期子宫内膜组织差异表达蛋白质,其中10个表达上调,11个表达下调。其中21个差异表达蛋白质与人类子宫内膜对胚胎接受性的关系还未见文献报道。通过文献查找发现31个差异表达的蛋白质功能涉及到细胞迁移与融合、酶活性改变、信号转导和基因调控、血管生成和凝血纤溶等6大功能组,这些蛋白质功能与胚胎种植过程中所涉及的多种生物学活动相一致。值得注意的是与以往基因水平研究发现的基因表达存在较大差异[4-5]。这种现象是否与本研究使用的IPG胶条(pH 3~10)测定到的蛋白质有限或与从基因到蛋白质水平表达存在时空差异有关还需进一步实验证实。
Annexin IV属于annexin家族,是Ca2+依赖的磷脂结合蛋白,具有促进膜融合,参与囊胞运输、钙离子通道形成、细胞骨架活动、磷脂化与膜受体的功能调节以及胞吞、胞吐和分泌等重要生物功能[9]。近年对annexin IV在肿瘤细胞扩散过程中的研究提示其可能参与生长、分化和细胞形态转换过程[10]。而胚胎种植过程中子宫内膜从非接受态向接受态转化过程中涉及上述类似的生物学过程。Riesewijk等[4]采用基因芯片技术比较LH+2 d/+7 d人类子宫内膜annexin IV基因表达发现在“种植窗”期上调4倍。本研究蛋白质组学结果显示annexin IV表达增强2.12倍;Western blotting结果显annexin IV表达趋势与蛋白质组学结果一致,提示子宫内膜向接受态转化过程中存在annexin IV表达量的显著增加。此结果与Ponnampalam等[11]报道结果一致。同时验证了我们建立的微创子宫内膜组织活检取材方法联合蛋白质组学研究体系的准确性和可靠性。
[1]Lindhard A,Bentin - Ley U,Ravn V,et al.Biochemical evaluation of endometrial function at the time of implantation[J].Fertil Steril,2002,78(2):221 -233.
[2]Tranguch S,Daikoku T,Guo Y,et al.Molecular complexity in establishing uterine receptivity and implantation[J].Cell Mol Life Sci,2005,62(17):1964 -1973.
[3]Kao LC,Tulac S,Lobo S,et al.Global gene profiling in human endometrium during the window of implantation[J].Endocrinology,2002,143(6):2119 -2138.
[4]Riesewijk A,Martin J,van Os R,et al.Gene expression profiling of human endometrial receptivity on days LH+2 versus LH+7 by microarray technology[J].Mol Hum Reprod,2003,9(5):253 -264.
[5]Mirkin S,Arslan M,Churikov D,et al.In search of candidate genes critically expressed in the human endometrium during the window of implantation[J].Hum Reprod,2005,20(8):2104-2117.
[6]Berendt FJ,Frohlich T,Schmidt SE,et al.Holistic differential analysis of embryo-induced alterations in the proteome of bovine endometrium in the preattachment period[J].Proteomics,2005,5(10):2551 -2560.
[7]Domínguez F,Garrido - Gómez T,López JA,et al.Proteomic analysis of the human receptive versus non-receptive endometrium using differential in-gel electrophoresis and MALDI-MS unveils stathmin 1 and annexin A2 as differentially regulated[J].Hum Reprod,2009,24(10):2607-2617.
[8]Marouga R,David S,Hawkins E.The development of the DIGE system:2D fluorescence difference gel analysis technology[J].Anal Bioanal Chem,2005,382(3):669 -678.
[9]李 洁,谭 真,黎明涛,等.膜联蛋白IV蛋白差异表达与人类子宫内膜胚胎接受性关系的初步研究[J].中华妇产科杂志,2006,12(41):803 -805.
[10]Zimmermann U,Balabanov S,Giebel J,et al.Increased expression and altered location of annexin IV in renal clear cell carcinoma:a possible role in tumour dissemination[J].Cancer Lett,2004,209(1):111 -118.
[11]Ponnampalam AP,Rogers PA.Cyclic changes and hormonal regulation of annexin IV mRNA and protein in human endometrium[J].Mol Hum Reprod,2006,12(11):661 -669.

