IL-32γ对大鼠血管平滑肌细胞增殖与细胞周期的影响*
刘宇宏, 王莎莎, 沈凌汛, 徐玉兰
(华中科技大学同济医学院附属协和医院风湿免疫科,湖北武汉430022)
类风湿关节炎(rheumatoid arthritis,RA)的早发心血管事件是同年龄、同性别未患该类疾病普通人群的4~5倍,其原因目前认为与RA慢性炎症导致血管内膜损伤及中膜平滑肌细胞向内膜迁移并异常增生,从而加速动脉粥样硬化的发生、演变与进展[1-2]。白细胞介素-32γ(interleukin-32γ,IL-32γ)是新近发现的一种致炎细胞因子[3-4],有研究发现它在RA的启动与进展中发挥作用[5-7],但它对在RA动脉粥样硬化进展中起关键作用的血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增生是否产生影响尚不清楚。本研究拟通过观察IL-32γ对体外培养的大鼠VSMCs增殖及细胞周期的影响,探讨其在RA早发动脉粥样硬化中的作用及机制。
材料和方法
1 材料
清洁级SD大鼠,4周龄,(180±20)g,雌雄不限,购自同济医学院实验动物中心;含1×105U/L青霉素和100 mg/L硫酸链霉素的完全达氏修正依氏培 养 基 (Dulbecco's modified Eagle's medium,DMEM)、10%胎牛血清购自HyClone;II型胶原酶、二甲基亚砜(dimethyl sulfoxide,DMSO)、四甲基偶氮唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]和吡咯烷二硫代氨基甲酸(pyrrolidine dithiocarbamate,PDTC)购自 Sigma-Aldrich;Annexin V-FITC/PI试剂盒购自南京博泰生物技术有限公司;鼠抗β-actin、组蛋白H3(histone H3)、核因子-κB p65(nuclear factor kappa B p65,NF-κB p65)、cyclin D1和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体购自Santa Cruz;IL-32γ购自R&D。
2 方法
2.1 细胞培养 取4周龄SD大鼠胸主动脉,按常规组织贴块方法分离、原代培养VSMCs,0.5%胰酶消化传代,培养液为含10%胎牛血清的DMEM培养基,实验采用3~8代细胞。
2.2 细胞增殖分析 取对数生长期的VSMCs,以含10% 胎牛血清的培养基制备为1×107/L细胞悬液,每孔200 μL分别接种于96孔培养板中培养,细胞同期化后分组处理。(1)对照组:IL-32γ的终浓度为0 μg/L;(2)实验组:每孔分别加入 10、20、50 μg/L IL-32γ;(3)IL-32γ+PDTC 组:PDTC(终浓度20 μmol/L)预处理1 h后加入 IL-32γ(终浓度50 μg/L)。每组设4个复孔,然后在含10% 胎牛血清的培养液中分别培养24和48 h。干预结束时每孔加入MTT溶液(5 g/L)20 μL,继续孵育4 h,弃培养液,再加入DMSO 200 μL,振荡溶解细胞,用酶标仪检测A490处的吸光度值。实验重复3次。
2.3 细胞周期分析 VSMCs按2×108/L接种于24孔培养板中,细胞同期化后分组处理。实验组加入IL-32γ 50 μg/L,对照组和 IL-32γ +PDTC 组处理方法如前述。每组设4个复孔,然后在含10% 胎牛血清的DMEM中培养24 h。收集细胞,用预冷的70%乙醇于4℃固定30 min,RNaseA(100 mg/L)37℃水浴30 min,加碘化丙啶(50 mg/L),以流式细胞仪(FACS Calibur)进行细胞周期分析。每个样本检测1×107个细胞。
2.4 免疫印迹法检测cyclin D1和核内NF-κB p65蛋白的表达 按上述方法处理VSMCs,培养24 h后收集细胞1×109/L,提取胞质和核蛋白。取25 μg以10%SDS-PAGE电泳分离,于低温100 V 3 h将蛋白转至硝酸纤维素膜上,加封闭液2 h阻断非特异性抗体结合位点,将膜与溶于封闭液中的Ⅰ抗室温下孵育2 h,磷酸盐缓冲液(phosphate-buffered saline,PBS)洗3次×5 min,加入辣根过氧化物酶标记的Ⅱ抗,室温下结合1 h,PBS缓冲液冲洗后,标准ECL法底物发光并显影。
2.5 免疫细胞化学染色法检测PCNA的表达 6孔培养板中加人盖玻片,VSMCs按1×109/L细胞密度接种,细胞长满盖玻片后按上述步骤加药、培养。24 h和48 h收集盖玻片,PBS液冲洗,纯丙酮固定8 min,制成细胞爬片。I抗选用小鼠抗人PCNA单克隆抗体。按SP法染色试剂盒说明书操作步骤进行操作。每张细胞爬片随机选取5个高倍视野,共计数1 000个细胞,计算阳性表达的细胞数占细胞总数的百分比。
3 统计学处理
结 果
1 VSMCs形态特点
将大鼠VSMCs分离、培养,倒置显微镜下观察,细胞为梭形,有较长突起,呈典型“峰-谷”样生长,见图1。
2 IL-32γ对细胞增殖的影响
MTT比色法检测表明,实验组在接种24和48 h后的细胞数量与对照组比较显著增多,且呈浓度和时间依赖性;提前1 h加入PDTC预处理,显著抑制了IL-32γ的促增殖作用(分别 P<0.05,P<0.01),见表 1。
3 IL-32γ对细胞周期的影响
IL-32γ刺激细胞24 h后,实验组处于G1期的细胞比例为(38±4)%,较对照组[(69±5)%]显著降低,处于S+G2期的细胞比例为(62±5)%,较对照组[(31±3)%]明显提高(均 P<0.01);加用PDTC预处理后,IL-32γ+PDTC组G1期的细胞比例为(60±5)%,处于S/G2期的细胞比例为(37±4)%,与实验组比较差异显著(均P<0.01),但与对照组比较差异无统计学意义,见图2。

Figure 1.Morphology of VSMCs at the third passage under inverted microscope(×100).图1 倒置显微镜下第3代VSMCs形态
表1 各组VSMCs的MTT检测结果Table 1.Absorbance(A)values of VSMCs in different groups detected by MTT assay(±s.n=3)

表1 各组VSMCs的MTT检测结果Table 1.Absorbance(A)values of VSMCs in different groups detected by MTT assay(±s.n=3)
*P <0.05,**P <0.01 vs control at the same time;△△P <0.01 vs 24 h in the same group;▲▲P <0.01 vs IL-32γ(10 μg/L)at the same time;##P <0.01 vs IL-32γ (50 μmol/L)+PDTC(20 μmol/L)at the same time.
Group 24 h 48 h Control 0.36 ±0.03 0.52 ±0.04△△IL-32γ(10 μg/L) 0.45 ±0.03* 0.63 ±0.06**△△IL-32γ(20 μg/L) 0.57 ±0.04**▲▲## 0.75 ±0.07**△△▲▲##IL-32γ(50 μg/L) 0.64 ±0.06**▲▲## 0.84 ±0.08**△△▲▲##IL-32γ(50 μg/L)+PDTC(20 μmol/L) 0.40 ±0.03 0.56 ±0.05△△
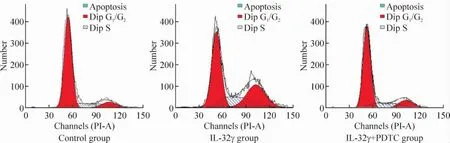
Figure 2.Flow cytometry analysis of cell cycle图2 流式细胞仪检测细胞周期
4 IL-32γ对cyclin D1和NF-κB p65表达的影响
免疫印迹检测结果显示,实验组cyclin D1和NF-κB p65的蛋白表达(分别为0.86±0.05和1.16±0.06)显著高于对照组(分别为0.47±0.03和0.58±0.05)(均P<0.01);IL-32γ+PDTC组的 cyclin D1和NF-κB p65蛋白表达(分别为0.58±0.04和0.70±0.05)较实验组显著降低(均P<0.01),但仍高于对照组(均P<0.05),见图3。
5 IL-32γ对PCNA表达的影响
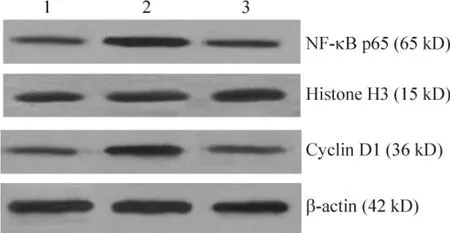
Figure 3.The expression levels of cyclin D1 and NF-κB p65 proteins in different groups(Western blotting).1:control group;2:IL-32γ group;3:IL-32γ+PDTC group.图3 免疫印迹检测各组细胞cyclin D1和NF-κB p65的蛋白表达
PCNA以细胞核棕黄色为阳性。实验组第24和48 h的PCNA阳性表达量分别为(60.3±5.0)%和(73.1±6.2)%,显著高于对照组的(38.1±4.2)%和(51.7±4.5)%(均 P<0.01);IL-32γ+PDTC组第24、48 h的PCNA阳性表达量分别为(40.1±4.0)%和(55.1±5.0)%,较实验组显著降低(均P<0.01),但与对照组比较差异无统计学意义。各组细胞形态未见明显改变,见图4。
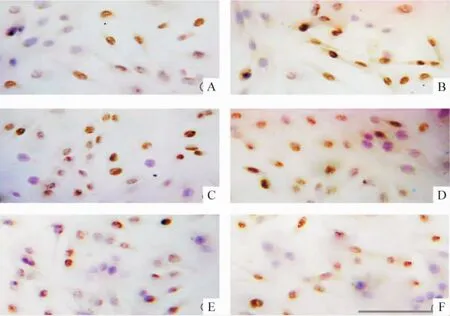
Figure 4.The immunocytochemical staining results of PCNA expression in each group(×200).A:control 24 h;B:control 48 h;C:IL-32γ 24 h;D:IL-32γ 48 h;E:IL-32γ+PDTC 24 h;F:IL-32γ+PDTC 48 h.图4 免疫细胞化学染色法检测各组细胞PCNA表达
讨 论
类风湿关节炎患者的心血管发病率与死亡率明显升高与其早发动脉粥样硬化密切相关。近年研究发现,RA和动脉粥样硬化的发病机制有着十分相似的特征,这些特征包括均有细胞因子参与、自体反应T细胞浸润、黏附分子表达、胶原降解和新生血管形成等[1]。导致RA患者滑膜损伤的炎症机制同时转入了血管壁损伤并启动了动脉粥样硬化进程[1]。
VSMCs的异常增殖是动脉粥样硬化过程中的一个关键因素。作为一个病理过程,其异常增殖受多方面的因素的影响与调控,诸如细胞因子[8]、趋化因子、生长因子等。晚近有研究发现IL-32γ高表达于RA患者的血管壁,且与内皮功能失调密切相关[9],但它对VSMCs增殖的影响尚不清楚。本研究结果显示,与对照组相比,10 μg/L以上的 IL-32γ可以浓度和时间依赖性地使VSMCs增殖加快。提示IL-32γ对体外培养的VSMCs有促增殖作用。PCNA含量随细胞不同周期而改变,其量的变化与DNA合成一致,可反映细胞增殖活性的变化。免疫细胞化学结果显示,PCNA在IL-32γ组中的表达水平明显高于对照组,表明细胞的DNA合成增多,即细胞增殖加快,与MTT检测法的结果一致。这与文献报道IL-32表达上调可以促进造血干细胞增殖[10]、敲除IL-32基因可以抑制胰腺癌细胞增殖是一致的[11],表明IL-32γ的确是一个与细胞增殖相关的细胞因子。
细胞周期长短是影响细胞增殖快慢的重要因素之一。本研究结果发现,当用50 μg/L IL-32γ刺激48 h后,实验组处于G1期的细胞比例较对照组降低,处于S+G2期的细胞比例较对照组提高。表明IL-32γ的促细胞增殖作用与加速细胞周期转化密切相关。
细胞周期受细胞周期素(cyclins)的调控。Cyclin D1在调控细胞通过G1期检验点发挥重要作用,通过G1期检验点的细胞将不可逆转地完成整个细胞分裂过程[12]。Cyclin D1表达上调可以加速细胞通过整个细胞周期[13-15]。因此,我们进一步检测IL-32γ对cyclin D1表达的影响。结果表明,cyclinD1在实验组中的表达显著高于对照组。表明IL-32γ在cyclin D1表达的调控中发挥重要的作用。上调cyclin D1表达可能是IL-32γ加速细胞周期转化的原因之一。
已知NF-κB可以通过转录调节cyclin D1而控制细胞生长[16]。有研究报道IL-32γ可激活人树突状细胞、单核细胞和小鼠巨噬细胞的NF-κB信号通路[17-18],但在VSMCs中是否存在这种机制尚未见报道。本实验发现,实验组核内NF-κB p65的表达显著高于对照组。提示IL-32γ可诱导RA-FLS中NF-κB活化。为了进一步了解该信号通路的活化与IL-32γ促细胞增殖作用间的相关性,我们较IL-32γ提前1 h加用NF-κB抑制剂PDTC预处理VSMCs,结果显示,PDTC显著抑制IL-32γ的促细胞增殖反应、促细胞周期转化和上调NF-κB p65与cyclin D1表达的作用。提示IL-32γ的确能通过激活NF-κB信号通路上调cyclin D1表达,进而缩短细胞周期和促进细胞增殖。
总之,本实验发现,IL-32γ能够在体外促进VSMCs增殖。表明IL-32γ作为炎症级联反应过程中的一个重要细胞因子,不仅参与了RA关节损伤的启动与进展,而且在RA早发动脉粥样硬化中发挥重要作用,可能是RA及其心血管并发症治疗的一个新靶标。
[1] Hürlimann D,Forster A,Noll G,et al.Anti-tumor necrosis factor-alpha treatment improves endothelial function in patients with rheumatoid arthritis[J].Circulation,2002,106(17):2184-2187.
[2] Full LE,Monaco C.Targeting inflammation as a therapeutic strategy in accelerated atherosclerosis in rheumatoid arthritis[J].Cardiovasc Ther,2011,29(4):231-242.
[3] Choi JD,Bae SY,Hong JW,et al.Identification of the most active interleukin-32 isoform[J].Immunology,2009,126(4):535-542.
[4] Felaco P,Castellani ML,De Lutiis MA,et al.IL-32:a newly-discovered proinflammatory cytokine[J].J Biol Regul Homeost Agents,2009,23(3):141-147.
[5] Alsaleh G,Sparsa L,Chatelus E,et al.Innate immunity triggers IL-32 expression by fibroblast-like synoviocytes in rheumatoid arthritis[J].Arthritis Res Ther,2010,12(4):R135.
[6] Kim YG,Lee CK,Oh JS,et al.Effect of interleukin-32γ on differentiation of osteoclasts from CD14+monocytes[J].Arthritis Rheum,2010,62(2):515-523.
[7] Joosten LA,Netea MG,Kim SH,et al.IL-32,a proinflammatory cytokine in rheumatoid arthritis[J].Proc Natl Acad Sci U S A,2006,103(9):3298-3303.
[8] Kim HM,Bae SJ,Kim DW,et al.Inhibitory role of magnolol on proliferative capacity and matrix metalloproteinase-9 expression in TNF-α-induced vascular smooth muscle cells[J].Int Immunopharmacol,2007,7(8):1083-1091.
[9] Nold-Petry CA,Nold MF,Zepp JA,et al.IL-32-dependent effects of IL-1beta on endothelial cell functions[J].Proc Natl Acad Sci U S A,2009,106(10):3883-3888.
[10] Moldenhauer A,Futschik M,Lu H,et al.Interleukin 32 promotes hematopoietic progenitor expansion and attenuates bone marrow cytotoxicity[J].Eur J Immunol,2011,41(6):1774-1786.
[11] Nishida A,Andoh A,Inatomi O,et al.Interleukin-32 expression in the pancreas[J].J Biol Chem,2009,284(26):17868-17876.
[12] Pardee AB.A restriction point for control of normal animal cell proliferation[J].Proc Natl Acad Sci USA,1974,71(4):1286-1290.
[13] Hunter T,Pines J.Cyclins and cancer II:cyclin D and CDK inhibitors come of age[J].Cell,1994,79(4):573-582.
[14] 乔礼芬,徐永健,刘先胜,等.周期蛋白D1在蛋白激酶C调控哮喘大鼠气道平滑肌细胞增殖中的作用[J].中国病理生理杂志,2008,24(11):2214-2219.
[15] Hinz M,Krappmann D,Eichten A,et al.NF-κB function in growth control:regulation of cyclin D1 expression and G0/G1-to-S-phase transition[J].Mol Cell Biol,1999,19(4):2690-2698.
[16] Guttridge DC,Albanese C,Reuther JY,et a1.NF-κB controls cell growth and differentiation through transcriptional regulation of cyclin D1[J].Mol Cell Biol,1999,19(8):5785-5799.
[17] Jung MY,Son MH,Kim SH,et al.IL-32γ induces the maturation of dendritic cells with Th1-and Th17-polarizing ability through enhanced IL-12 and IL-6 production[J].J Immunol,2011,186(12):6848-6859.
[18] Kim SH,Han SY,Azam T,et al.Interleukin-32:a cytokine and inducer of TNFα[J].Immunity,2005,22(1):131-142.

