一种新的角膜缘干细胞分选方法△
张 伟 杨为中 金 敏 高宗银 陈晓燕 许艳丽 张玉平
随着科学技术的发展,组织工程技术正在成为治疗组织、器官衰竭的有效方法和辅助手段。这标志着医学将走出器官移植的范畴,步入制造组织和器官的新时代,即再生医学的新时代。将种子细胞种植在支架上是构建组织工程产品的基本方法[1]。因此种子细胞在组织工程角膜中占据非常重要的地位。
我们以前报道了采用平板离心的方法[2],以人角膜缘细胞系SDHCEC1为种子细胞构建了组织工程角膜上皮片。同时我们设计了一种利用平板离心方法短时间内形成纯细胞片的方法。实验中先用正交实验法优选出最佳离心参数,然后用多层叠加的方法快速构建出细胞片,对获得的纯细胞片中种子细胞的活性分析显示细胞活性明显高于传统方法。对于人角膜缘细胞系SDHCEC1,在离心转速为1800 r·min-1时有80%左右的细胞能够贴壁黏附,但当我们将这种方法应用于人角膜上皮组织块原代培养出的细胞时却发生了相反的变化,在同样的离心力下仅20%左右的细胞贴壁。为什么会产生这种现象呢?人角膜上皮组织块原代培养出的细胞中贴壁的细胞和不能贴壁的细胞有什么区别呢?本次我们通过细化平板离心转速分离出三群细胞,并对其特征性细胞标记的表达和增殖活性等进行了详细研究。
1 材料与方法
1.1 角膜缘上皮细胞完全培养基的配制 用DMEM无血清基础培养基(Gibco BRL),添加胎牛血清(Gibco BRL)、hEGF重组人胰岛素(Gibco BRL),人转铁蛋白(Sigma)、L-Glutamine(Gibco BRL)、青链霉素溶液(Gibco BRL)、氢化可的松(Sigma)和非必需氨基酸(Gibco BRL),混匀后 0.2 μm 滤膜过滤,4℃下保存备用。
1.2 细胞培养 取角膜移植术后剩余的眼球,用生理盐水冲洗3次后无菌条件下钝性分离角膜板层。用角膜剪将角膜缘剪成2 mm×2 mm大小的组织块,将组织块上皮面朝下贴附于25 mm2塑料培养瓶中。将接种有组织块的培养瓶放在细胞培养箱中静置干燥30 min左右,待组织块贴附后,加入适量培养液,使其刚刚覆盖组织块,放入细胞培养箱中静置培养48 h以上,根据培养液的颜色变化及时换液,定期观察细胞的生长情况。待人角膜缘上皮细胞达到80%融合时即可以 2.5 g·L-1胰蛋白酶加 0.1 g·L-1EDTA混合消化液消化收集细胞,将细胞悬液吸入离心管中,1000 r·min-1离心 5 min。弃去上清液,用上皮细胞培养液重新悬浮细胞,以备下一步平板离心法分离细胞使用。
1.3 平板离心法分选角膜上皮细胞 将原代组织块培养的细胞收集后制作细胞悬液接种于六孔板中,细胞密度为900×103·cm-2(n=6),放置于平板离心机(Eppendorf 5810R,直径20 cm)中进行离心。首先用1400 r·min-1离心4 min,离心结束后吸取上清液,分别收集上清液和离心贴壁的细胞(ATC1),然后将上清液再次用1800 r·min-1离心4 min,分别收集离心贴壁的细胞(ATC2)和上清液中的细胞(NAC)。
1.4 分选细胞免疫组织化学分析 将上述分选所得三群细胞进行免疫荧光染色。室温下,将三群细胞分别用酒精固定10 min;Triton X-100孵育10 min;山羊血清封闭20 min;加入一抗,4℃过夜后去除一抗,PBS冲洗,使用一抗为:鼠抗 K3 mAb(Chemicon)、p63 mAb(Chemicon)和 ABCG2 mAb(Santa Cruz,CA);加入羊抗小鼠IgG二抗,室温下避光孵育2 h,去除二抗PBS冲洗;加入Hoechst33342染核10 min,PBS冲洗;抗荧光衰减封片剂封片,共聚焦显微镜下观察并拍照。阴性对照除一抗用PBS液代替外,其余操作相同。
1.5 克隆形成实验 将上述分选所得三群细胞分别按以往报道的方法[3]进行克隆形成实验。即按每皿接种500个细胞种植到60 mm×60 mm的细胞培养皿中。培养箱中静置培养,隔日半量换液。进行为期1周的培养后,吸出培养液,用PBS轻轻漂洗,然后加入固定液 (甲醇∶冰醋酸=3∶1)固定20 min。PBS冲洗,用 Giemsa染液(1∶10稀释)染色10 min,自来水冲洗后,在光镜下观察细胞克隆的形态,计算细胞克隆数(>4个细胞为一个克隆)和细胞克隆形成率(细胞克隆形成率=克隆数/接种细胞数 ×100%)。
1.6 流式细胞仪分析Ki67阳性情况 将上述分选所得三群细胞分别按以往报道的方法[4-5]进流式细胞仪分析Ki67的阳性情况。即分别收集各组细胞、计数、离心;PBS洗1次,离心5 min,弃去上清;固定液固定15 min;加入PBS洗涤1次,离心弃去上清;加入破膜液破膜15 min;加入PBS洗涤1次,离心弃去上清;加入一抗(用PBS或破膜液稀释),37℃孵育30 min;PBS洗1次,离心5 min,弃去上清;加入荧光二抗,培养箱内37℃放置20 min;PBS洗1次,离心5 min,弃去上清;PBS液定容至500 μL,置入1 mL EP管中上机。
1.7 统计学处理 本次数据采用SPSS 13.0统计软件处理。克隆形成实验和流式细胞仪Ki67阳性检测率采用ANOVA进行分析,α=0.05。
2 结果
2.1 平板离心分选所得细胞的贴壁率和生长特征
在离心速度为1400 r·min-1时,细胞的贴壁率为(11.32 ±2.46)%;在离心速度为 1800 r·min-1时,细胞的贴壁率为(18.55±2.79)%,上清液中悬浮而不能贴壁的细胞则为(68.29±4.07)%。倒置显微镜下观察ATC1细胞生长紧密,形态较小且均一;ATC2的细胞形态变大,细胞形态不均一;而NAC则表现出明显老化的现象,细胞出现空泡,有些细胞死亡漂浮于培养液中。
2.2 p63、ABCG2和K3表达情况 共聚焦显微镜观察显示(图1),ATC1 p63和ABCG2阳性表达率最高,而K3几乎没有表达;ATC2仅有小部分表达p63和ABCG2,大部分表达K3;而 NAC不表达 p63和ABCG2,但K3几乎完全表达。
2.3 细胞增殖活性
2.3.1 细胞克隆能力 细胞克隆形成率检测结果(图2)显示ATC1细胞克隆形成最多,克隆形成率为(3.90±0.17)%,而ATC2和NAC细胞克隆形成率则分别为(2.48 ±0.19)% 和(0.84 ±0.89)%(n=6,P=0.000)。观察克隆的形态可见:ATC1形成的克隆较其他细胞形成的克隆稍大一些。
2.3.2 细胞Ki67阳性率 流式细胞仪检测细胞Ki67阳性率结果(图3)显示ATC1 Ki67阳性率最高,为(56.78±2.39)%,而 ATC2 和 NAC 细胞 Ki67阳性检测率则分别为(9.67±1.88)%和(4.76±0.57)%(n=6,P=0.000)。
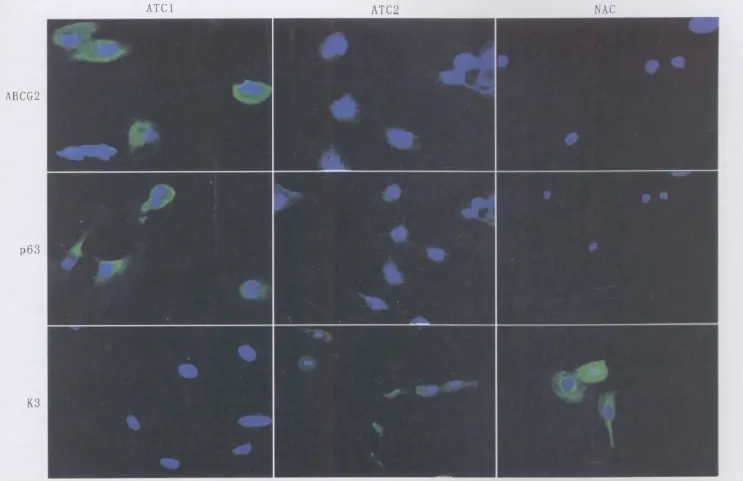
Figure 1 Expression of ABCG2,p63 and K3 in ATC1,ATC2 and NAC ABCG2、p63 和 K3在 ATC1、ATC2和 NAC 中的表达情况
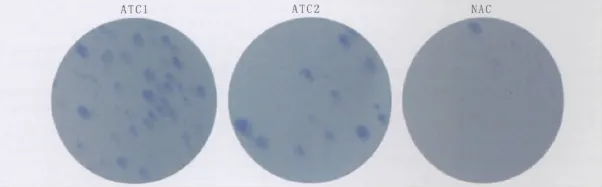
Figure 2 Cell clone of ATC1,ATC2 and NAC ATC1、ATC2和NAC细胞克隆形成情况
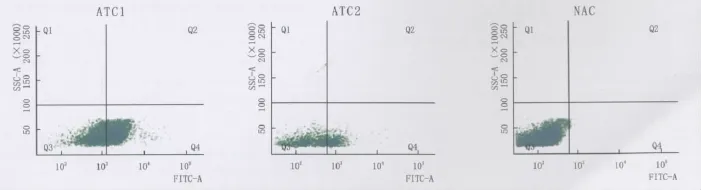
Figure 3 Positive expression of Ki67 in ATC1,ATC2 and NAC ATC1、ATC2和NAC的Ki67阳性检测情况
3 讨论
角膜缘干细胞是角膜上皮更新的细胞源泉,由于眼烧伤、化学伤等各种原因所致的角膜缘干细胞缺损可引起持续性角膜上皮缺损,严重者甚至发生基质溶解、角膜穿孔,是临床上十分棘手的问题。来自于供体角膜的同种异体或自体角膜缘干细胞移植治疗角膜缘干细胞缺损已取得了较好的临床效果,但供体材料来源有限等困难严重制约了这一治疗方法的广泛开展,组织工程角膜则应此局限孕育而生,蓬勃发展。
角膜上皮组织的代谢是依靠角膜缘组织中存在的干细胞来维持的,分离纯化角膜缘干细胞对于组织工程角膜的构建和研究角膜干细胞的特性非常重要。目前有报道可根据其 SP phenotype[6]、细胞大小[7]、慢周期细胞[8]、克隆形态[9]和体外黏附[10]等特性来进行分离纯化。角膜缘干细胞是一群形态较小,核质比较大的慢周期细胞,目前缺乏特异性识别物,只能通过间接识别的方法,如其阳性表达ABCG2、p63,阴性表达K3/K12。干细胞在角膜受伤或体外培养的情况下表现出自我增殖和功能组织再生的潜能。本次我们在离心转速为1400 r·min-1时用平板离心法筛选出的贴壁细胞ATC1具备上述的角膜缘干细胞的特性。它们大部分阳性表达角膜缘干细胞的特异性标记ABCG2和p63,而不表达角膜上皮的分化标记物K3,且拥有很强的细胞克隆能力和很高的增殖能力,即Ki67高表达。而从细胞的生长状态来看,ATC2类似角膜短暂扩充细胞,NAC类似角膜终末分化细胞。这表明用平板离心法可筛选出人角膜缘干细胞。
Krulova等[11]用 Percoll gradient离心法从鼠的角膜缘细胞分离出了两种不同的细胞群,它们发现高密度部分(占细胞总量的7%)细胞体积较小,K12表达阴性而p63表达阳性。他们没有像我们细化分离且使用的分离方式复杂,易将细胞中参入其他物质。
在组织工程和细胞特性的研究中,细胞的新鲜和纯化非常重要。目前的一些方法是根据干细胞的一些特征性的标记物用流式细胞分选出角膜缘干细胞,这种方法需要很多处理步骤。也有学者用细胞克隆分析的方法来分离干细胞,但这也需要很长的时间。Li等[10]利用角膜缘干细胞细胞黏附的特性,将培养皿用Ⅳ型胶原包被后筛选干细胞。但平板离心法尤其独特的优点是,不需包被培养皿,不需特殊的仪器,只需平板离心机这种常见的仪器即可在4 min内快速的分离出干细胞来,可以避免细胞污染,保持细胞新鲜,对下一步的研究非常重要。因此,平板离心法可予未包被的培养皿上快速分选出人角膜缘干细胞,这是一种新的角膜缘干细胞的分选方法。这些方面并不仅仅局限于分离人角膜缘干细胞,也许可以应用于其他的细胞领域,我们目前正在进行这方面的研究。
1 Dravida S,Gaddipati S,Griffith M,Merrett K,Lakshmi Madhira S,Sangwan VS,et al.A biomimetic scaffold for culturing limbal stem cells:a promising alternative for clinical transplantation[J].J Tissue Eng Regen Med,2008,2(5):263-271.
2 Zhang W,Xiao J,Li C,Wan P,Liu Y,Wu Z,et al.Rapidly constructed scaffold-free cornea epithelial sheets for ocular surface reconstruction[J].Tissue Eng Part cmethods,2011,17(5):569-577.
3 Liu J,Song G,Wang Z,Huang B,Gao Q,Liu B,et al.Establishment of a corneal epithelial cell line spontaneously derived from human limbal cells[J].Exp Eye Res,2007,84(3):599-609.
4 Kawakita T,Higa K,Shimmura S,Tomita M,Tsubota K,Shimazaki J.Fate of corneal epithelial cells separated fromLimbus in vivo[J].Invest Ophthalmol Vis Sci,2011,52(11):8132-8137.
5 Sebastian A,Syed F,Perry D,Balamurugan V,Colthurst J,Chaudhry IH,et al.Acceleration of cutaneous healing by electrical stimulation:Degenerate electrical waveform down-regulates inflammation,up-regulates angiogenesis and advances remodeling in temporal punch biopsies in a human volunteer study[J].Wound Repair Regen,2011,19(6):693-708.
6 Selver OB,Barash A,Ahmed M,Wolosin JM.ABCG2-dependent dye exclusion activity and clonal potential in epithelial cells continuously growing for 1 month fromLimbal explants[J].Invest Ophthalmol Vis Sci,2011,52(7):4330-4337
7 Shortt AJ,Secker GA,Munro PM,Khaw PT,Tuft SJ,Daniels JT.Characterization of the limbal epithelial stem cell niche:novel imaging techniques permit in vivo observation and targeted biopsy of limbal epithelial stem cells[J].Stem Cells,2007,25(6):1402-1409.
8 Pajoohesh-Ganji A,Pal-Ghosh S,Simmens SJ,Stepp MA.Integrins in slow-cycling corneal epithelial cells at the limbus in the mouse[J].Stem Cells,2006,24(4):1075-1086.
9 Wang H,Tao T,Tang J,Mao YH,Li W,Peng J,et al.Importin 13 serves as a potential marker for corneal epithelial progenitor cells[J].Stem Cells,2009,27(10):2516-2526.
10 Li DQ,Chen Z,Song XJ,de Paiva CS,Kim HS,Pflugfelder SC.Partial enrichment of a population of human limbal epithelial cells with putative stem cell properties based on collagen type IV adhesiveness[J].Exp Eye Res,2005,80(4):581-590.
11 Krulova M,Pokorna K,Lencova A,Fric J,Zajicova A,Filipecm,et al.A rapid separation of two distinct populations of mouse corneal epithelial cells with limbal stem cell characteristics by centrifugation on percoll gradient[J].Invest Ophthalmol Vis Sci,2008,49(9):3903-3908.

