白藜芦醇对大鼠糖尿病性白内障抗氧化损伤的保护作用△
钟晓东 罗卫民 刘越峰 余锦强 李 凌 王 莹 李玉霞
白内障是世界上首位致盲因素,全球约1700万人因白内障而致盲,也是我国第一位致盲性眼病[1]。糖尿病是白内障的最主要诱发因素之一,随着研究的深入,氧化损伤在糖尿病性白内障中的作用已经日益受到重视[2]。白藜芦醇是一类非黄酮类多酚化合物,已有研究发现它具有强大的抗氧化和清除自由基能力[3]。本研究试图建立大鼠链脲佐菌素(streptozotocin,STZ)糖尿病性白内障模型,研究白藜芦醇对糖尿病性白内障小鼠晶状体组织中超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)等酶活性及铜锌超氧化物歧化酶(Cu-Zn superoxide dismutase,CuZnSOD)基因表达水平的影响,从而为糖尿病性白内障的防治寻找新的方法。
1 材料与方法
1.1 材料与试剂 SD大鼠90只由湖北医药学院实验动物部提供,体质量(250±5)g,散瞳检查结果显示晶状体透明,并随机分为3组(每组各30只),A组:正常对照组;B组:糖尿病模型组;C组:白藜芦醇治疗组。白藜芦醇和STZ购自美国Sigma公司(纯度分别>99%、98%),兔抗鼠CuZnSOD多克隆抗体为武汉博士德公司产品。Tag酶购自英国Biolabs公司。Trizol和DNA Marker购自美国Promega公司,SOD试剂盒、CAT试剂盒以及GSH-PX试剂盒均为南京建成生物工程研究所产品。其他生化试剂主要为上海生物工程有限公司分析纯产品。
1.2 方法
1.2.1 糖尿病大鼠动物模型的建立及白藜芦醇干预[4]A组大鼠给予常规饲料喂养,B组、C组大鼠一次性腹腔注射10 g·L-1STZ 溶液(0.1 mol·L-1柠檬酸盐缓冲液稀释,pH 4.5),72 h后尾静脉取血,当空腹血糖>14 mmol·L-1表示糖尿病模型建立成功。C组大鼠按400 mg·kg-1体质量给予白藜芦醇灌胃,12周后采用10 g·L-1戊巴比妥钠麻醉并无菌条件下处死大鼠,获取晶状体用于以下研究。
1.2.2 晶状体混浊度的观察 大鼠双眼经10 g·L-1托品酰胺滴眼液滴眼后,乙醚蒸汽麻醉。用裂隙灯观察晶状体变化情况。晶状体混浊程度参考文献
[5]进行分级:Ⅰ级:无混浊,晶状体清亮透明;Ⅱ级:轻度混浊,晶状体周边有少量空泡;Ⅲ级:中度混浊,空泡扩散至中心区域,晶状体核出现雾状混浊;Ⅳ级:晶状体高度混浊,周边空泡扩展到核区,核雾状混浊进一步加重;Ⅴ级:核混浊,完全性白内障。
1.2.3 SOD、GSH-PX以及CAT活性检测 获取的大鼠晶状体经生理盐水漂洗后加入9倍晶状体质量的匀浆介质(pH 7.4,含 10 mmol·L-1Tris、0.1 mmol·L-1EDTA、10 mmol·L-1蔗糖、8 g·L-1NaCl),制成匀浆,4 ℃ 下 14 000 r·min-1离心 10 min,取上清用于SOD、GSH-PX以及CAT活性检测。黄嘌呤氧化酶法、二硫代二硝基苯甲酸法和钼酸铵-化学比色法分别检测SOD、GSH-PX和CAT活性。操作步骤按试剂盒提供的方法进行。
1.2.4 晶状体 CuZnSOD 基因表达(RT-PCR)的检测 用Trizol试剂提取晶状体RNA,并逆转录成cDNA。25 μL反应体系中含有:10×Tag缓冲液2.5 μL、25 mmol·L-1MgCl21.5 μL、2.5 mmol·L-1dNTP 2 μL、上下游引物各 1 μL、cDNA 模板2 μL、重蒸水 14.75 μL、Tag 酶 0.25 μL。94 ℃预变性 3 min后,进入31个循环:96℃ 50 s、55℃ 50 s、70℃ 50 s,最后72℃延伸10 min。所用引物序列如下:CuZnSOD上游引物:5’-TGGTGGGCAGACGACTAA-3’、下游引物:5’-AAGATGGATGCTCGGTGTAA-3’,产物 578bp;β-actin 上 游 引 物:5’-ACCGTGGAGAAGAGCTACGA-3’、下 游 引 物:5’-GTACTTGCGCTCAGAAGGAG-3’,产物309 bp。反应结束后取10 μL进行琼脂糖凝胶电泳,拍照后灰度扫描。
1.3 统计学分析 所有实验数据均平行测定3次,计量资料采用±s表示,晶状体混浊度比较用H检验,两两比较采用Nemenyi分析。采用SPSS 13.0统计软件分析数据,P<0.05为差异有统计学意义。
2 结果
2.1 实验大鼠血糖、体质量观察 分别于灌注后4周、8周、12周测量3组大鼠体质量,结果显示:糖尿病模型组大鼠体质量明显低于正常对照组和白藜芦醇治疗组,差异有统计学意义(P<0.05),而白藜芦醇治疗组和正常对照组相比差异无统计学意义(P>0.05)。STZ注射3 d后,大鼠血糖均 >14 mmol·L-1。灌注后4周、8周、12周,3组大鼠血糖两两比较,差异有统计学意义(P<0.05),其中白藜芦醇治疗组血糖低于糖尿病模型组,但略高于正常对照组(P <0.05)。
2.2 晶状体混浊度检测 3组大鼠不同时间晶状体混浊度见表1所示,正常对照组大鼠在4~12周内始终透明。灌注后12周糖尿病模型组大部分晶状体核及核周皮质均出现混浊或完全混浊,3组大鼠晶状体的混浊度差异有统计学意义(Hc=34.57,P<0.05)。其中白藜芦醇治疗组晶状体混浊度高于正常对照组(χ2=8.26,P <0.05),但与糖尿病模型组相比明显减轻(χ2=14.72,P <0.05)。
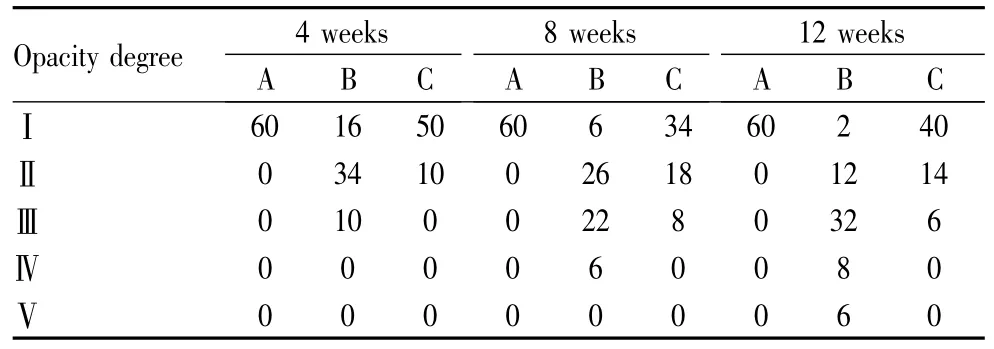
表1 4~12周内3组大鼠晶状体混浊程度比较Table1 Comparison of opacity degree among the three groups from 4 weeks to 12 weeks (rats)
2.3 晶状体内SOD、GSH-PX及CAT活性的变化
糖尿病模型组晶状体内SOD、GSH-PX和CAT活性分别为(10.39 ±1.25)U·mg-1、(24.36 ±1.05)U·mg-1和(1.62 ±0.24)U·mg-1,均低于正常对照组(40.16 ±1.87)U·mg-1、(67.86 ±1.24)U·mg-1、(5.57 ±1.54)U·mg-1(均为 P <0.05)。白藜芦醇治疗组晶状体内SOD、GSH-PX和CAT活性分别为(29.06 ±1.33)U·mg-1,(47.58 ±2.35)U·mg-1和(3.26 ±0.47)U·mg-1,与糖尿病模型组相比,3种酶活性有所增强,差异均有统计学意义(均为P<0.05)。
2.4 CuZnSOD mRNA表达变化 3组大鼠晶状体内CuZnSOD mRNA表达变化见图1。由图1可见:正常对照组大鼠晶状体内CuZnSOD mRNA呈高水平表达,当腹腔注射STZ后,CuZnSOD mRNA表达水平显著降低(t=8.44,P<0.05)。而白藜芦醇能有效提高糖尿病大鼠晶状体内CuZnSOD mRNA水平(t=6.97,P <0.05)。
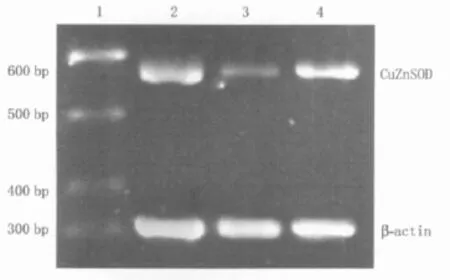
Figure 1 The mRNA expression level of CuZnSOD in the three groups.1:Marker;2:Control group;3:Diabeticmodel group;4:Resveratrol group 3组大鼠晶状体内CuZnSOD mRNA表达水平。1:Marker;2:正常对照组;3:糖尿病模型组;4:白藜芦醇治疗组
3 讨论
糖尿病性白内障的发生机制尚未完全阐明,目前的观点主要包括渗透压学说、蛋白质糖基化学说和氧化应激学说[6]。氧化应激学说认为,糖尿病发生时,血糖的自氧化、多元醇途径以及蛋白糖基化等能显著增加氧自由基的产生[7]。生理条件下,晶状体具有两道抗氧化屏障:第1道包括谷胱甘肽、抗坏血酸以及维生素E,其功能主要是保护晶状体蛋白中巯基功能,还原H2O2和其他氧化物;第2道防线是晶状体内的抗氧化酶系统,主要包括GSH-PX、CAT、SOD及其同工酶CuZnSOD等。自由基的生成-降解平衡的异常是引起白内障的共同途径,它能与细胞膜中的聚不饱和脂肪酸相互作用,从而影响细胞膜的通透性,并引起Na+泵、Ca2+泵功能失调[8-9]。随后,自由基与晶状体蛋白氨基酸中的巯基反应,使之发生交联,导致蛋白变性并发生肉眼可见的混浊。
自从上世纪40年代以来,白藜芦醇一直颇受医学界的重视,尤其是其抗氧化与自由基能力尤为突出,体外实验发现白藜芦醇能清除多种活性氧簇[10]。Cu-白藜芦醇复合物能够在生理pH值范围内发挥类似SOD的作用。但目前关于白藜芦醇对糖尿病性白内障的防治作用的研究尚无相关报道。
本研究结果发现,白藜芦醇对糖尿病大鼠具有一定的降血糖作用,并在相应的时间内能有效改善晶状体的混浊程度。同时我们通过对晶状体中抗氧化的关键物质GSH-PX、CAT和SOD,以及CuZnSOD mRNA水平进行了检测,结果发现糖尿病大鼠中GSH-PX、CAT和SOD的活性显著下降,而白藜芦醇能部分维持晶状体的氧化还原状态,甚至逆转抗氧化酶类活性的降低,同时白藜芦醇能增强CuZnSOD的转录。这可能与直接清除活性氧自由基、抑制脂质过氧化作用、保护与激活抗氧化酶、抑制氧化酶有关。总之,本研究从晶状体的形态学、酶学等方面研究了白藜芦醇全身性给药对糖尿病大鼠晶状体的保护作用,证实了其具有一定的抗氧化酶活性,因此有望成为糖尿病性白内障治疗的一种潜在药物,但其确切的作用机制还有待进一步研究。
1 Zhou Q,Friedman DS,Lu H,Duan X,Liang Y,Yang X,et al.The epidemiology of age-related eye diseases in mainland China[J].Ophthalmic Epidemiol,2007,14(6):399-407.
2 Pollreisz A,Schmidt-Erfurth U.Diabetic cataract-pathogenesis,epidemiology and treatment[J].J Ophthalmol,2010,2010:608751.
3 Rodrigo R,Miranda A,Vergara L.Modulation of endogenous antioxidant system by wine polyphenols in human disease[J].Clin Chim Acta,2011,412(5-6):410-424.
4 施沃栋,王志良,罗 敏,范先群.链脲佐菌素诱发糖尿病大鼠模型视网膜形态学改变的观察[J].眼科新进展,2008,28(8):583-585.
5 Azuma M,Shearer TR,Matsumoto T,David LL,Murachi T.Calpain II in two in vivo models of sugar cataract[J].Exp Eye Res,1990,51(4):393-401.
6 Obrosova IG,Chung SS,Kador PF.Diabetic cataracts:mechanisms and management[J].Diabetes Metab Res Rev,2010,26(3):172-180.
7 Osawa T,Kato Y.Protective role of antioxidative food factors in oxidative stress caused by hyperglycemia[J].Ann N Y Acad Sci,2005,1043(4):440-451.
8 Maurya OP,Mohanty L,Bhaduri G,Chandra A.Role of anti-oxidant enzymes superoxide dismutase and catalase in the development of cataract:study of serumLevels in patients with senile and diabetic cataracts[J].J Indian Med Assoc,2006,104(7):394,396-397.
9 Nambu H,Kubo E,Takamura Y,Tsuzuki S,Tamura M,Akagi Y.Attenuation of aldose reductase gene suppresses high-glucoseinduced apoptosis and oxidative stress in rat lens epithelial cells[J].Diabetes Res Clin Pract,2008,82(1):18-24.
10 Subramanian L,Youssef S,Bhattacharya S,Kenealey J,Polans AS,van GPR.Resveratrol:challenges in translation to the clinic——a critical discussion[J].Clin Cancer Res,2010,16(24):5942-5948.

