结缔组织生长因子在2型糖尿病大鼠虹膜中的表达△
王 虹 吉 雷 刘远光 周萍萍 张 鹏 王冬兰
随着糖尿病发病率的逐年上升,糖尿病眼部并发症的发生率和致盲率也在逐年上升。虹膜红变即虹膜新生血管(new vascularization of iris,NVI)常继发于视网膜的缺血缺氧性疾病,而糖尿病视网膜病变(diabetic retinopathy,DR)是其发生的主要原因。研究表明视网膜在缺血缺氧状态下,机体分泌产生多种促血管生成因子,其中结缔组织生长因子(connective tissue growth factor,CTGF)在DR的视网膜以及微血管周细胞中的表达均显著上升。CTGF具有促进微血管周细胞程序性死亡,导致血管渗透性增加,促进DR的早期发展的作用。还有研究表明,CTGF在促进增生性DR的纤维增生和新生血管的形成中起着重要的作用。但其在糖尿病患者虹膜中的表达及其与虹膜病理改变的相关性研究尚未见报道。本实验通过电镜和光镜观察糖尿病大鼠及正常大鼠虹膜的特征,并比较CTGF在糖尿病大鼠和正常大鼠虹膜组织中表达的变化,探讨其相关性。
1 材料与方法
1.1 实验动物及分组 选取Wistar大鼠40只(佳木斯大学实验动物中心提供),体质量180~200 g,随机分成实验组和对照组。实验组为2型糖尿病大鼠,对照组为正常大鼠,每组各20只(各40只眼球)。将实验组及对照组中各15只眼球用酶联免疫吸附测定法(enzyme linked immunosorbent assay,Elisa)定量分析虹膜中CTGF的含量,另将实验组及对照组中其余25只眼球的虹膜组织用于光镜和电镜观察(其中光镜观察各15只眼球,电镜观察各10只眼球)。
1.2 动物处理
1.2.1 实验组 实验组大鼠给予35 mg·kg-1STZ(溶于枸橼酸缓冲液中,pH 7.2)腹腔注射1次,48 h后测空腹血糖,大于 11.1 mmol·L-1纳入实验组[1]。若小于11.1 mmol·L-1,则按照 5 ~10 mg·kg-1再进行腹腔注射1~2次,48~72 h后再次测定大鼠空腹血糖,若大于11.1 mmol·L-1则纳入实验组。
1.2.2 对照组 对照组大鼠给予同体积的缓冲液腹腔注射。
1.2.3 大鼠的饲养 所有动物自由进水,自然照明,实验组大鼠给予高脂、高热量饮食;对照组给予正常饮食,最长饲养90 d。定期观察大鼠的神态、体质量、尿量、饮食及眼部变化,特别是眼部虹膜的表现。实验组大鼠一经发现NVI形成(虹膜上出现一些细小弯曲、不规则的新生血管,多位于瞳孔缘)就立即处死。
1.3 镜下观察和Elisa检测
1.3.1 镜下观察 造模成功后处死大鼠取出虹膜组织,分别用甲醛和戊二醛固定、脱水、浸蜡、包埋、组织切片、染色后常规显微镜和透射电镜下观察虹膜组织的新生血管形态改变。对照组标本采集同实验组。
1.3.2 两组大鼠虹膜组织中CTGF含量检测 造模成功后取出两组大鼠的虹膜组织。将取出的虹膜组织碾碎后,以1200 r·min-1的速度离心取上清。用Elisa定量分析实验组和对照组大鼠虹膜中CTGF的含量。本实验应用双抗体夹心法测定标本中大鼠CTGF水平。按照上海丽臣生物有限公司所提供试剂盒内说明书进行检测。用纯化的大鼠CTGF抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入CTGF,再与辣根过氧化物酶(horse radish peroxidase,HRP)标记的CTGF抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物3,3’,5,5’-四甲基联苯胺显色。3,3’,5,5’-四甲基联苯胺在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的CTGF含量呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中大鼠CTGF浓度。
1.4 统计学分析 实验中所得计量资料数据结果均以均数±标准差表示,两组之间的比较用t检验,使用SPSS for Windows 16.0统计软件包进行统计。P<0.05为差异有统计学意义。
2 结果
2.1 两组大鼠虹膜中CTGF含量的比较 用Elisa定量分析实验组和对照组大鼠虹膜中CTGF的含量,结果见表1。
表1 实验组和对照组大鼠虹膜中CTGF的表达Table1 Expression of CTGF in iris of rats in the experimental and control groups(±s,ρ/ng·L-1)

表1 实验组和对照组大鼠虹膜中CTGF的表达Table1 Expression of CTGF in iris of rats in the experimental and control groups(±s,ρ/ng·L-1)
Note:Compared with control group,*P <0.001
Group n CTGF Experimental 15 1010.49 ±8.18*Control 15 644.82 ±8.08
2.2 光镜和电镜下两组大鼠虹膜的特征
2.2.1 光镜下观察 对照组切片中未见NVI,大部分切片均未见血管芽;而实验组大鼠虹膜切片中均可见NVI。实验组中可见纤维血管膜和血管膜出现,纤维血管膜是由少量的血管和较厚的胶原纤维组织组成(图1),该膜表面可见成纤维细胞、巨噬细胞等。血管膜主要是腔大壁薄的毛细血管(图2),其周围可见极少量成纤维细胞和巨噬细胞。
2.2.2 电镜下观察 电镜下观察对照组大鼠虹膜组织,未见NVI,而实验组大鼠虹膜组织中可见明显的NVI形成。实验组中可见纤维血管膜和血管膜。其中纤维血管膜的血管内皮细胞呈特殊性排列(图3),即血管内外侧壁薄厚不对称,主要表现在面向前房的血管外侧壁为内皮细胞的菲薄有孔的胞质突部分,而内侧壁多为内皮细胞有核部分,壁厚无孔。内皮细胞的胞核有明显的凹陷或为杆状核,胞质中存在少量线粒体和内质网,多见小泡,并有少量致密小体,偶见大的囊泡。基底部胞突少,基膜为单层,但在无周细胞处可增生达3~4层。周细胞明显可见,胞质清亮,肿胀变性,散在少数线粒体和小泡,细丝丰富,局部可有空化区,周细胞基膜增殖显著,可达5~6层之多。纤维血管膜表面存在的细胞分别具有角膜内皮细胞、巨噬细胞的超微结构特征。血管膜的血管内皮细胞呈扁平梭状(图4),细胞核呈椭圆形,胞质丰富,高尔基体发达,有中等量线粒体和粗面内质网,小泡较多。内皮细胞腔面有较多指状和不规则圆形胞突,基底部伸出锥形或指状胞突,此处基膜不完整,未见周细胞。血管内皮细胞由非色素细胞的树枝状胞突所围绕。
Figure 1 The fibrovascular membranes in NVI(HE,×400)NVI中纤维血管膜(HE,×400)

Figure 2 The vascular membrane in NVI(HE,×400)NVI中血管膜(HE,×400)

Figure 3 The fibrovascular membranes in NVI(TEM,×10 000)NVI中纤维血管膜(TEM,×10 000)
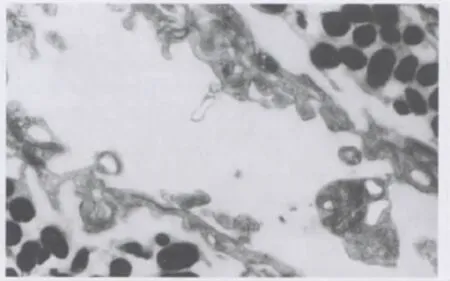
Figure 4 The vascular membrane in NVI(TEM,×10 000)NVI中血管膜(TEM,×10 000)
3 讨论
NVI即虹膜红变,常继发于视网膜的缺血缺氧性疾病(视网膜中央静脉阻塞、DR等疾病),而随着糖尿病发病率的逐年上升,由DR导致的NVI及新生血管性青光眼的发病率和致盲率也呈逐年上升趋势。而针对其病因的研究成为现在防治其发生的主要途径。近年研究表明,CTGF有诱导新生血管形成的作用。
早在1991年Bradham等[2]用亲和色谱法在人脐静脉内皮细胞条件培养基中发现了CTGF。该因子类属于 CCN(CTGF、Cyr61、nov)家族[3],富含半胱氨酸分泌性生长因子,具有刺激成纤维细胞和血管内皮细胞的生长、黏附及促进I型胶原等细胞外基质(extracellular matrix,ECM)分泌的作用,且参与组织纤维化和新生血管的形成。CTGF的结构特征:CTGF由349个氨基酸组成,相对分子质量为(36~38)×103,基因定位于染色体6q23.1,构成它的主要蛋白结构域包括:胰岛素样生长因子(insulin-like growth factor,IGF)结合区,血管性血友病因子(Von Willebrand factor)的C型重复区,血小板反应蛋白(thrombospondin,TSP)Ι型重复区[4],富含半胱氨酸的C末端。CTGF的特异性受体是一种多配基受体,为肝素依赖性的低密度脂蛋白受体相关蛋白/α-2巨球蛋白受体(LRP)[5]。CTGF的生物学特性:CTGF具有加速DNA合成,促进细胞增生[6],促进细胞黏附[7],增加血管平滑肌的生长和迁移[8],促进新生血管形成[9],刺激 ECM 的生成[10];ECM 具有促使脉络膜新生血管生成的作用,而CTGF可促使视网膜色素上皮细胞中ECM含量增加,从而使脉络膜新生血管形成[11]。在脉络膜新生血管形成的过程中,CTGF表达增加且对新生血管形成起潜在作用[12]。新生血管形成同时存在ECM的溶解、内皮细胞的增殖和迁移以及新基质成分的合成。CTGF主要通过调节ECM的结构和稳定性来促进新生血管的形成,主要表现为直接促进胶原的合成,加速ECM的产生,从而促进血管床的形成。CTGF本身就是一种促新生血管生成的因子,它可促进血管内皮细胞形成管腔,在血管生成的各个阶段都起到重要作用。此外,CTGF还可通过调控与新生血管相关的其他生长因子的表达来促进新生血管形成[13],CTGF所属蛋白是一种镶嵌蛋白,CTGF的C末端可作为血管内皮细胞的表面配体。在新生血管形成过程中,CTGF和血管内皮生长因子(vascular endothelial growth factor,VEGF)是同时表达的,且相互影响,现已证明VEGF与CTGF可直接连接形成复合物,调控与血管新生相关的其他生长因子的表达。CTGF被认为是TGF-β2的下游效应介质;而 TGF-β2可诱导 CTGF和VEGF表达增加;TGF-β2通过MAPK和PKC途径使VEGF表达增加;VEGF也可诱导体外培养的血管内皮细胞中TGF-β2和CTGF的表达。CTGF、VEGF和TGF-β2均具有刺激新生血管形成、细胞增殖的作用。同时TGF-β2可显著上调RPE细胞和成纤维细胞CTGF、VEGF的表达[14]。而缺氧可诱导CTGF表达[15-16]。
现研究表明碱性成纤维细胞生长因子、过氧化氢、γ-8T细胞、糖基化终产物、纤维蛋白酶、草酸钙晶体、糖皮质激素、活性氧、血栓素、机械性循环张力、前列腺素F2α等物质均可诱导CTGF表达;血管紧张素转化酶抑制剂、肝细胞生长因子、成纤维细胞生长因子、环腺苷酸、一氧化氮、维生素 E、己酮可可碱、吡非尼酮等物质可抑制CTGF表达。
本实验表明,2型糖尿病大鼠虹膜中CTGF的含量与NVI的生成有关。正因为CTGF的病理学效应及与其相关的血管增生因子的共同作用引起的DR及NVI形成,从而诱发新生血管性青光眼,最终导致失明。因此根据本实验研究结果,早期若减少CTGF的表达,可预防NVI的产生。这可对糖尿病晚期并发症(NVI、新生血管性青光眼)所导致的失明起到预防作用,为糖尿病晚期并发症的预防奠定一定的理论基础。
1 于德民,吴 锐,尹 潍,袁 勇.实验性链脲佐菌素糖尿病动物模型的研究[J].中国糖尿病杂志,1995,3(2):105-109.
2 Bradham DM,Igarashi A,Potter RL,Grotendorst GR.Connective tissue growth factor:a cysteine-rich mitogen secreted by human vascular endothelial cell is related to the SRC-induced immediate early gene product CEF-10[J].J Cell Biol,1991,114(6):1285-1294.
3 Brigstock DR.The connective tissue growth factor/cysteinerrich 61/nephroblastoma overexpressed(CCN)family[J].Endocr Rev,1999,20(2):189-206.
4 Grotendorst GR,Okochi H,Hayashi N.A novel transforming growth factor beta response element controls the expression of the connective tissue growth factor gene[J].Cell Growth Differ,1996,7(4):469-480.
5 Segarini PR,Nesbitt JE,Li DX,Hays LG,Yates JR,Carmichael DF,et al.The low density lipoprotein receptor-related protein/alpha2-macroglobulin receptor is a receptor for connective tissue growth factor[J].J Biol Chem,2001,276(44):40659-40667.
6 Kothapalli D,Grotendorst GR.CTGF modulates cell progression in cAMP-arrested NRK fibroblasts[J].J Cell Physiol,2000,182(1):119-126
7 Chen CC,Chen N,Lau LF.The angiogenic factor Cyr61 and connective tissue growth factor induce adhesive signaling in primary human skin fibroblasts[J].J Biol Chen,2001,276(13):10443-10452.
8 Fan WH,Pech M,Karnovsky MJ.Connective tissue growth factor stimulates vascular smooth muscle cell growth and migration in vitor[J].Eur J Cell Biol,2000,79(12):915-923.
9 Babic AM,Chen CC,Lau LF.FISP12/mouse connective tissue growth factor mediates endothelial cell adhesion and migration through integrin alphavbeta3,promotes endothelial cell survival,and induces angiogenesis in vivo[J].Mol Cell Biol,1999,19(4):2958-2966.
10 Shi-wen X,Pennington D,Holmes A,Leask A,Bradham D,Beauchamp JR,et al.Autocrine overexpression of CTGF maintains fibrosis:RDA analysis of fibrosis genes in systemic sclerosis[J].Exp Cell Res,2000,259(1):213-224.
11 Nagai N,Fujihara M,Wu T,Handa J.Effect of connective tissue growth factor on ECM modulation in retinal pigment epithelial cells[J].Vis Sci,2008,49(15):5541.
12 Watanabe D,Takagi H,Suzuma K,Oh H,Ohashi H,Honda Y.Expression of connective tissue growth factor and its potential role in choroidal neovascularization[J].Retina,2005,25(7):911-918.
13 Suzuma K,Naruse K,Suzuma I,Takahara N,Ueki K,Aiello LP,et al.Vascular endothelial growth factor induces expression of connective tissue growth factor via KDR,Flt1,and phosphatidylinositol 3-kinase-akt-dependent pathways in retinal vascular cells[J].J Biol Chem,2000,275(52):40725-40731.
14 Jesmin S,Zaedi S,Shimojo N,Iemitsu M,Masuzawa K,Yamaguchi N,et al.Endothelin antagonism normalizes VEGF signaling and cardiac function in STZ-induced diabetic rat hearts[J].Am J Physiol Endoerinol Metab,2007,292(4):E1030-E1040.
15 Kondo S,Kubota S,Shimo T,Nishida T,Yosimichi G,Eguchi T,et al.Connective tissue growth factor increased by hypoxia may initiate angiogenesis in collaboration with matrix metalloproteinases[J].Carcinogenesis,2002,23(5):769-776.
16 Lee YK,Kim EJ,Lee JE,Noh JW,Kim YG.Hypoxia induces connective tissue growth factor mRNA expression[J].J Korean Med Sci,2009,24(Suppl):S176-182.

