上调SIRT1减少同型半胱氨酸诱导的血管内皮细胞凋亡
吴凡,金培印,王学惠
动脉粥样硬化(AS)是冠状动脉硬化性心脏病、脑梗死及外周血管病等心脑血管疾病发病的主要原因之一,已成为引起心脑血管疾病患者致死和致残的重要原因[1]。目前,动脉粥样硬化的发病机制还未被完全阐明,但研究指出高血压、高血糖、吸烟遗传等因素是动脉粥样硬化发病的主要危险因素[2],而内皮细胞损伤及其引起的级联炎症反应是引起动脉粥样硬化病发生的重要步骤[3]。同型半胱氨酸(Hcy)是目前研究发现的通过损伤血管内皮细胞而促进动脉粥样硬化斑块形成的重要物质之一,其不仅被发现在冠状动脉硬化性心脏病、脑卒中等心脑血管疾病患者的血液含量增高,还被认为是心脑血管疾病发病的危险因素[4,5]。之前的研究表明[6,7],同型半胱氨酸在体外可以诱导血管内皮细胞凋亡,但其引起血管内皮细胞凋亡的分子机制还是清楚。
沉默信息调节因子1(SIRT1)是一种组蛋白去乙酰化酶,已经被证实参与调控哺乳动物细胞增殖、迁移和凋亡等等生物学功能[8]。Matteo等[9]研究发现,SIRT1通过抑制重建氧化还原平衡和恢复线粒体功能而抑制氧化应急引起的牛皮癣患者成纤维细胞的凋亡。此外,SIRT1还被发现可减轻缺氧引起的大鼠脑微血管内皮细胞损伤[10]和影响高糖环境下血管内皮细胞活力[11]。因此,本研究通过建立Hcy诱导血管内皮细胞体外损伤模型和过表达SIRT1内皮细胞系以研究Hcy处理对血管内皮细胞中SIRT1表达的影响,并探讨上调血管内皮细胞中SIRT1表达对Hcy诱导的血管内皮细胞凋亡的影响。
1 材料与方法
1.1 细胞培养与过表达SIRT1HMEC-1细胞培养在添加有10%胎牛血清(10100-147,thermofisher,美国)的DMEM培养基(12491-15,thermo fisher,美国)中,培养条件为37℃和5%CO2。过表达SIRT1的慢病毒(pcDNASIRT1)购买自上海吉凯基因医学科技股份有限公司,并以空载质粒(pcDNA3.1)作为对照,慢病毒感染HMEC-1细胞72 h后,通过qPCR和免疫印记法检测SIRT1表达以验证过表达效率。
1.2 CCK8试剂盒和检测细胞活性将0.2×105个HMEC-1细胞接种在96孔板的每个孔中,培养12 h后,向培养液中加入不同浓度的Hcy(0、1、2和4 mmol/L)处理24 h,去除细胞培养基后,将10 μl CCK8溶液(C0009,Beyotime Scientific,中国)和100 μl细胞培养基中加入到细胞中,在37℃和5%CO2下培养1 h后测定OD450。
1.3 流式细胞仪检测细胞凋亡将1.0×106个HMEC-1细胞接种在6孔板的每个孔中,培养12 h后,然后向培养液中加入不同浓度的Hcy(0、1、2和4 mmol/L)处理24 h,收集HMEC-1细胞,根据Annexin V-FITC/PI(40302ES20,上海翊圣生物科技有限公司,中国)细胞凋亡检测试剂盒所述检测细胞凋亡情况。
1.4 实时荧光定量PCR细胞经不同方式处理后,被收集后通过加入适量的RNAiso以提取RNA。根据提取RNA的含量加入ddH2O溶解RNA,NanoDrop 2000超微量分光光度计(Thermo Scientific,USA)测定RNA浓度。然后用PrimeScript RT reagent Kit with gDNA Eraser将提取的RNA反转录成cDNA。PCR参数设定:37℃/60 min,85℃/5 s。RT-qPCR:根据GoTaq™ qPCR Master Mix试剂盒说明书制备20 μl RT-qPCR系统,使用ABI 7500荧光定量PCR仪器进行扩增。PCR引物如下:
SIRT1-F: 5'-TCGCAACTATACCCAGAACATA GACA-3';
SIRT1-R: 5'-CTGTTGCAAAGGAACCATGACA-3'。β-actin引物参照之前的研究。
1.5 蛋白免疫印迹法细胞经不同方式处理后,被收集后通过RIPA裂解液(R0010,Solarbio,中国)从细胞中提取总蛋白。通过10%SDSPAGE分离50 μg总蛋白。将蛋白从SDS-PAGE凝胶转移到PVDF膜上,5%脱脂牛奶室温封闭1 h。用PBS洗涤膜3遍后,将膜与SIRT1抗体(ab189494,abcam,英国)在4℃孵育过夜。然后在室温下添加二抗孵育2 h。用PBS洗涤3次后,加入ECL溶液(WBKLS0100,北京新晶科生物技术有限公司,中国)进行检测。
1.6 统计学分析方法所有数据均采用SPSS 20.0统计学软件分析。计量资料采用均数±标准差(±s)表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 Hcy诱导血管内皮细胞凋亡将不同浓度的Hcy与血管内皮细胞培养24 h,通过CCK8试剂盒检测细胞活性后发现,与0 mmol/L Hcy组相比,经1、2和4 mmol/L Hcy处理的血管内皮细胞活性均显著降低,差异有统计学意义(P<0.05),且Hcy浓度越高,血管内皮细胞活性越低(如图1A所示);通过流式细胞仪分析不同组血管内皮细胞活性,与0 mmol/L Hcy组相比,经1、2和4 mmol/L Hcy处理的血管内皮细胞活性均显著增高,差异有统计学意义(P<0.05),并且Hcy浓度越高,细胞凋亡率越高,具体如图1B和1C所示。

图1 同型半胱氨酸以剂量依赖形式诱导血管内皮细胞凋亡
2.2 Hcy抑制血管内皮细胞SIRT1的表达将不同浓度的Hcy与血管内皮细胞培养24 h,经qPCR检测SIRT1 mRNA表达和经免疫印迹法检测SIRT1蛋白表达,结果显示:与0 mmol/L Hcy处理的血管内皮细胞相比,SIRT1在经1、2和4 mmol/L Hcy处理的血管内皮细胞中表达均显著降低,差异有统计学意义(P<0.05),且Hcy浓度越高,SIRT1在血管内皮细胞中表达越低(图2)。
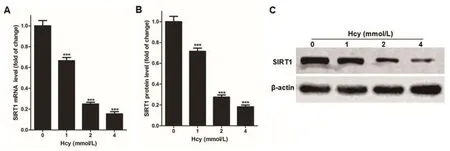
图2 同型半胱氨酸以剂量依赖形式抑制SIRT1在血管内皮细胞的表达
2.3 上调SIRT1减低Hcy诱导的血管内皮细胞的凋亡通过向血管内皮细胞中转入pcDNA-SIRT1以上调SIRT1在血管内皮细胞中的表达,通过向血管内皮细胞中转入空载质粒(pcDNA3.1)作为对照。经qPCR检测SIRT1 mRNA表达和经免疫印迹法检测SIRT1蛋白表达后发现,向血管内皮细胞中转入pcDNA-SIRT1成功显著上调血管内皮细胞中SIRT1的表达,差异有统计学意义(P<0.05),见图3A和图3B。将表达SIRT1不同的血管内皮细胞与2 mmol/L同型半胱氨酸培养24 h,通过CCK8试剂盒测定血管内皮细胞活性,结果显示:与pcDNA3.1组相比,pcDNA-SIRT1组血管内皮细胞活性显著降低,差异有统计学意义(P<0.05),如图3C所示;并通过流式细胞仪检测细胞凋亡,结果显示:与pcDNA3.1组相比,pcDNA-SIRT1组血管内皮细胞凋亡率显著增高,差异有统计学意义(P<0.05),见3D和3E。
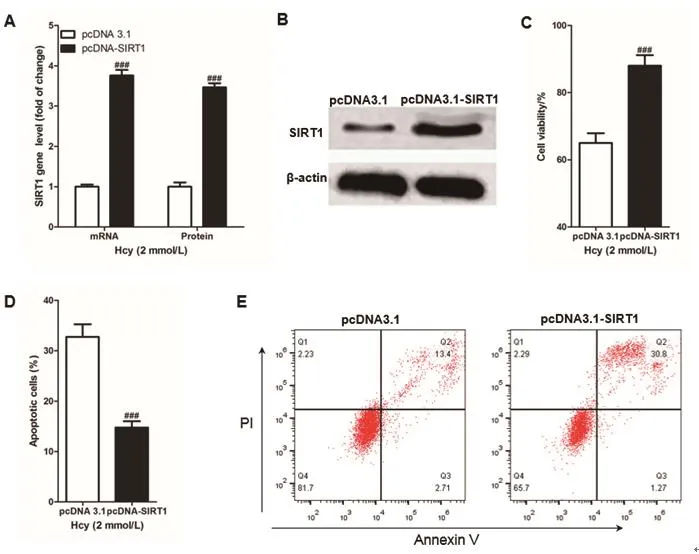
图3 过表达SIRT1抑制同型半胱氨酸诱导的血管内皮细胞凋亡
2.4 上调SIRT1对凋亡相关基因表达的影响将表达SIRT1不同的血管内皮细胞与2 mmol/L Hcy酸培养24 h,通过qPCR法检测凋亡相关基因的表达,结果显示:与pcDNA3.1组相比,pcDNASIRT1组血管内皮细胞中Bcl2表达显著降低,Bax和Cyt C表达显著增高,差异有统计学意义(P<0.05),图4。
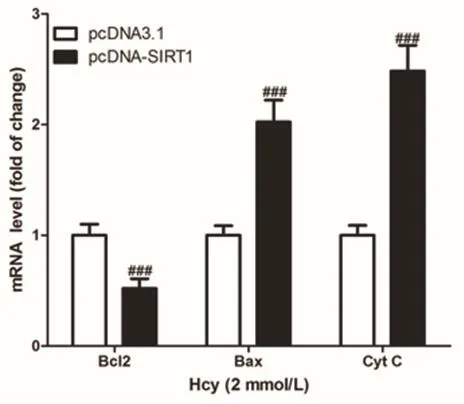
图4 过表达SIRT1对同型半胱氨酸诱导的血管内皮细胞凋亡基因表达的影响
3 讨论
Hcy是一种含硫氨基酸,为蛋氨酸和半胱氨酸代谢过程中产生的重要中间产物。正常生理条件下,血液中的Hcy在体内被分解代谢,因此Hcy在体内维持在较低浓度。当机体病变时,Hcy因分解代谢受阻堆积使得浓度升高。研究表明高Hcy会大幅增加冠心病、外周血管疾病及脑血管疾病的发病风险,而其分子机制可能与Hcy引起血管内皮细胞损伤有关[6,7]。本研究发现,经Hcy处理的血管内皮细胞活性降低、凋亡增加,且Hcy浓度越高,血管内皮细胞活性越低,凋亡率越高,即以浓度依赖形式在体外诱导血管内皮细胞损伤。与宓宝斌等[12]研究结果一致,研究发现经0.5、1.0和1.5 mmol/L Hcy处理的ECV-304内皮细胞凋亡率逐渐升高,表明Hcy引起的血管内皮细胞凋亡与浓度有关。
此外,本研究还发现,Hcy以剂量依赖形式抑制血管内皮细胞中SIRT1的表达,与之前研究结果类似。Zhao等[13]研究发现,红景天苷通过增加SIRT1蛋白的表达而氧化的低密度脂蛋白诱导的人脐静脉内皮细胞损伤。Marampon等[14]研究表明,维生素D,一种在心脑血管疾病患者中常表现为缺乏的维生素,可通过上调SIRT1蛋白的表达而减轻辐射引起的内皮细胞衰老和凋亡。SIRT1是sirtuin蛋白家族的成员之一,是一种烟酰胺腺嘌呤二核苷酸依赖性组蛋白去乙酰化酶,其不仅通过去乙酰化组蛋白而维持染色质和基因组的稳定,还可通过其去乙酰化非组蛋白的功能而参与细胞生物学功能的调控[8],且之前研究发现SIRT1参与调控血管内皮细胞的凋亡。本研究结果提示,SIRT1参与调控内皮细胞的凋亡,且上调其表达可减轻外界因素诱导的内皮细胞凋亡。结合本次研究,Hcy可能通过下调SIRT1蛋白的表达而诱导血管内皮细胞的凋亡。
为了研究SIRT1表达对Hcy诱导的内皮细胞凋亡的影响,我们建立了过表达SIRT1内皮细胞系,结果发现:SIRT1过表达可以显著降低Hcy诱导的血管内皮细胞凋亡。此外,我们研究还发现,SIRT1过表达可显著抑制促凋亡基因Bcl2的表达和促进抗凋亡基因Bax、Cyt C的表达。根据起始caspase的不同,可将哺乳动物细胞的凋亡分为三种基本途径[15,16]:一是外在途径,即由细胞表面的死亡受体如fas和肿瘤坏死因子受体家族引发;另一种称为内在途径或线粒体途径,由许多应激条件(如缺氧、低糖)、化学治疗试剂和药物所起始;第三种途径是内质网应激导致caspase-12的活化,从而导致凋亡。此前研究已经证实,Hcy主要通过线粒体凋亡途径引起的内皮细胞凋亡,即Hcy抑制内皮细胞Bcl-2的表达和促进内皮细胞Bax的表达而引起Bax/Bcl2比例失衡,引起细胞线粒体膜电位改变及线粒体细胞色素释放,激活Caspase家族蛋白,最终导致内皮凋亡的发生[17]。因此,上调SIRT1是通过抑制线粒体凋亡途径而抑制Hcy引起的内皮细胞凋亡。
综上所述,Hcy可能通过抑制SIRT1的表达而诱导血管内皮细胞凋亡,而上调SIRT1表达可减少Hcy诱导的血管内皮细胞的凋亡,SIRT1是开发减少Hcy引起的血管内皮细胞损伤的潜在靶点。

