自制可注射性明胶基止血剂治疗实验犬肝创伤的有效性
谢 霞,田江克,于腾飞,吕发勤,武 荣,罗渝昆,唐 杰
中国人民解放军总医院超声科,北京 100853
自制可注射性明胶基止血剂治疗实验犬肝创伤的有效性
谢 霞,田江克,于腾飞,吕发勤,武 荣,罗渝昆,唐 杰
中国人民解放军总医院超声科,北京 100853
目的探讨自制可注射性明胶基止血剂 (HIGM)即刻治疗实验犬肝创伤的有效性。方法将27只杂种犬经戊巴比妥钠全身麻醉后开腹暴露肝脏,制作肝创伤模型,然后随机分为治疗组、阳性对照组和阴性对照组3组,每组9只。治疗组病灶处直接注射自制止血剂,阳性对照组病灶处直接注射凝血酶溶液,而阴性对照组病灶处直接注射0.9%生理盐水。记录10 min止血时间及30 min腹腔内总出血量,并在创伤前,创伤后治疗前、后30 min比较平均动脉血压、心率及血常规,并观察治疗后30 min出血情况。结果治疗组止血时间 [(1.20±0.33)min]与出血量[(47.22±8.61)ml]均明显少于阳性对照组与阴性对照组 (P均<0.05)。治疗后30 min,3组间心率 (P=0.026)与平均动脉压 (P=0.013)差异均有统计学意义,且治疗组心率与平均动脉压均接近创伤前 (P>0.05)。治疗后30 min,肉眼观察治疗组无1例再出血,创伤区HIGM形成的血凝块填充完好,无局部炎症、感染和黏连形成;阳性对照组发现2例 (22.22%)再出血;阴性对照组所有动物仍可见出血。结论在无需按压的情况下,HIGM可以有效控制犬肝创伤出血,对野战外科具有潜在的应用价值。
止血;肝创伤;凝血酶;明胶;谷氨酰胺转氨酶
肝出血是腹部创伤后最常见的死亡原因之一[1],肝创伤后进行快速有效的治疗是降低死亡率和并发症的关键。尽管传统的机械治疗方法 (如:加压、缝合、结扎、或各类电外科技术)能有效快速地控制不同程度的出血[2],但是由于肝脏的质地较脆,位置难以接近,传统方法的应用价值有限[3]。伊拉克战争的最新统计数字表明,在潜在可预防的伤亡中大约90%的士兵死于不可控出血,其中50%以上是由不可压迫性的出血造成[4]。因此迫切需要设计出一种能用于急救和战地现场介入治疗的无需手动按压的可注射性止血剂。本研究初步探讨了自制可注射性明胶基止血剂 (hemostatics of injected gelatin matrix,HIGM)在无需外力按压下即刻控制实验犬肝创伤出血的有效性。
材料和方法
药物制备 实验用20%明胶溶液和谷氨酰胺转氨酶 (transglutaminase,TG)由北京化工大学提供,凝血酶冻干粉 (500 U)由北京第一生物化学药业有限公司提供,氯化钙注射液 (0.5 g/10 ml)由上海信谊金朱药业有限公司提供,0.9%生理盐水由本院提供。在制备HIGM前,必须将明胶溶液放置在37℃的水浴锅中加热,以便转化成流体状态。TG溶液是由粉状TG和氯化钙溶液按1 g/10 ml混合而成。凝血酶溶液是由凝血酶冻干粉和氯化钙注射液相混合配制而成。即刻使用前,将温热的明胶溶液(37℃)与凝血酶溶液及TG溶液相混合,3者以体积比1∶7∶2配制而成。对照组所使用的凝血酶溶液与HIGM相比含有相同单位和浓度的凝血酶,均为2 ml注射液含有2000 U凝血酶。
动物与麻醉 健康成年杂种犬27只,体重15~19 kg,雌雄不限,由中国人民解放军总医院动物实验中心提供并饲养,许可证号码:SCXK[Beijing]2007-0004。所有动物经历为期3d的适应期,于手术前18 h禁食。全身麻醉:静脉注射30 mg/kg戊巴比妥钠 (3%);持续麻醉:1次剂量为3 mg/kg戊巴比妥钠静脉给药。实施机械通气 (日本光电公司,DC-120H主机),设置为初始潮气量300 ml,峰值压力为6.5 cmH2O(1 mmH2O=9.8 Pa),呼吸频率设置为18次/min。将导管置入股动脉用于测量血压、心率,置入副头静脉用于液体复苏、麻醉及血样采集。连续监测血压及心率 (美国Puritan Bennett公司,微处理呼吸机7200系列)。静脉内注射乳酸林格氏液以确保平均动脉压不低于60 mmHg(1 mmHg=0.133 kPa)。
方法 将麻醉后的动物仰卧固定于动物手术台,用推毛器推去上腹部、前肢及股部内侧的毛。在无菌操作下正中切口,逐层打开腹腔,暴露肝脏。止血钳于肝左侧叶统一制作长×宽×深约为4 cm×4 cm×2 cm的创伤灶 (图1)。依据美国创伤外科协会(American Association for the Surgery of Trauma,AAST)分级标准[5],相当于Ⅲ~Ⅳ级肝外伤。27只动物在创伤前随机分为3组,即治疗组、阳性对照组和阴性对照组,每组9只。治疗组的肝创伤注射2 ml HIGM,阳性对照组注射2 ml凝血酶溶液,阴性对照组注射2 ml生理盐水。建模成功后,迅速将止血剂从创伤灶中央最深处开始注射 (图2)。记录止血时间、30 min腹腔内总出血量 (依据纱布浸血前后的重量变化和犬血的比重计算容量)和多个时间点的心率、平均动脉压和血常规参数,并于治疗后30 min后观察3组局部出血情况。
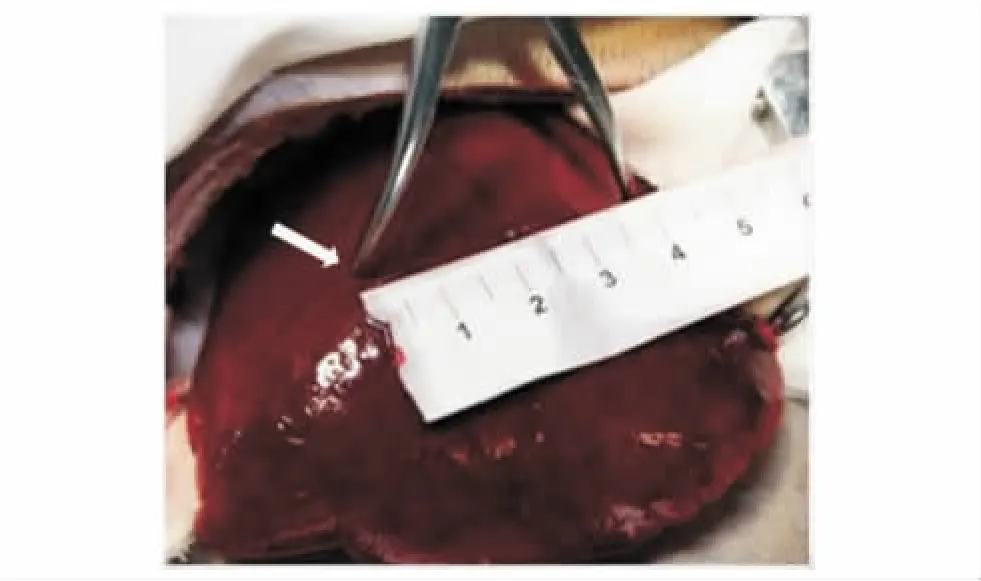
图1 止血钳置于肝左侧叶制作4 cm×4 cm×2 cm的创伤灶(白色箭头)Fig 1 Hemostatic clamp was uniformly positioned over the left lateral lobe of the liver to inflict a 4 cm×4 cm×2 cm blunt liver injury(white arrow)
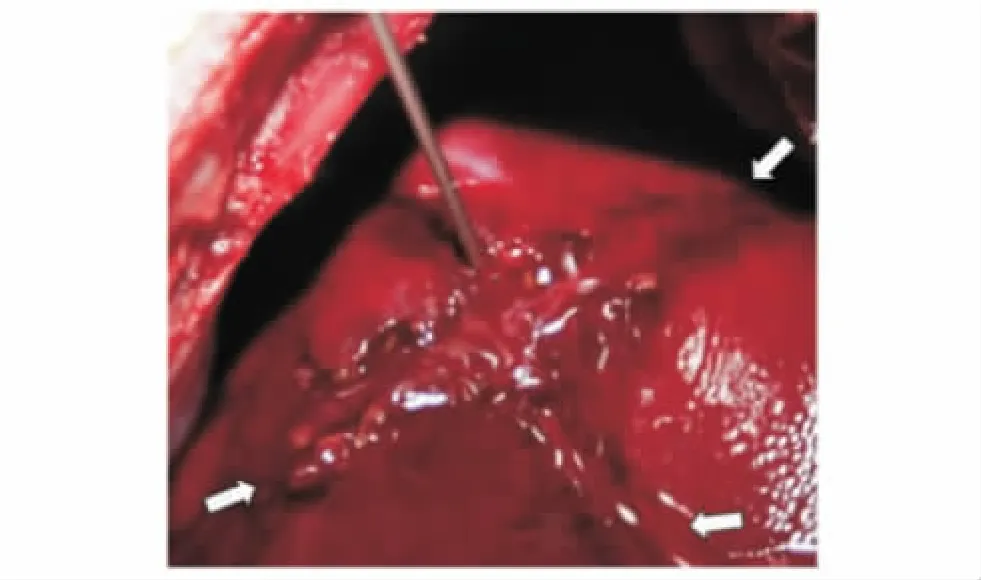
图2 将止血药从创伤灶中央的最深部开始注入 (白色箭头所示为创伤灶)Fig 2 The application of HIGM was began at the deepest part of the central liver lesion(white arrows show the traumatic lesion)
统计学处理 采用SPSS 17.0统计软件,计量资料以均数±标准差表示,采用单因素方差分析和Bonferroni's多重比较检验,多个时间点的参数比较采用两个因素的重复测量方差分析,P<0.05为差异有统计学意义。
结 果
动物的一般状态 治疗组与阳性、阴性对照组动物体重分别为 (16.82±1.06)、(16.73±1.15)和 (17.09±1.14)kg,3组间差异无统计学意义(P>0.05)。
HIGM对止血时间和出血量的影响 治疗组的平均止血时间为 (1.20±0.33)min(1.00~1.83 min),明显少于阳性对照组的 (6.70±0.64)min(5.83~7.83 min)(P<0.0001),阴性对照组10 min内均未完成止血。治疗组的平均出血量为 (47.22±8.61)ml(37.91~52.52 ml),明显少于阳性对照组的 (79.29±11.97)ml(64.82~105.72 ml)(P<0.0001)和阴性对照组的 (108.2±13.53)(85.43~135.21 ml)(P<0.0001)。
HIGM对心率的影响 创伤前,治疗组与阳性、阴性对照组的心率分别为(144.33±22.73)、(148.78±22.48)、(144.89±21.80)次/min,3组间差异无统计学意义 (P>0.05);创伤后治疗前,治疗组与阳性、阴性对照组分别为 (185.67±24.21)、(187.56±26.82)、(186.00±20.44)次/min,3组间差异也无统计学意义 (P>0.05);治疗后30 min,治疗组的心率降低到 (149.11±23.36)次/min,明显低于阳性对照组的 (182.67±24.53)次/min和阴性对照组的 (170.78±26.32)次/min(P均<0.05)。
HIGM对血压的影响 创伤前,治疗组与阳性、阴性对照组的平均动脉压分别为 (120.66±20.35)、(119.78±19.84)、(120.33±20.37)mmHg,差异无统计学意义 (P>0.05);创伤后治疗前,治疗组与阳性、阴性对照组分别为 (98.00±20.29)、(96.78±18.88)、 (97.67±20.37)mmHg,3组间差异也无统计学意义 (P>0.05),但均明显低于创伤前 (P均<0.0001);治疗后30 min,治疗组的平均动脉压上升到 (118.22±20.61)mmHg,明显高于阳性对照组的 (98.89±17.71)mmHg和阴性对照组的 (89.22±19.46)mmHg(P均 <0.05),但与创伤前相比差异无统计学意义 (P>0.05)。
HIGM对血常规参数的影响 治疗组与阳性、阴性对照组,在创伤前及创伤后治疗前的血细胞比容和血红蛋白差异均无统计学意义 (P均>0.05);治疗后30 min,治疗组的血细胞比容和血红蛋白均明显高于阳性和阴性对照组 (P均<0.05);治疗组的血细胞比容和血红蛋白平均值均在正常范围,而阳性和阴性对照组均不在正常范围。3组间创伤前,创伤后治疗前、后的血小板和白细胞差异均无统计学差异 (P均>0.05),其平均值也均在正常范围(表1)。
HIGM对再出血的影响 治疗后30 min,HIGM组无1例动物观察到再出血,肉眼观察治疗组创伤区HIGM形成的血凝块完整填充整个创口,无局部炎症、感染和黏连形成 (图3A),凝血酶组发现2例原创伤区域再出血 (图3B),阴性对照组所有动物创伤区域仍持续出血。
表1 不同状态的血常规参数值比较(n=9,± s)Table 1 Comparison of routine blood test results among different groups(n=9,± s)
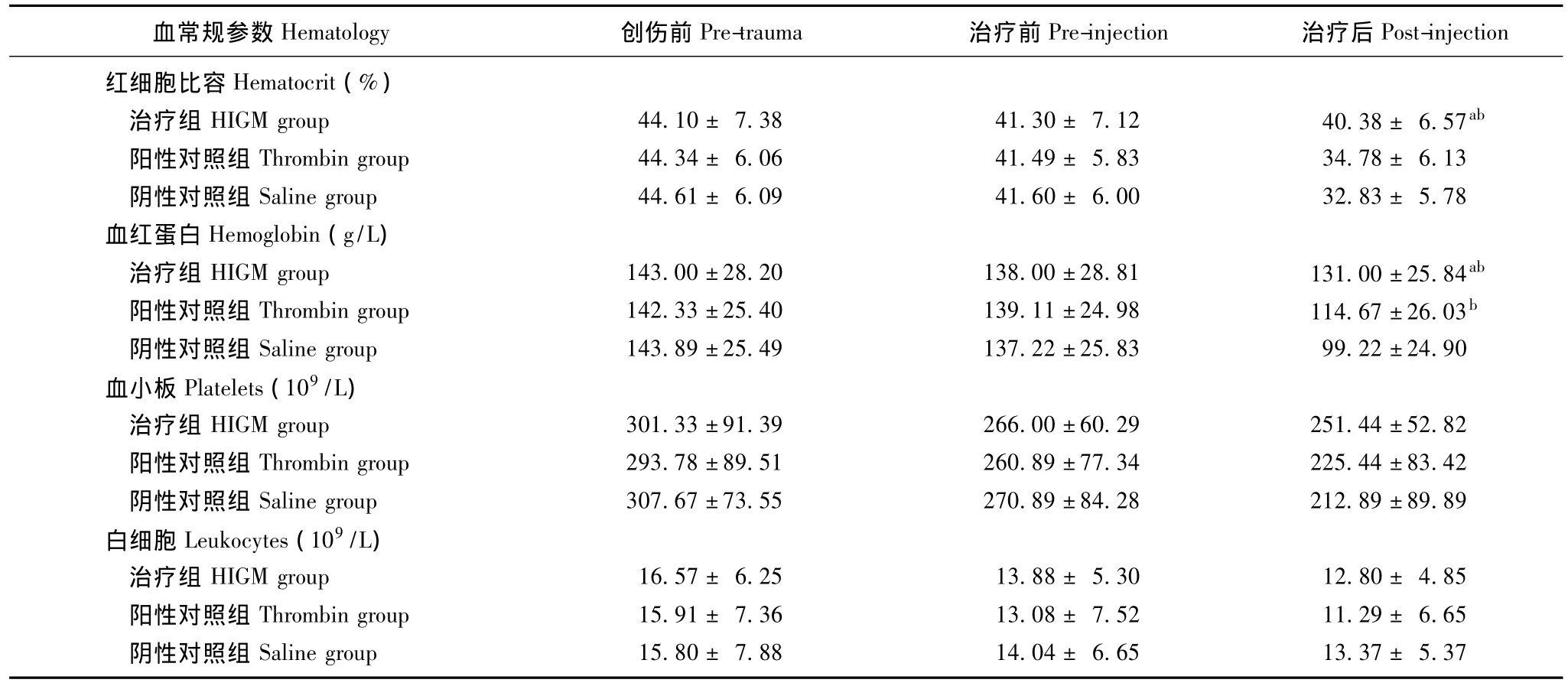
表1 不同状态的血常规参数值比较(n=9,± s)Table 1 Comparison of routine blood test results among different groups(n=9,± s)
HIGM:注射性明胶基止血剂;与阳性对照组比较,aP<0.05;与阴性对照组比较,bP<0.05HIGM:hemostatics of injected gelatin matrix;aP<0.05 compared with thrombin group;bP<0.05 compared with saline group
37 Post-injection红细胞比容Hematocrit(%)治疗组HIGM group 44.10±7.38 41.30±7.12 40.38±6.57ab阳性对照组Thrombin group 44.34±6.06 41.49±5.83 34.78±6.13阴性对照组Saline group 44.61±6.09 41.60±6.00 32.83±5.78血红蛋白Hemoglobin(g/L)治疗组 HIGM group 143.00±28.20 138.00±28.81 131.00±25.84ab阳性对照组 Thrombin group 142.33±25.40 139.11±24.98 114.67±26.03b阴性对照组 Saline group 143.89±25.49 137.22±25.83 99.22±24.90血小板Platelets(109/L)治疗组 HIGM group 301.33±91.39 266.00±60.29 251.44±52.82阳性对照组 Thrombin group 293.78±89.51 260.89±77.34 225.44±83.42阴性对照组 Saline group 307.67±73.55 270.89±84.28 212.89±89.89白细胞Leukocytes(109/L)治疗组HIGM group 16.57±6.25 13.88±5.30 12.80±4.85阳性对照组Thrombin group 15.91±7.36 13.08±7.52 11.29±6.65阴性对照组Saline group 15.80±7.88 14.04±6.65 13.37±5.血常规参数Hematology 创伤前Pre-trauma 治疗前Pre-injection 治疗后
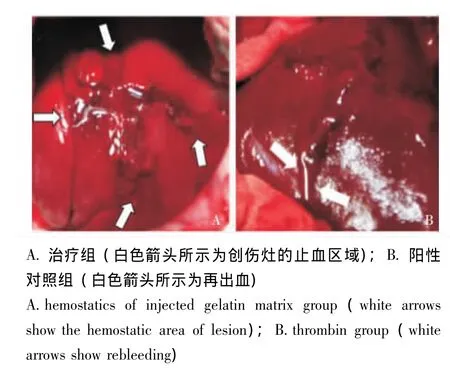
图3 治疗30 min后的出血情况Fig 3 Gross examinations 30 minutes after treatment
讨 论
当传统的外科治疗方法不能有效控制出血时,局部止血剂可以发挥重要止血作用。目前可供医生使用的局部止血剂品种繁多,如明胶海绵 (Gelfoam、urgifoam)、微原纤维胶原 (Avitene、elistat)、氧化再生纤维素 (Surgicel)和微孔多糖球 (Arista)[6]。这些止血剂需要一个完整的凝血级联来确保能够最终产生纤维蛋白,因此,当由严重的凝血病造成出血时,它们并不奏效[7]。氧化纤维素的酸性本质可以增加周围组织发生炎症的机率而推迟伤口愈合[8]。微原纤维胶原在血小板减少症患者身上使用效果差[9],更重要的是,其为固态敷料,主要应用于开放性创伤止血治疗,不能用于注射治疗。外用凝血酶作为另一种局部止血剂,已在临床广泛使用了60多年,它通过直接作用于血液中的纤维蛋白原,促使其转变为纤维蛋白而加速血液凝固。在控制局部出血方面,比上述提到的止血剂更有效[10]。然而,凝血酶形成的血凝块较松软、不稳固,不能完全控制出血。
本课题组自制的HIGM是TG交联的明胶与凝血酶混合液。明胶是胶原的降解产物,由动物的皮、骨等结缔组织中胶原经部分水解和热变性而得到的大分子蛋白质。由于其使用历史相对较长以及理化性能良好,使它得以安全地应用于食品、药品及医疗中,特别是在创伤敷料领域,如明胶类代血浆、止血类明胶海绵等[11]。TG广泛存在于动物、植物、微生物体内[12-14],由于其卓越的交联特性,被誉为21世纪超级交联剂,在食品、医药等领域展现出广泛前景[15]。明胶安全无毒、作用温和、生物相容性好,主要作用有:作为血液凝固的第13因子促进凝血作用[16];促进皮肤创伤愈合的作用[17];增强与关节软骨的黏强度;促进新合成胶原纤维的一体化修复[18]等。有报道认为,TG能在数分钟内与明胶交联形成一种凝胶,这种凝胶可以与潮湿的组织黏合,黏连强度可以等同或者优于纤维蛋白胶[19]。另有研究表明,在体外的猪皮测试中,明胶-TG黏合剂可以在潮湿条件下形成凝胶,这种凝胶可以抵抗200 mmHg的压力[20];在体内大鼠肝创伤模型中,它可以在2.5 min内彻底止血,也可以在2.5 min内控制大鼠股动脉的出血。此外,当TG与明胶交联形成的凝胶被冷却或加热时无明显变化,作用较稳固、较持久[21],而且TG与明胶具有良好的协同作用,交联形成的凝胶可以黏附在潮湿、不规则、倾斜或垂直的组织表面,从而封闭创面、促进伤口愈合。
AAST分级标准是创伤外科界最具权威的分级标准之一。按照此标准,Ⅲ级定义为:包膜下血肿范围>50%或进行性扩张,实质血肿>10 cm,实质裂伤深度>3 cm;Ⅳ级定义为:损伤累及25%~75%肝叶或一叶中累及1~3个肝段。在临床上此标准用于创伤患者,本研究依据此标准结合动物体重进行换算,建立Ⅲ~Ⅳ级肝创伤模型,即肝创伤程度大于Ⅲ级、小于Ⅳ级。经过近30年的临床实践,肝创伤治疗由单一手术治疗发展成非手术治疗占主导的医疗模式。在非手术治疗中,微创治疗发挥着重要作用,从而使不同创伤程度的患者得到更合理、有效的救治。实践证明,Ⅲ级以下肝创伤的保守治疗(即输液、制动、抗感染)成功率高,在密切观察病情变化情况下,90%以上患者不需要采取其他积极措施[22];而对Ⅳ级以上的肝创伤患者因出血多、生命体征不稳定,多需即刻开腹止血。而Ⅲ~Ⅳ级肝创伤可通过液体复苏实现暂时血流动力学稳定,此时可采用微创治疗方法实现止血,如超声造影引导介入止血治疗[23]。本研究选用Ⅲ~Ⅳ级肝创伤的目的就是为了采用介入性超声方法探讨自制HIGM控制肝创伤出血的效果。
本研究结果显示,治疗组的止血时间和腹腔内出血量明显小于两个对照组,治疗后30 min治疗组所有动物均成功止血,未见原发病灶再出血。分析原因可能是TG酶交联的原位明胶黏连强度牢固、持久,当与凝血酶溶液混合注射到创伤部位后成为均匀的胶状体,从而形成稳定的血凝块,封闭血液渗漏,最终提供一种具有强大黏接强度的凝胶,从而无需外力按压。治疗组创伤后的平均心率由186次/min降到治疗后的149次/min,平均动脉压由98 mmHg上升到118 mmHg,恢复效果明显优于其他两组,表明自制HIGM的止血作用较迅速,且出血被完全控制,无继发出血,因此心率减慢、血压回升。阳性对照组治疗后30 min有2例再出血,原因可能是凝血酶形成的血凝块较松软、抗张强度小,不能完全控制出血。
血常规作为手术前的常规化验检查,研究其与创伤严重程度、出血量的关系,对创伤结局的预测价值具有重要的临床意义。机体出血部位和失血量越多,血细胞比容及血红蛋白含量越低。本研究结果显示,两个对照组的血细胞比容及血红蛋白均明显低于治疗组。犬血细胞比容的正常范围是37.0%~55.0%,血红蛋白含量的正常范围是120~180 g/L。治疗后30 min,治疗组和阳性、阴性对照组的血细胞比容均值分别是40.38%、34.78%、32.83%,血红蛋白含量的均值分别是131.00 g/L、114.67 g/L、99.22 g/L。治疗组的血细胞比容及血红蛋白含量均在正常范围,而阳性和阴性对照组均低于正常范围,说明3组间血细胞比容及血红蛋白含量的差异不仅有统计学意义,还具有生物相关性。
本研究的局限性在于:(1)肝创伤模型是由止血钳于暴露的肝脏表面制作而成,不同于临床诊治的闭合性钝性肝创伤模型;(2)本研究是即刻治疗研究,因此其中、长期有效性和局部/全身不良反应尚不清楚,需要进一步探索;(3)由于动物与人在凝血功能方面的不同,需要设计更好的临床试验来确定临床止血功效。
总之,本研究结果显示自制HIGM可以在无需按压下有效控制犬肝创伤的出血,即刻观察未见明显不良反应,对急救及战地创伤介入治疗有潜在的应用价值。
[1]Lv F,Tang J,Li W,et al.Hemostatic agents injected directly into hepatic injury sites for liver trauma hemorrhage under the duidance of contrast-enhanced ultrasound:An animal experiment[J].Ultrasound Med Biol,2008,34(10):1604-1609.
[2]Hutchinson RW,Broughton D,Barbolt TA,et al.Hemostatic effectiveness of fibrin pad after partial nephretomy in swine[J].J Surg Res,2011,167(2):e291-e298.
[3]Chapman WC,Singla N,Genyk Y,et al.A phase 3,randomized,double-blind comparative study of the efficacy and safety of topical recombinant human thrombin and bovine thrombin in surgical hemostasis[J].J Am Coll Surg,2007,205(2):256-265.
[4]Kelly JF,Ritenour AE,McLaughlin DF,et al.Injury severity and causes of death from operation Iraqi freedom and operation enduring freedom:2003-2004 versus 2006 [J].J Trauma,2008,64(Suppl):S21-S27.
[5]Moore EE,Cogbill TH,Jurkovich GJ,et al.Organ injury scaling:spleen and liver(1994 revision)[J].J Trauma,1995,38(3):323-324.
[6]Neveleff DJ,Kraiss LW,Schulman CS.Implementing methods to improve perioperative hemostasis in the surgical and trauma settings[J].Aorn J,2010,92(5):s1-s15.
[7]Sarfati MR,DiLorenzo DJ,Kraiss LW,et al.Severe coagulopathy following intraoperative use of topical thrombin[J].Ann Vasc Surg,2004,18(3):349-351.
[8]Tomizawa Y.Clinical benefits and risk analysis of topical hemostats:a review[J].J Artif Organs,2005,8(3):137-142.
[9]Low RK,Moran ME,Goodnight JE.Microfibrillar collagen hemostat during laparoscopically derected liver biopsy [J].J Laparoendosc Surg,1993,3(4):415-420.
[10]Spotnitz WD,Burks S.Hemostats,sealants,and adhesives:components of the surgical toolbox[J].Transfusion,2008,48(7):1502-1516.
[11]于腾飞,唐杰,黄雅钦,等.明胶对人脐静脉内皮细胞株细胞相容性影响的研究[J].中华医学超声杂志 (电子版),2010,7(10):1639-1645.
[12]Folk JE.Transglutaminases[J].Biochemistry,1980,49:517-531.
[13]Falcone P,Serafini-Fracassini D,Del Duca S.Comparative studies of transglutaminase activity and substrates in different organs of helianthus tuverosus [J].Plant Physiol,1993,142(3):265-273.
[14]Yasueda H,Kumazawa Y,Motoki M.Purification and characterization of a tissue-type transglutaminase from red sea bream(Pagrus major)[J].Biosci Biotechnol Biochem,1994,58(11):2041-2045.
[15]Dube M,Zunker K,Neidhart S,et al.Effect of technological processing on the allergenicity of mangoes[J].J Apric Food Chem,2004,52(12):3938-3945.
[16]贺雷雨,王璋,李新华.谷氨酰胺转胺酶及其在食品加工中的应用[J].食物开发与应用,2004,25(2):82-84.
[17]谈丹,陈雄,黄敬华,等.微生物谷氨酰胺转胺酶对大鼠创伤愈合作用研究 [J].中国生物工程杂志,2007,27(8):85-90.
[18]Carsten E,Torsten B,Rainer M,et al.Bonding of articular cartilage using a combination of biochemical degradation and surface cross-linking[J].Arthritis Res Ther,2007,9(3):47.
[19]Chen T,Janjua R,McDermott MK,et al.Gelatin-based biomimetic tissue adhesive.Potential for retinal reattachment[J].J Biomed Mater Res B Appl Biomater,2006,77(2):416-422.
[20]Liu Y,Doron K,Wu LQ,et al.Biomimetic sealant based on gelatin and microbial transglutaminase:an initialin vivoinvestigation [J].J Biomed Mater Res B Appl Biomater,2009,91(1):5-16.
[21]Tianhong C,Heather D,Eleanor M,et al.Enzyme-catalyzed gel formation of gelatin and chitosan:potential for in situ applications[J].Biomaterials,2003,24(17):2831-2841.
[22]Myers GL,Dent DL,Stewart RM,et al.Blunt splenic injuries:dedicated trauma surgeons can achieve a high rate of nonoperative success in patients of all ages[J].J Trauma,2008,48(5):801-806.
[23]Tang J,Lv F,Li W,et al.Percutaneous injection of hemostatic agents for blunt hepatic trauma:an experimental study[J].Eur Radiol,2008,18(12):2848-2853.
Efficacy of Homemade Hemostatics of Injected Gelatin Matrix for Immediately Treating Blunt Hepatic Trauma in Canine Model without Additional Pressure
XIE Xia,TIAN Jiang-ke,YU Teng-fei,LÜ Fa-qin,WU Rong,LUO Yu-kun,TANG Jie
Department of Ultrasound,General Hospital of Chinese PLA,Beijing 100853,China
TANG Jie Tel:010-66939532,E-mal:txiner@vip.sina.com
ObjectiveTo explore the efficacy of homemade hemostatics of injected gelatin matrix(HIGM)for immediately treating blunt hepatic trauma in canine model without additional pressure.Methods
A total of 27 commercial hybrid dogs underwent celiotomy to establish hepatic trauma model after general anesthesia.The dogs were prospectively randomized into 3 groups:the treatment group(n=9,with the direct application of homemade hemostat),the positive control group(n=9,with thrombin solution),and the negative control group(n=9,with 0.9%normal saline).Time to hemostasis and intra-abdominal blood loss were recorded,and heart rate(HR),mean arterial pressure(MAP),and hematological parameters were compared among these three groups.Gross examinations were performed 30 minutes after surgery.ResultsSignificantlyshorter time to hemostasis[(1.20±0.33)min]and less blood loss[(47.22±8.61)ml]were observed in the treatment group than in control groups(P<0.05).HR and MAP among 3 groups were significantly different 30 min after injection(P<0.05),and HR and MAP in HIGM group were close to the state of pre-trauma(P>0.05).No cases of bleeding occurred in any animals in the treatment group,and no signs of infection and adhesion formation were evident due to exposure to HIGM.Two cases in the positive control group(22.22%)were found to have rebleeding.All animals in the negative control group experienced visible bleeding.ConclusionHIGM is effective for controlling bleeding after hepatic trauma without the additional compression,and therefore may be valuable in field surgery.
hemostasis;hepatic trauma;thrombin;gelatin;transglutaminase
Acta Acad Med Sin,2012,34(4):337-342
唐 杰 电话:010-66939532,电子邮件:txiner@vip.sina.com
R973+.1
A
1000-503X(2012)04-0337-06
10.3881/j.issn.1000-503X.2012.04.005
国家自然科学基金 (81071279)Supported by the National Natural Sciences Foundation of China(81071279)
2012-04-27)
·综 述·

