靶向敲减Ras癌蛋白融合型泛素连接酶E3的构建
马怡晖,张 强,谷雨妹,卢朝辉,陈 杰
1中国医学科学院 北京协和医学院 北京协和医院病理科,北京 100730 2郑州大学第一附属医院病理科,郑州 450052
靶向敲减Ras癌蛋白融合型泛素连接酶E3的构建
马怡晖1,2,张 强1,谷雨妹1,卢朝辉1,陈 杰1
1中国医学科学院 北京协和医学院 北京协和医院病理科,北京 1007302郑州大学第一附属医院病理科,郑州 450052
目的应用蛋白质敲减技术原理,构建理论上能够靶向敲减Ras癌蛋白的融合型泛素连接酶E3的真核表达载体。方法选取Raf-1、PI3K、RalGDS中能够与Ras蛋白相互作用的结合结构域和具有泛素连接酶活性的F-Box及U-Box作为功能结构域,采用分子克隆技术依次将其连入pcDNA3.1中构建融合蛋白表达载体,双酶切、PCR和测序技术检测连入核苷酸片段的正确性,Western blot检测融合蛋白表达载体在真核细胞内表达的正确性和作用有效性。结果
成功获得6个融合蛋白E3表达载体,5个能够在真核细胞内有效表达,其中 (RBD+CRD)Raf-1-U-Box-pcDNA3.1能够敲减人胰腺癌细胞系PANC-1细胞中Ras蛋白。结论成功构建能够靶向敲减Ras癌蛋白的融合蛋白表达载体,为下一步应用蛋白质敲减技术奠定了实验基础。
泛素;蛋白酶体;泛素连接酶;Ras癌蛋白
泛素-蛋白酶体途径 (ubiquitin-proteasome pathway,UPP)主要由泛素分子、泛素激活酶E1、泛素转移酶E2、泛素连接酶E3和26S蛋白酶体构成,其中E3负责蛋白底物同UPP途径的联系,是决定UPP特异性降解蛋白底物的关键酶[1]。靶向泛素化降解蛋白质技术 (又名蛋白质敲减技术)是利用UPP原理,构建某个能与靶蛋白特异结合的融合型泛素连接酶E3,达到降解靶蛋白的目的[2-3]。本研究利用该技术,以Ras癌蛋白作为靶向泛素化降解的对象,构建了能够靶向敲减Ras癌蛋白的融合型泛素连接酶的表达载体,以期在蛋白水平上实现细胞内对Ras的降解。
材料和方法
试剂和仪器 基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒 (北京天根生物有限公司),DNA聚合酶、dNTP、各种核酸内切酶、T4连接酶 (日本Takara公司),质粒提取试剂盒、lipofection2000转染试剂、高溶点琼脂糖 (美国Invitrogen公司),鼠抗人β-actin单克隆抗体、鼠抗人Ras单克隆抗体和c-Myc标签单克隆抗体 (美国Santa cruz公司),HPR标记二抗 (北京中山金桥生物有限公司),丙烯酰胺、N'N'-亚甲基双丙烯酰胺、过硫酸胺、SDS(美国Pierce公司),DMEM培养基 (美国Gibco公司),胎牛血清(天津灏阳公司),ECL发光液 (北京普利莱公司),医用X光片 (厦门Koda公司)。
细胞培养 人HEK293T和胰腺癌细胞系PANC-1用DMEM培养基培养于37℃、5%CO2孵箱中。
融合蛋白E3表达载体构建原则 选取Ras下游效应分子 Raf-1[4-5]、PI3K[6]和 RalGDS[7]中 能 够 与Ras蛋白相互作用的氨基酸片段作为结合结构域,E3 泛素连接酶 TrCP[8]和 CHIP[9]中的 F-Box 和 U-Box作为功能结构域。结合结构域和功能结构域通过GS(胱氨酸和丝氨酸)重复片段相串联,并在C-末端引入Myc标签,便于后期在蛋白水平直接检测融合蛋白的表达情况 (图1)。其中连入的由GS重复序列构成的寡氨基酸片段具有较好的柔韧性,能够使其两端的多肽片段具有相对自由的活动空间以利于形成正确的空间构型。
引物设计和合成 上游引物设计原则为:5'-保护碱基-酶切位点-ATG-核甘酸序列-3',下游引物中避开终止密码子,使扩增片段连入pcDNA3.1载体后能够与该载体自带的Myc标签序列通读。为了保证所截取的多肽片段能够有效表达,并在真核细胞内折叠成正确的空间构型,分别向选取片段的上下游各延伸5~10个氨基酸 (相当于15~30个核苷酸序列)。表1列出了扩增各核苷酸片段所用的引物,均在上海生工生物工程技术服务有限公司合成;表2列出了截取的多肽片段在原蛋白分子中的氨基酸位点及选用的酶切位点。
RNA的提取及逆转录 参照Trizol Reagent试剂盒说明书,提取组织及细胞中的总RNA,采用逆转录反应体系合成cDNA,以cDNA为模板扩增相应的目的基因或片段。表3列出了各表达载体中连入核苷酸的理论数目。
融合蛋白表达的检测 用RIPA裂解液处理瞬时转染E3表达载体48 h后的HEK293T细胞,提取相应的蛋白,以β-actin作为内参,采用Western blot方法对不同处理组中携带有Myc标签的融合蛋白表达进行检测。表3列出了各融合蛋白分子氨基酸理论数目及相应的蛋白相对分子质量。

图1 融合型泛素连接酶E3表达载体构建原则Fig 1 Construction of the chimeric E3s expression plasimds

表1 扩增各片段的引物序列Table 1 Sequences of the primers
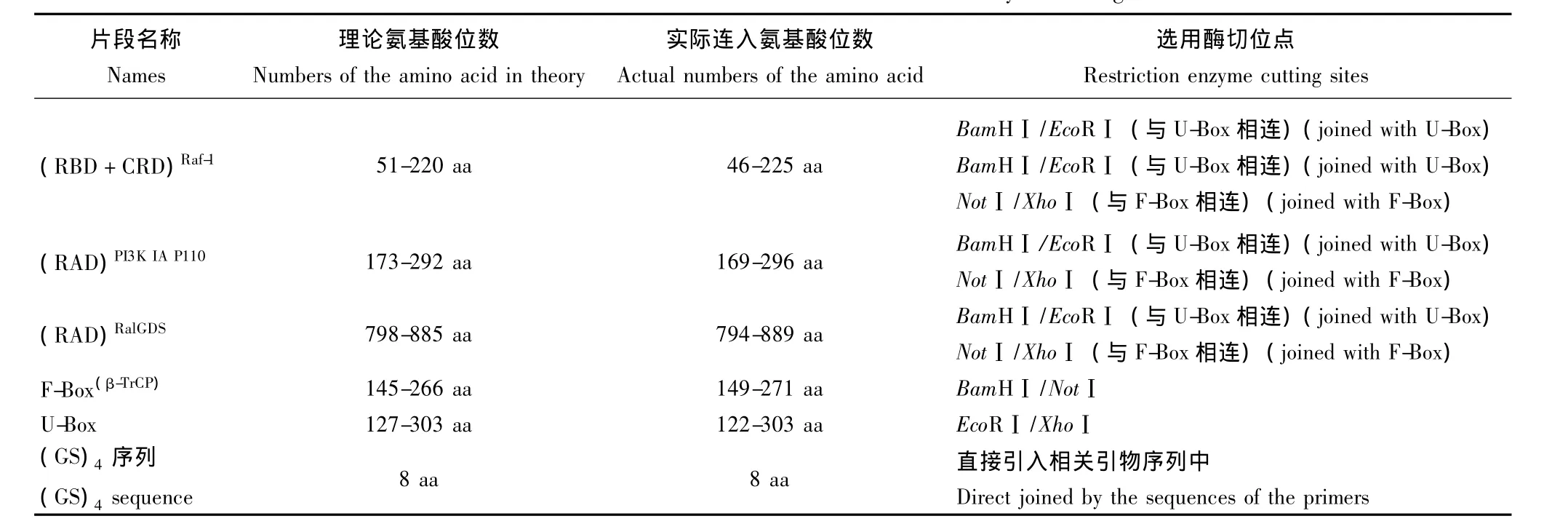
表2 各多肽片段在原蛋白分子中的氨基酸位点及载体构建中选用的酶切位点Table 2 Sites of the amino acid and the restriction enzyme cutting
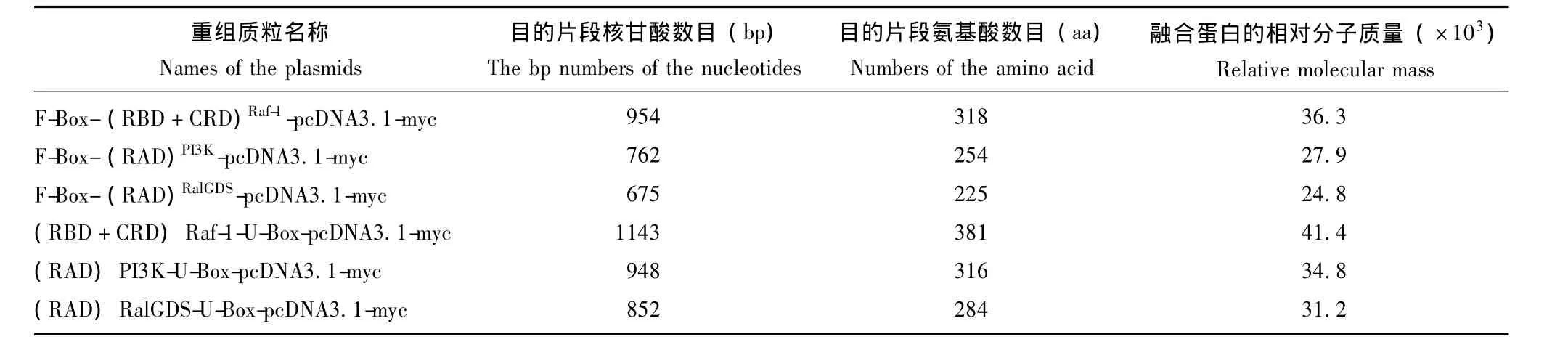
表3 各个融合蛋白理论分子大小Table 3 Molecular weight of all the chimeric proteins in therory
结 果
E3表达载体的鉴定 将表达载体经相应的双酶切后,采用10%聚丙烯酰胺凝胶电泳鉴定酶切片段,结果显示所获得的6个重组质粒连入了相应大小的核苷酸片段 (图2)。以E3表达载体作为模板,经PCR扩增,得到了相应大小的核苷酸片段 (图3)。最终经测序证实,所有表达载体连入的核苷酸序列是正确的 (图4)。
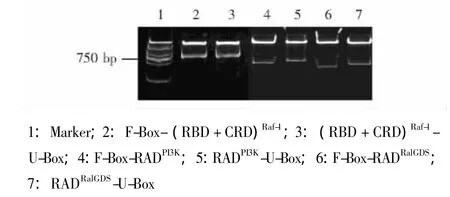
图2 10%聚丙烯酰胺凝胶电泳验证E3表达载体双酶切片段Fig 2 Identification of the double digestion E3 fragments by 10%polyacrylamide gel electrophoresis
E3表达载体在真核细胞内表达有效性验证 将所构建的6个E3表达载体瞬时转染人HEK293T细胞,于转染后48 h收集细胞,裂解后上样检测各重组质粒Myc标签表达情况。设立pcDNA3.1空载体转染组作为对照,以管家基因β-actin作为内参,结果显示除RADPI3K-F-Box-pcDNA3.1重组质粒未见表达,其余5个重组质粒在瞬时转染后48 h即有表达,所表达融合蛋白相对分子质量的大小和理论值基本一致 (图5)。
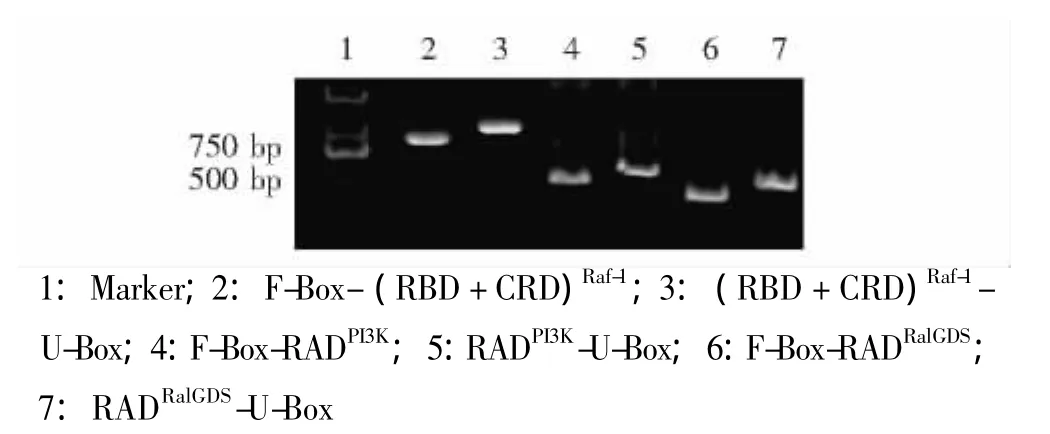
图3 PCR验证E3表达载体连入的核苷酸序列Fig 3 Identification of the sequences of the chimeric E3 plasmids by PCR
图4 各E3表达载体测序图谱Fig 4 Sequencing map of the E3 chimeric plasmids
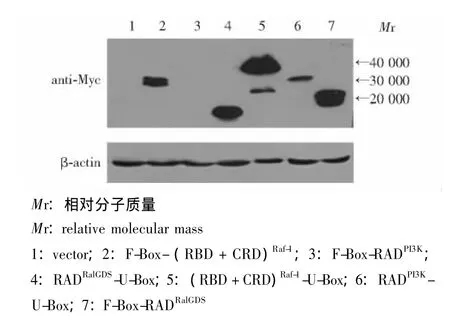
图5 各E3表达载体瞬时转染HEK293T细胞48 h后融合蛋白的表达Fig 5 Expression of the chimeric proteins in HEK293T cells after 48 hours of transient transfection
E3表达载体敲减PANC-1细胞中Ras蛋白有效性验证 将所构建的6个E3表达载体瞬时转染胰腺癌细胞系PANC-1,并于转染后48 h和72 h收集细胞,裂解后上样检测细胞内源性Ras蛋白水平,同时检测各个重组质粒Myc标签表达情况,设立未处理组、Lipofectamine2000单独处理组及pcDNA3.1空载体转染组作为对照,以管家基因β-actin作为内参,结果显示 (RBD+CRD)Raf-1-U-Box-pcDNA3.1组在转染后48 h和72 h均降解了Ras蛋白 (图6)。
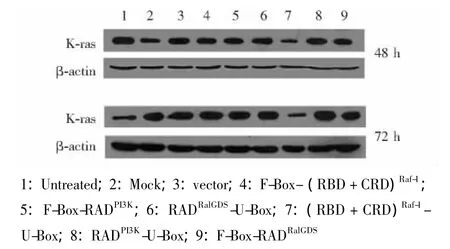
图6 各E3表达载体瞬时转染PANC-1细胞48 h和72 h后内源性Ras蛋白表达水平Fig 6 Expression levels of endogenous Ras in PANC-1 cells after 48 or 72 hours of transient transfection of the E3 plasmids
讨 论
Ras基因编码具有GTP酶活性的膜相关蛋白[10],当Ras基因突变后,其编码产物与GTP结合处于持续活化状态,能够引起细胞恶性转化。研究发现,在胰腺癌[11]、结肠癌[12]、肺癌[13]等多种人类恶性肿瘤中存在着较高频率的Ras基因点突变,具有该突变的患者生存率明显低于未突变者。以往人们利用反义寡核苷酸和RNAi技术在基因水平成功沉默了Ras的表达,为临床应用基因手段治疗恶性肿瘤带来了革新[14-15]。不同于基因水平的沉默手段,蛋白质敲减技术是构建某个能够与靶蛋白特异结合的融合型泛素连接酶E3,直接在蛋白水平实现对某种癌蛋白的降解。融合型E3原则上含有两个结构域,即结合结构域和功能结构域,结合结构域与选定的底物结合,功能结构域使被结合的底物通过泛素-蛋白酶体途径降解。利用这种技术路线,研究者已经先后在不同肿瘤细胞内成功敲减了诸如 Rb[2-3]、β-catenin[16-17]、CyclinA/CDK2[18]、c-Myc[19]以及 Her-2[20]等癌蛋白,体内外实验表明,肿瘤细胞的恶性生物学特性在一定程度上得到了逆转,初步显示了蛋白质敲减技术作为另一种沉默基因表达手段的潜在应用价值。
本研究初步尝试利用蛋白质敲减原理,选择Ras癌蛋白作为靶点,将Ras下游3种不同效应分子中的RAD/RBD多肽片段分别与两种不同泛素连接酶的功能结构域F-Box和U-Box融合表达,共构建出6个融合蛋白表达载体。实验结果显示,瞬时转染人HEK293T细胞后,F-Box-(RBD+CRD)Raf-1-pcDNA3.1、F-Box-RADRalGDS-pcDNA3.1、(RBD+CRD)Raf-1-U-BoxpcDNA3.1、RADPI3K-U-Box-pcDNA3.1和RADRalGDS-U-BoxpcDNA3.1可以有效表达出相应的目的蛋白,其中(RBD+CRD)Raf-1-U-Box-pcDNA3.1能够在PANC-1细胞内实现对Ras蛋白的降解。
相较于核酸分子较为简单的一级和二级结构,蛋白分子的空间构型要复杂得多,为了提高融合蛋白E3作用的特异性和有效性,结构域应尽可能截取短或小的片段,以排除非相关结构或序列对相互作用的干扰。此外,依据 F-Box在 TrCP中位于 N-末端,U-Box在CHIP中位于C-末端,还应将F-Box和U-Box放在相应融合蛋白的 N-和 C-末端[21],使连入的多肽片段能够折叠成正确的空间构型以发挥正常功能。本研究中,F-Box-RADPI3K-pcDNA3.1重组质粒未见表达,其原因可能是其表达出的融合蛋白形成了某种不利于在真核细胞体系中稳定存在的空间构型,于翻译后极短时间内被降解,应用常规实验手段不能被检测到[22]。
本研究一系列融合蛋白表达载体的成功构建为在肿瘤细胞中靶向敲减Ras蛋白的研究工作奠定了基础,下一步将以 (RBD+CRD)Raf-1-U-Box为研究重点,进一步探讨该表达载体发挥作用的原理和机制。
[1]Pickart CM.Mechanisms underlying ubiquitination [J].Annu Rev Biochem,2001,70:503-533.
[2]Zhou P,Bogacki R,McReynolds L,et al.Harnessing the ubiquitination machinery to target the degradation of specific cellular proteins[J].Mol Cell,2000,6(3):751-756.
[3]Zhang J,Zheng N,Zhou P.Exploring the functional complexity of cellular proteins by protein knockout[J].Proc Natl Acad Sci USA,2003,100(24):14127-14132.
[4]Mott HR,Carpenter JW,Zhong S,et al.The solution structure of the Raf-1 cysteine-rich domain:a novel ras and phospholipid binding site[J].Proc Natl Acad Sci USA,1996,93(16):8312-8317.
[5]Bondeva T,Balla A,Várnai P,et al.Structural determinants of Ras-Raf interaction analyzed in live cells[J].Mol Biol Cell,2002,13(7):2323-2333.
[6]Wymann MP,Pirola L.Structure and function of phosphoinositide 3-kinases[J].Biochim Biophys Acta,1998,1436(1-2):127-150.
[7]Quilliam LA,Rebhun JF,Castro AF.A growing family of guanine nucleotide exchange factors is responsible for activation of Ras-family GTPases[J].Prog Nucleic Acid Res Mol Biol,2002,71:391-444.
[8]Deshaies RJ.SCF and Cullin/Ring H2-based ubiquitin ligases[J].Annu Rev Cell Dev Biol,1999,15:435-467.
[9]Aravind L,Koonin EV.The U box is a modified RING finger:a common domain in ubiquitination [J].Curr Biol,2000,10(4):R132-134.
[10]Qian J,Niu J,Li M,et al.In vitromodeling of human pancreatic duct epithelial cell transformation defines gene expression changes induced by K-ras oncogenic activation in pancreatic carcinogenesis [J].Cancer Res,2005,65(12):5045-5053.
[11]Shi C,Daniels JA,Hruban RH.Molecular characterization of pancreatic neoplasms[J].Adv Anat Pathol,2008,15(4):185-195.
[12]Fang JY,Richardson BC.The MAPK signalling pathways and colorectal cancer[J].Lancet Oncol,2005,6(5):322-327.
[13]Mascaux C,Iannino N,Martin B,et al.The role of RAS oncogene in survival of patients with lung cancer:a systematic review of the literature with meta-analysis [J].Br J Cancer,2005,92(1):131-139.
[14]Fan HY,Liu Z,Paquet M,et al.Cell type-sepcific mutations of Kras and Pten document proliferation arrest in granulosa cells versus oncogenic insult to ovarian surface epithelial cells[J].Cancer Res,2009,69(16):6463-6472.
[15]Seldler B,Schmidt A,Mayr U,et al.A Cre-loxP-based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors [J].Proc Nati Acad Sci USA,2008,105(29):10137-10142.
[16]Zhang J,Zheng N,Zhou P.Exploring the functional complexity of cellular proteins by protein knockout[J].Proc Natl Acad Sci USA,2003,100(24):14127-14132.
[17]Liu J,Stevens J,Matsunami N,et al.Targeted degradation of beta-catenin by chimeric F-box fusion proteins[J].Biochem Biophys Res Commun,2004,313(4):1023-1029.
[18]Yokoyama Y,Nimura Y,Nagino M.Advances in the treatment of pancreatic cancer:limitations of surgery and evaluation of new therapeutic strategies[J].Surg Today,2009,39(6):466-475.
[19]Hatakeyama S,Watanabe M,Fujii Y,et al.Targeted destruction of c-Myc by an engineered ubiquitin ligase suppresses cell transformation and tumor formation[J].Cancer Res,2005,65(17):7874-7879.
[20]Li X,Shen L,Zhang J,et al.Degradation of HER2 by Cblbased chimeric ubiquitin ligases[J].Cancer Res,2007,67(18):8716-8724.
[21]Gorman C,Skinner RH,Skelly JV,et al.Equilibrium and kinetic measurements reveal rapidly reversible binding of Ras to Raf[J].Biol Chem,1996,271(12):6713-6719.
[22]Ciechanover A,Orian A,Schwartz AL.Ubiquitin-mediated proteolysis:biological regulation via destruction[J].Bioessays,2000,22(5):442-451.
Construction of Chimeric E3s Expression Plasimds Targeting Oncoprotein Ras
MA Yi-hui1,2,ZHANG Qiang1,GU Yu-mei1,LU Zhao-hui1,CHEN Jie1
1Department of Pathology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China2Department of Pathology,the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
CHEN Jie Tel:010-69155490,E-mail:xhblk@163.com
ObjectiveTo construct certain chimeric E3s expression plasmids targetting oncoprotein Ras by harnessing the theory of protein knockdown.MethodsWe chose the binding domain of Raf-1,PI3K,Ral-GDS,and the function domain of F-Box as well as the U-Box to construct the plasmids.Then used the double enzyme,PCR,and sequence to test the validity and integrity of the cloned nucleotide fragments.The expression efficiency of the plasmids in eukaryotic cells was detected by Western blot analysis.ResultsFive of 6 plasmids in this study expressed the corresponding fusion proteins in HEK293T cells,and(RBD+CRD)Raf-1-U-Box-pcDNA3.1 can knocked down the protein level of Ras in PANC-1 cells.Conclusions We successfully constructed the chimeric E3 expression plasmids,which provides a solid basis for further research on protein knockdown.
ubiquitin;proteasome;ubiquitin ligase;Ras
国家自然科学基金 (30270599、3047197、30973470、81172334)、卫生部卫生行业科研专项项目 (200802011)和教育部高等学校博士学科点专项科研基金 (20060023013)Supported by the National Natural Sciences Foundation of China(30270599,3047197,30973470,81172334),the Ministry of Health Industry Scientific Research Projects(200802011),and the Research Fund for the Doctoral Program of Higher Education of China(20060023013)
陈 杰 电话:010-69155490,电子邮件:xhblk@163.com
R446.8
A
1000-503X(2012)04-0313-06
10.3881/j.issn.1000-503X.2012.04.001
Acta Acad Med Sin,2012,34(4):313-318
2011-11-24)
·论 著·

