一种高效诱导胚胎胰腺细胞分化为内分泌细胞培养方法的建立
陈 芳,马凤霞,池 颖,赵钦军,杨少光,卢士红,韩忠朝
中国医学科学院 北京协和医学院 血液学研究所&血液病医院实验血液学国家重点实验室,天津 300020
一种高效诱导胚胎胰腺细胞分化为内分泌细胞培养方法的建立
陈 芳,马凤霞,池 颖,赵钦军,杨少光,卢士红,韩忠朝
中国医学科学院 北京协和医学院 血液学研究所&血液病医院实验血液学国家重点实验室,天津 300020
目的建立一种使胚胎胰腺细胞体外高效分化为成熟内分泌细胞的培养方法。方法体外分离小鼠12.5 d的胚胎胰腺,培养于下层为培养基的漂浮膜上7 d,采用免疫组织化学方法检测胰腺祖细胞标志胰腺十二指肠同源盒基因1(PDX-1)和神经源素3(Ngn3)的表达及内、外分泌细胞的标志胰岛素、胰高血糖素、羧肽酶表达,定量PCR检测培养过程中胰腺标志表达的变化。结果胚胎胰腺培养1 d后,有大量胰腺祖细胞标志表达,且这些胰腺祖细胞处于增殖状态。培养3 d后,仍有胰腺祖细胞的标志大量表达。培养7 d后,分化的胰腺表达成熟内、外分泌细胞的标志,且胰腺标志的表达与体内表达模式一致。结论建立了一种使胚胎胰腺细胞体外高效分化为成熟内分泌细胞的培养方法。
胰腺;胰岛素;腺十二指肠同源盒基因1;神经源素3
中国糖尿病发病率已高达9.6%,其中以2型糖尿病为主,所占比例达到93.7%,1型糖尿病约占5%,其他类型糖尿病仅占0.7%,糖尿病已经成为继肿瘤、心血管病变之后位居第三的严重威胁人类健康的慢性疾病[1]。随着胰岛移植技术的发展,胰岛移植成为治疗胰岛素依赖型糖尿病的一种有效方法。有研究显示,胰岛移植不仅能够纠正糖代谢的紊乱,而且能够防止或逆转糖尿病的血管病变,为彻底治疗糖尿病带来希望[2-3]。但是,供体胰腺的不足限制了胰岛移植的广泛开展,目前迫切需要寻找β细胞的新来源。最近,诱导全能的胚胎干细胞分化为胰岛素分泌细胞的方法取得了很大进步,但是这种方法需要加大量的诱导因子,而且需要严格控制诱导因子的剂量和诱导时间,更重要的是难以产生成熟的、功能和体内β细胞类似的胰岛素分泌细胞[4-5]。因此,胰腺祖细胞成为最有应用前景的β细胞新来源。成体胰腺是否存在胰腺祖细胞现还存在争论[6-7]。胚胎胰腺富含大量的胰腺祖细胞,而且具有高增殖及低免疫原性的优点[8]。由于胰腺祖细胞缺乏特异的表面标志,分离胰腺祖细胞有很大困难,并且由于胰腺祖细胞数量少,尚缺乏高效诱导胰腺祖细胞分化为胰岛素分泌细胞的方法。本研究建立了一种新的能在体外诱导胚胎胰腺细胞高效分化为内分泌细胞的培养方法。
材料和方法
主要试剂 PRMI-1640培养基 (美国 Gibco公司),胎牛血清 (美国Hyclone公司),牛血清白蛋白、抗胰岛素抗体、抗胰高血糖素抗体、抗羧肽酶抗体、FITC标记的抗兔IgG、Texas red标记的抗小鼠IgG(美国Sigma公司),逆转录试剂盒 (德国Qiagen公司),LCR膜 (美国Millipore公司),SYBR Green PCR master mix(美国Applied Biosystems公司)。
实验动物 6~8周龄成年雌性及雄性昆明小鼠,购自北京维通利华实验动物技术有限公司。雌、雄性小鼠按2∶1的比例合笼,第2天早上雌、雄性分开,检查雌性小鼠的阴道拴来判断是否怀孕,怀孕小鼠的胚胎计为0.5 d,12 d后取孕鼠的胚胎用来分离胚胎胰腺。
小鼠胚胎胰腺的分离 脱颈椎处死孕12.5 d的小鼠,酒精消毒后,打开腹腔,剪开子宫,把小鼠胚胎置于冰D-Hanks盐溶液中,在体视显微镜下,首先切除胚胎的头和四肢,再切除脊柱,然后切除肝脏以上部分。在红色的肝脏下方可看到白色的胃和胰腺,切除肝脏,再仔细把胰腺和胃分开。
胚胎胰腺的培养 取直径为35 mm的培养皿或六孔培养板中加入2 ml PRMI-1640培养基,培养基中添加10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素、1%非必需氨基酸和2 mmol/L谷氨酰胺。LCR膜是一种亲水性的聚四氟乙烯膜,把LCR膜平铺于培养皿或培养板中,由于浮力作用LCR膜漂浮于培养基中。将分离好的孕12.5 d的胚胎胰腺组织(E12.5)置于LCR膜上,处于气体和液体的分界面上 (图1),于饱和湿度、5%CO2的37℃孵箱中培养,每3 d换液1次,培养7 d。
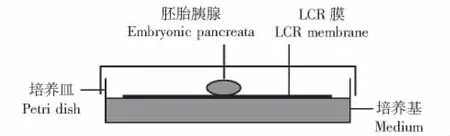
图1 胚胎胰腺培养方法示意图Fig 1 Illustration of culture method for embryonic pancreata
荧光免疫组织化学染色及定量 将胰腺组织固定于3.7%甲醛溶液中1 h,预包埋在4%低熔点琼脂糖中,然后包埋在石蜡中。包埋的胰腺组织切片后,常规脱蜡至水,抗原修复后,3%BSA阻断非特异性结合,0.1%或0.3%triton透膜。加一抗于4℃孵育过夜,TBST洗涤3次,加入荧光标记的抗一抗的二抗常温避光孵育2 h,洗涤二抗后,Hoechst孵育10 min染细胞核,TBST洗涤3次后封片,荧光显微镜下观察染色情况并拍照。为了定量胰岛素、胰高血糖素等的表达,整个胰腺组织所有切片的1/3被拍照。用图像分析软件IP lab定量每张照片中胰腺标志的染色,同样定量Hoechst染色,两者比值作为胰腺标志的表达率。
总RNA提取及实时荧光定量PCR 采用RNeasy微量试剂盒提取胰腺组织的总RNA,并用DNA酶处理以去除DNA污染。将50 ng RNA逆转录成cDNA,合成的cDNA被稀释10倍,取5 μl用于PCR反应。实时荧光定量PCR采用7300系统,反应体系包括SYBR Green荧光染料、反应混合物、引物。将cyclophilin A作为内对照,应用相对定量的比较方法(2-ΔΔct)计算每个基因的表达水平。E15.5d胚胎胰腺的cDNA作为标准样品。
统计学处理 采用SPSS 13.0统计软件,所有数据以均数±标准差表示,组间数据比较采用t检验,P<0.05为差异有统计学意义。
结 果
培养过程中胚胎胰腺形态和结构的变化 分离的小鼠孕12.5 d胚胎胰腺由表皮和间充质两部分组成,胰腺间充质位于外周包围着胰腺表皮。当胚胎胰腺培养于漂浮的膜上时,其形态、结构发生明显变化。未经培养的胚胎胰腺表皮和间充质体积相似,随着培养天数增加,间充质体积逐渐缩小,表皮体积逐渐增大,胚胎胰腺的密度逐渐增加;培养7 d时,间充质基本消失,胚胎胰腺的密度明显高于未培养时 (图2)。
胰腺祖细胞标志表达的变化 胚胎胰腺培养1 d后,有大量胰腺十二指肠同源盒基因1(pancreatic duodenal homeobox-1,PDX-1)表达,PDX-1表达率为 (41±1)%;掺入BrdU的PDX-1阳性细胞占总PDX-1阳性细胞的 (29±2)%,多靠近间充质 (图3)。培养3 d后,有大量神经源素3(neurogenin 3,Ngn3)表达,Ngn3表达率为 (12±2)%(图4)。培养7 d后,胚胎胰腺大量表达胰岛素,胰岛素阳性细胞的核表达PDX-1(图5A);胰岛素阳性细胞和胰高血糖素阳性细胞聚集在一起形成类似胰岛的结构 (图5B);胚胎胰腺表达外分泌细胞的标志羧肽酶 (carboxypeptidase,CPA),而且胰岛素阳性细胞和CPA阳性的细胞完全没有重叠 (图5C);成熟的β细胞增殖率非常低,仅存在极少量胰岛素BrdU双阳性细胞,与体内胰腺类似 (图5D);用不同浓度的葡萄糖刺激培养7d的胰腺,结果显示高浓度葡萄糖能明显刺激胰岛素分泌 (图5E)。
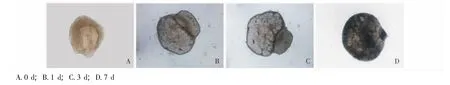
图2 胚胎胰腺培养过程中形态变化 (×50)Fig 2 Morphological change of embryonic pancreata during culture(×50)
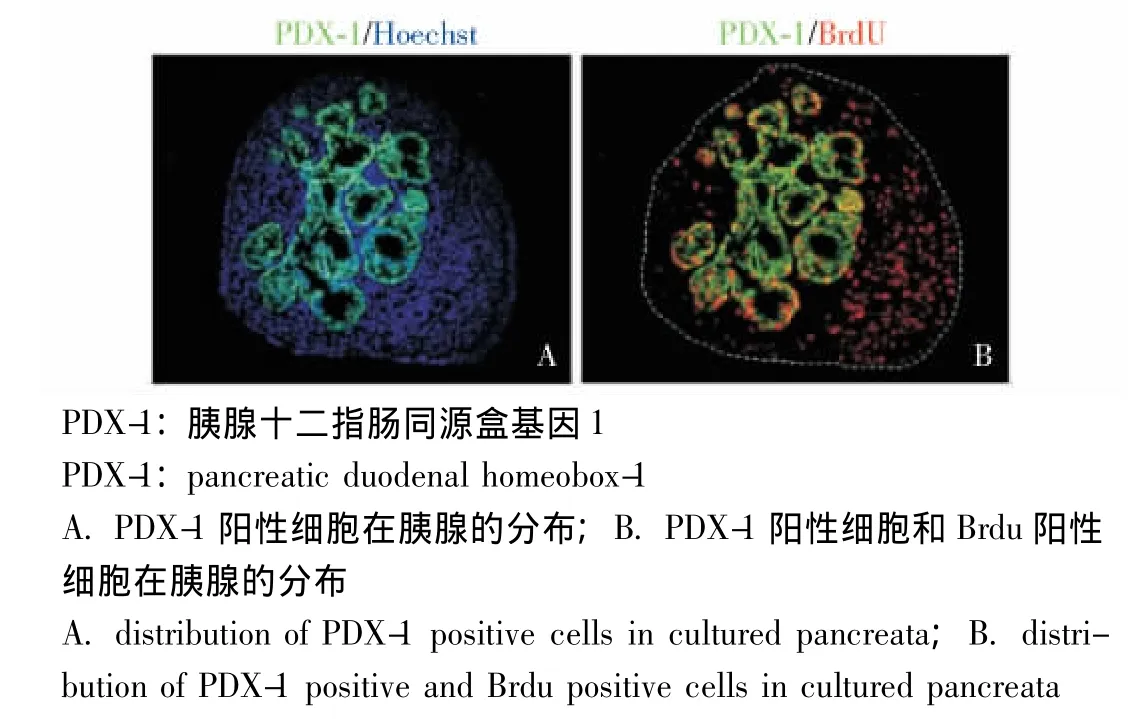
图3 胚胎胰腺培养1 d后PDX-1的表达 (×200)Fig 3 Expression of PDX-1 in embryonic pancreata after cultured for 1 day(×200)
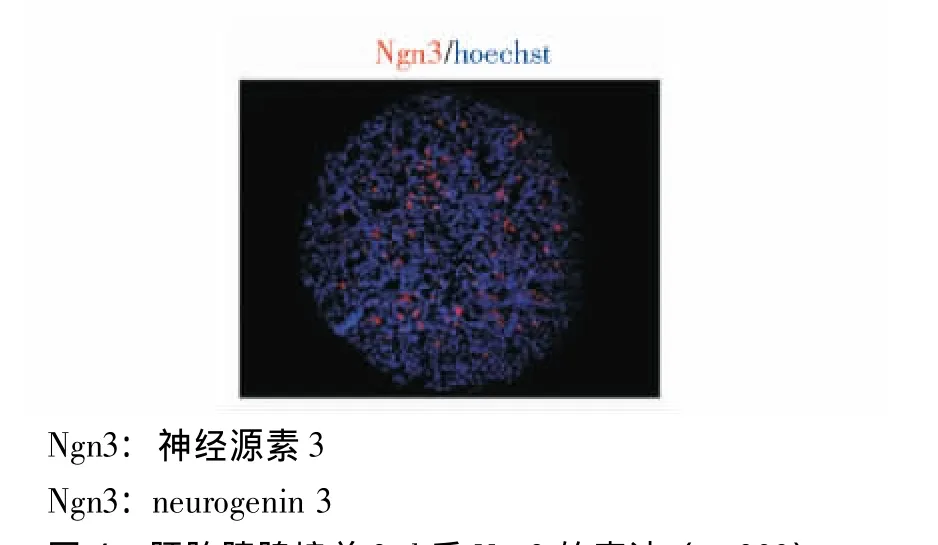
图4 胚胎胰腺培养3 d后Ngn3的表达 (×200)Fig 4 Expression of Ngn3 in embryonic pancreata after having been cultured for 3 days(×200)
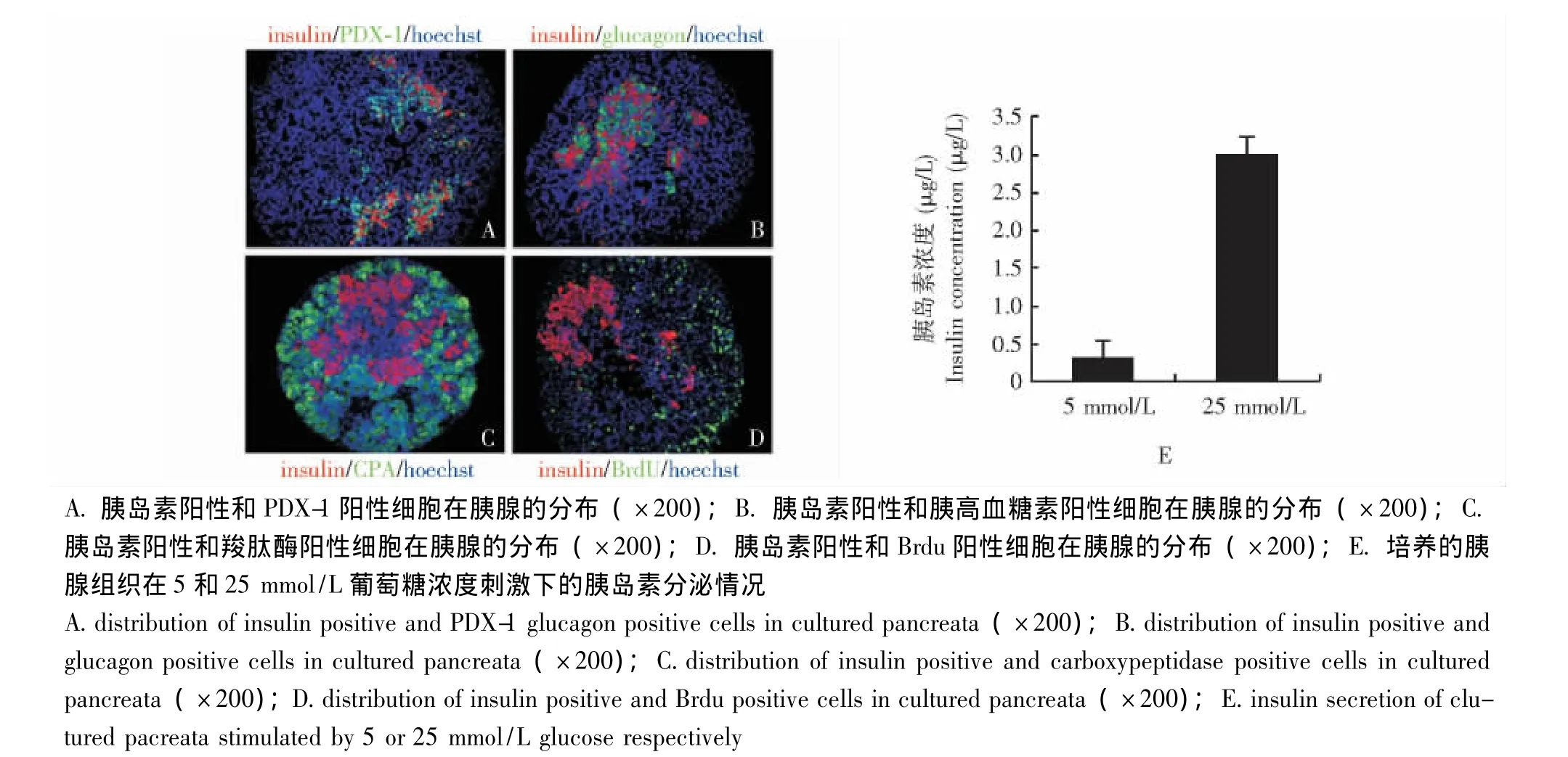
图5 胚胎胰腺培养7 d后内、外分泌标志的表达Fig 5 Expression of endocrine and exocrine markers in embryonic pancreata after having been cultured for 7 days
胚胎胰腺培养过程中胰腺特异性标志表达的变化实时荧光定量PCR结果显示,胚胎胰腺培养过程中,PDX-1表达逐渐降低 (图6A),Ngn3表达逐渐增加,第3天时达最高。3 d后Ngn3表达逐渐下降 (图6B)。刚分离的胚胎胰腺几乎不表达胰岛素,培养3 d后,胰岛素仅有少量表达,培养7 d后,胰岛素大量表达 (图6C)。β细胞的另一个标志Znt8和胰岛素的表达相一致 (图6D)。胰腺外分泌的标志淀粉酶的表达也和胰岛素类似 (图6F)。胰高血糖素的表达在刚分离的胚胎胰腺中表达较高,随着胰腺祖细胞分化,胰高血糖素表达逐渐下降,第3天时表达最低,但随着成熟α细胞出现,胰高血糖素表达逐渐增加 (图6E)。
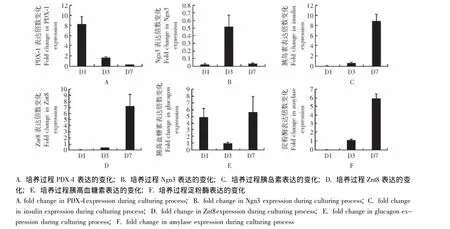
图6 胚胎胰腺培养过程中胰腺标志的表达Fig 6 Expression of pancreatic markers in embryonic pancreata during culture
讨 论
为了诱导胰腺细胞分化,目前大部分研究者采用单层培养或接种在matrigel上的三维培养,但诱导分化效率低,而且需要大量细胞因子[9-10]。本研究建立了一种新的培养方法,即使无任何诱导因子加入也能使胚胎胰腺细胞体外高效分化为内分泌细胞,该方法具有以下优点:(1)培养方法简单:直接培养胰腺组织,省略了把胰腺消化成细胞的步骤,维持了胰腺间充质和表皮的相互作用。胰腺间充质在胰腺发育过程中可发挥重要作用,不仅能促进胰腺祖细胞增殖,维持胰腺祖细胞处于不分化状态[11],还可控制胰腺表皮的发育进程[12]。本研究结果也显示,随着间充质体积逐渐缩小,表皮体积逐渐增大,胰腺祖细胞逐渐分化。(2)有利于内分泌细胞分化:本研究中分化胰腺的胰岛素和胰高血糖素表达率分别为10.2%和5.4%,远高于体内胰腺。(3)体外诱导胚胎胰腺分化过程与体内相一致:培养过程中,胰腺祖细胞及内、外分泌细胞标志的表达与体内一致。本研究中,体外培养的胰腺具有类似于活体胰腺的功能,外源性葡萄糖可以刺激其胰岛素分泌增加,25 mmol/L葡萄糖刺激的胰岛素释放量是5 mmol/L葡萄糖的10倍左右。尤值一提的是,本研究所培养的胰腺组织取自小鼠胚胎12.5 d,此时胚胎胰腺组织含有大量祖细胞,相比较于晚期阶段,这种早期阶段的胰腺具有更低的免疫原性[8]。由于目前移植的最大障碍是免疫排斥的问题,这种培养的低免疫原性早期阶段的胰腺或许能够改善移植排斥问题。而且,胚胎胰腺体外培养7 d时,胰腺祖细胞已分化出内分泌和外分泌细胞,可大大减少其移植应用中的致瘤性问题。体外培养胰腺组织中细胞的活性也与移植密切相关,在本组之前的研究中,大鼠胚胎胰腺体外培养14 d能够保持很好的活性[13]。
[1]代庆红,王忠东.中国糖尿病的现状调查 [J].中国医药指南,2011,9(13):206-208.
[2]Fiorina P,Folli F,Bertuzzi F,et al.Long-term beneficial effect of islet transplantation on diabetic macro-/microangiopathy in type 1 diabetic kidney-transplanted patients[J].Diabetes Care,2003,26(4):1129-1136.
[3]Witkowski P,Zakai SB,Rana A,et al.Pancreatic islet transplantation,what has been achieved since Edmonton break-through [J].Ann Transplant,2006,11(2):5-13,32-43.
[4]Kubo A,Shinozaki K,Shannon JM,et al.Development of definitive endoderm from embryonic stem cells in culture[J].Development,2004,131(7):1651-1662.
[5]D'Amour KA,Bang AG,Eliazer S,et al.Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells[J].Nat Biotechnol,2006,24(11):1392-1401.
[6]Zhao M,Amiel SA,Christie MR,et al.Evidence for the presence of stem cell-like progenitor cells in human adult pancreas[J].J Endocrinol,2007,195(3):407-414.
[7]Dor Y,Brown J,Martinez OI,et al.Adult pancreatic betacells are formed by self-duplication rather than stem-cell differentiation[J].Nature,2004,429(6987):41-46.
[8]Brands K,Colvin E,Williams LJ,et al.Reduced immunogenicity of first-trimester human fetal pancreas[J].Diabetes,2008,57(3):627-634.
[9]Suzuki A,Nakauchi H,Taniguchi H.Prospective isolation of multipotent pancreatic progenitors using flow-cytometric cell sorting[J].Diabetes,2004,53(8):2143-2152.
[10]Hisatomi Y,Okumura K,Nakamura K,et al.Flow cytometric isolation of endodermal progenitors from mouse salivary gland differentiate into hepatic and pancreatic lineages[J].Hepatology,2004,39(3):667-675.
[11]Miralles F,Serup P,Cluzeaud F,et al.Characterization of beta cells developedin vitrofrom rat embryonic pancreatic epithelium[J].Dev Dyn,1999,214(2):116-126.
[12]Attali M,Stetsyuk V,Basmaciogullari A,et al.Control of beta-cell differentiation by the pancreatic mesenchyme[J].Diabetes,2007,56(5):1248-1258.
[13]Haumaitre C,Lenoir O,Scharfmann R.Histone deacetylase inhibitors modify pancreatic cell fate determination and amplify endocrine progenitors[J].Mol Cell Biol,2008,28(20):6373-6383.
Establishment of a New Method to Induce the Differentiation of Embryonic Pancreatic Cells into Mature Endocrine Cells
CHEN Fang,MA Feng-xia,CHI Ying,ZHAO Qin-jun,YANG Shao-guang,LU Shi-hong,HAN Zhong-chao
State Key Laboratory of Experimental Hematology,Institute of Hematology and Hospital of Blood Diseases,CAMS and PUMC,Tianjin 300020,China
MA Feng-xia Tel:022-23909349,E-mail:mafengxia@gmail.com
ObjectiveTo establish a new culture method to induce the differentiation of embryonic pancreatic cells into mature endocrine cells.MethodsMouse embryos at day 12.5 were used and embryonic pancreata were isolated.The isolated embryonic pancreata were cultured on the filter for 7 days,which floated in the dish containing medium.During culture,the expression of pancreas duodenum homeobox-1(PDX-1),a pancreatic stem cell marker,was examined at day 1.The expression of neurogenin 3(Ngn3),a pancreatic progenitor cell marker,was examined at day 3.The expressions of endocrine and exocrine markers,insulin,glucagon,and carboxypeptidase(CPA)were examined at day 7 by immunohistochemistry.The kinetics of pancreatic marker expression during culture was assayed by real-time PCR.ResultsMany pancreatic stem cells still existed in embryonic pancreata cultured for 1 day;meanwhile,these pancreatic stem cells proliferated in high rate.A large amount of pancreatic progenitor cells were found in embryonic pancreata c ultured for 3 days.Pancreatic stem/progenitor cells differentiated into mature endocrine and exocrine cells in embryonic pancreata after having been cultured for 7 days.Furthermore,the expression pattern of pancreatic marker is consistent with thatin vivo.ConclusionWe successfully established a new culture method,with which embryonic pancreatic cells can efficiently differentiate into mature endocrine cell.
pancreas;insulin;pancreas duodenum homeobox-1;neurogenin 3
Acta Acad Med Sin,2012,34(4):343-347
马凤霞 电话:022-23909349,电子邮件:mafengxia@gmail.com
R318.15
A
1000-503X(2012)04-0343-05
10.3881/j.issn.1000-503X.2012.04.006
天津市应用基础及前沿技术研究计划 (09JCYBJC09700)Supported by the Tianjin Research Program of Application Foundation and Advanced Technology(09JCYBJC09700)
2011-11-27)
·综 述·

