人卵巢颗粒细胞的体外培养方法探讨
刘玉霞 董静霞 金玉洁 申春艳 徐 健
人卵巢颗粒细胞的体外培养方法探讨
刘玉霞 董静霞 金玉洁 申春艳 徐 健*
(北京大学基础医学院人体解剖与组织胚胎学系,北京100191)
目的 建立人卵巢颗粒细胞分离纯化、体外培养的有效方法。方法 收集体外受精—胚胎移植(IVF-ET)穿卵时的卵泡液,用胰蛋白酶消化法及密度梯度离心法分离纯化颗粒细胞并用不同培养基进行培养。结果 用体积分数为50%的Percoll细胞分离液分离,DMEM/F12或McCoy’5a液体培养基进行培养,细胞纯度高,存活率高,后续生长良好。结论建立了人卵巢颗粒细胞体外培养的稳定模型,为颗粒细胞的体外研究奠定良好的基础。
人;卵巢颗粒细胞;细胞培养
卵泡是女性卵巢的基本功能单位,而颗粒细胞是卵泡中最大的细胞群。颗粒细胞与卵母细胞间存在的信息交流,对卵母细胞的生长、成熟、发育都起着重要作用,因此颗粒细胞是研究雌性生殖调控的重要细胞模型[1]。当今人工辅助生殖技术在临床上得到广泛应用,颗粒细胞作为此项技术操作过程中废弃的体细胞,其获取及培养并不涉及严格的伦理问题,从而为我们的实验研究在客观上提供了便利。文献中涉及的人颗粒细胞培养方法有很多,但在细胞纯度及后续生长等方面不尽如人意。因此我们从细胞分离、纯化、培养的各个环节分别用不同的方法和试剂进行了比较,建立了人卵巢颗粒细胞体外培养的有效而稳定方法,为颗粒细胞的体外研究提供实验基础。
材料和方法
1.材料
收集超排卵后穿卵获得的卵泡液(卵母细胞-放射冠细胞-卵丘细胞复合体已经挑出),分离后进行颗粒细胞体外培养。
2.试剂
(1)PercollPLUS:瑞典Pharmacia产品,Ficoll人淋巴细胞分离液:北京普利莱公司产品;(2)RPMI1640,DMEM,DMEM/F12,McCoy’5a液体培养基均购于Gibco公司;(3)胎牛血清购于美国 Hy-Clone公司;(4)PV-6001兔二步法免疫组化试剂盒、DAB显色试剂盒购于北京中杉生物技术有限公司;(5)FSHR Antibody购于美国 Bioworld technology公司。
3.方法
3.1 细胞分离纯化
3.1.1 一次分离法:先消化后分离
穿卵时收集获得的卵泡液,以200g离心10min,弃上清,用无Ca2+、Mg2+的0.01mol/L PBS(后面所提PBS均与此相同)重悬细胞,加入等体积0.25%胰蛋白酶溶液(用无Ca2+、Mg2+的0.01mol/L PBS配置),室温消化10-20min或者37℃消化5-10min后加入血清培养液终止消化。
将终止消化后的细胞悬液离心,200g离心10min,弃上清,用PBS重悬细胞,然后移液至等体积Ficoll淋巴细胞分离液或50%(体积分数)的Percoll细胞分离液液面上,以400g离心20min后,将中间细胞层收集至另一试管,用含10%血清的培养液洗涤细胞一次,重悬待计数(培养液含10%胎牛血清、青霉素100U/ml、链霉素100U/m1)。
3.1.2 两次分离法:分离-消化-再分离
穿卵时收集获得的卵泡液,以200g离心10min,弃上清,用PBS重悬细胞,然后移液至等体积Ficoll淋巴细胞分离液或50%(体积分数)的Percoll细胞分离液液面上,以400g离心20min。
分离后将中间细胞层收集至另一试管,用PBS重悬,加入等体积0.25%胰蛋白酶溶液,室温消化10-20min或者37℃消化5-10min后加入血清培养液终止消化,然后以200g离心10min,弃上清,用PBS重悬。
用同样的方法再分离一次,最后用含10%血清的培养液洗涤细胞一次,重悬待计数[2,3]。
3.2 细胞计数及存活率检测
颗粒细胞用含10%血清的培养液重悬后,可选或不选300目细胞筛过滤,用台盼兰染色(细胞存活率一般在75%以上),血球计数板计数。
3.3 细胞培养
用含10%血清的不同的培养液(洗涤、重悬、调整细胞密度时所用的培养液需一致)对颗粒细胞进行培养,根据细胞计数调整细胞密度为2×105/ml[4]。接种到预先放置有20mm×20mm盖玻片的3.5cm培养皿中,置37℃、5%CO2孵箱。24h后换液。
3.4 细胞染色和鉴定
颗粒细胞培养4d后,将细胞爬片用PBS漂洗3次,2min/次,4%多聚甲醛室温下固定30min,PBS再次漂洗3次,2min/次,然后常规 HE染色,或按照PV-6001兔二步法免疫组化试剂盒和DAB显色试剂盒说明书逐条进行操作,检测卵泡刺激素受体(FSHR)的表达,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。阳性细胞显示棕色染色,即颗粒细胞FSHR 阳性[5]。
结 果
1.细胞鉴定
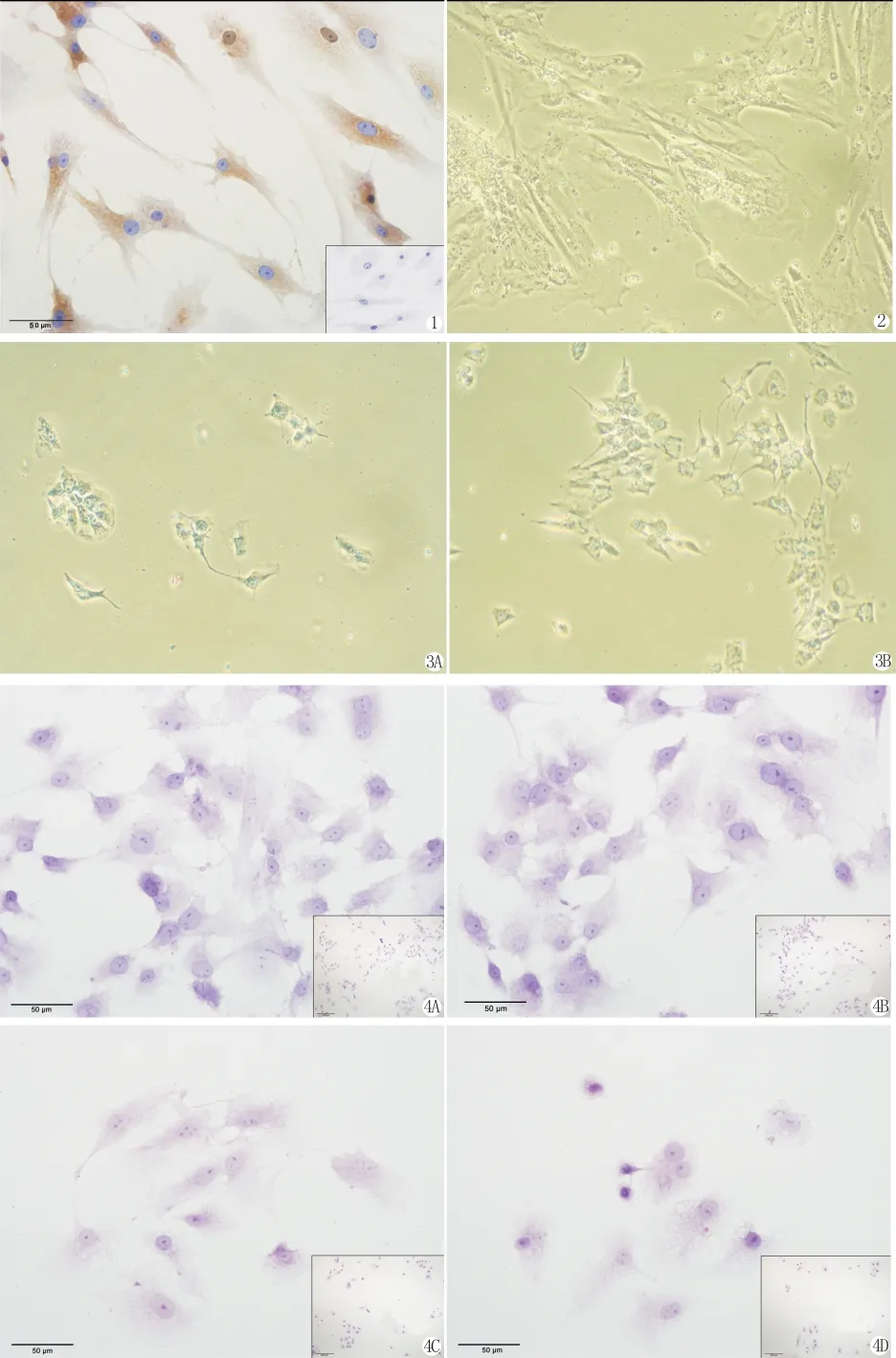
通过免疫细胞化学染色方法检测人颗粒细胞FSHR的表达,经鉴定90%以上细胞均为人卵巢颗粒细胞(图1)。
2.细胞的形态学观察
颗粒细胞体外生长速度较慢,培养24h内贴壁。48h后在倒置显微镜下观察,可见细胞生长呈多突状或梭形,细胞与细胞间有延长的伪足相互连接,细胞核大、圆,核仁明显,胞质颗粒均匀丰富。体外生长的颗粒细胞在培养第2-5d达到分裂高峰,培养10d左右细胞开始出现退化现象,以后漂浮细胞逐渐增多,贴壁细胞逐渐出现类似成纤维细胞的形态(图2)。
讨 论
1.不同的分离纯化方法对颗粒细胞产率、纯度及生长情况的影响
1.1 分离液选择
分离液使用之前均要摇匀,并恢复至室温。通过对比,50%Percoll细胞分离液较国产Ficoll人淋巴细胞分离液,分离得到的细胞数目较多、纯度较高且产率稳定。图3、图4是分别用Ficoll和50%Percoll分离液分离颗粒细胞,同种培养液培养48h,倒置显微镜下观察到的细胞贴壁生长状态。
1.2 离心力选择
分离细胞时离心力亦小不亦大,否则白膜层会贴近于下面的红细胞层,不易分离,一般用离心力400g离心20min。如果离心后试管内还没有形成明显的白膜层,表现为一段白色浑浊的细胞和周围界限不明显,可适当延长离心时间或转速。
1.3 分离方法选择
两次分离法比一次分离法分离所得的细胞纯度高,但本实验倾向于一次分离法。因为减少离心次数,相应减少了细胞的流失,同时使得制备细胞的时间比常规方法要缩短许多,从而成活率增加,细胞后续生长状态好。另外我们合并运用差速贴壁法进一步纯化细胞,即24h颗粒细胞贴壁后,可通过PBS漂洗1-2次后换液来进一步纯化,基本可以去除混杂血细胞及其他,这样既能提高细胞活性又能保证细胞纯度。
1.4 消化方法选择
热消化法是用终浓度为0.125%胰蛋白酶溶液37℃消化5-10min,冷消化法为室温消化10-20min,本实验多采用冷消化法,因为37℃条件下胰蛋白酶活性最高,作用强烈,如果消化过度,24h内细胞贴壁数目少,后续生长状态欠佳,漂浮细胞增多。
2.不同培养基对人卵巢颗粒细胞生长情况的影响
本实验筛选了四种培养基:RPMI1640、DMEM、DMEM/F12、McCoy’5a,分别对颗粒细胞进行培养。实验发现,用培养液DMEM/F12、Mc-Coy’5培养的细胞存活率高、24h内贴壁数目多、细胞伸展好,培养6d左右会出现较多细胞漂浮;而用培养液RPMI1640和DMEM培养的细胞存活率较低、24h内贴壁数目较少、细胞伸展较差,培养4d左右会出现较多细胞漂浮。图5-8是分别用不同培养液培养颗粒细胞4d,取细胞爬片HE染色后的图像。
3.细胞筛的应用对人卵巢颗粒细胞生长情况的影响
可用300目细胞筛滤掉消化后出现的絮状物,因为过多絮状物可能影响细胞的贴壁,但过滤也会造成一部分细胞流失。为缩短细胞在外界暴露的时间,相对提高活细胞比例,可视情况不过滤,待24h后换液时用PBS漂洗即可除去絮状物。
[1]卢翠玲,杨巍,胡召元,等 .颗粒细胞的增殖分化及其在卵泡发育中的作用 .科学通报,2005,51(27):2341-2347
[2]Feng-Tao Shi,Anthony P.Cheung and Peter C.K.Leung.Growth Differentiation Factor 9Enhances Activin A-Induced Inhibin B Production in Human Granulosa Cells.Endocrinology,2009,150:3540-3546
[3]Yukiyo Kumazawa,Kazuhiro Kawamura,Toshiharu Sato,et al.HCG up-regulates survivin mRNA in human granulosa cells.Mol Hum Reprod,2005,11(3):161-166
[4]Risto Jaatinen,Jonas Bondestam,Taneli Raivio,et al.Activation of the Bone Morphogenetic Protein Signaling Pathway Induces InhibinβB-Subunit mRNA and Secreted Inhibin B Levels in Cultured Human Granulosa-Luteal Cells.J Clin Endocrinol Metab,2002,87:1254-1261
[5]白晓红,糜若然,岳天孚,等 .体外培养人卵巢黄素化颗粒细胞的鉴定及其分泌功能变化 .中华妇产科杂志,2005,40(5):351-352
图 版 说 明
图1 免疫细胞化学染色(苏木精复染细胞核),颗粒细胞FSHR阳性,右下角图为阴性对照。
图2 培养第14d时倒置显微镜下观察颗粒细胞形态。
图3 用不同细胞分离液分离颗粒细胞,培养48h后倒置显微镜下观察细胞贴壁情况。
图4 用不同培养基培养颗粒细胞4d,HE染色观察细胞形态。右下角图为低倍镜图像,可观察贴壁细胞数目。
EXPLANATION OF FIGURES
Fig.1 The expression of FSHR by ICC in granulose cells.as shown,FSHR is localized in the cytoplasm of GCs.Figure in right corner is negative control picture.
Fig.2 Granulose cells cultured for 14days were observed under inverted microscope.
Fig.3 Granulosa cells,purificated by different cell separation medium,were observed under inverted microscope after 48hours for culture.3A:Ficoll;3B:50%Percoll.
Fig.4 Morphology of granulosa cells,cultured by different media for 4days,were presented by HE staining.Figures in right corner are lower magnification image.4A:McCoy’5a,4B:DMEM/F12,4C:DMEM,4D:RPMI 1640.
Culture method of human ovarian granulosa cells in vitro
Liu Yuxia,Dong Jingxia,Jin Yujie,Shen Chunyan,Xu Jian*
(Department of Anatomy and Histoembryology,School of Basic Medical Sciences,Peking University,Beijing100191,China)
ObjectiveTo establish effective methods of purification and culture in vitro of human ovarian granulosa cells.MethodsHuman ovarian granulosa cells were obtained in conjunction with oocyte aspiration from women undergoing hormone treatment for in vitro fertilization.Cells were treated with trypsin and density gradient centrifugation,and then cultured with different media.ResultsCentrifuged by 50% (v/v)Percoll PLUS,and cultured with DMEM/F12or McCoy'5aliquid medium,cells were of great purity,high survival rate,and good subsequent growth.ConclusionWe have established a stable model of culturing human ovarian granulosa cells in vitro,and laid a good foundation for research of granulosa cells in vitro.
Human;Ovarian granulosa cells;Cell culture
R329
A
10.3870/zgzzhx.2011.05.002
2011-04-06
2011-06-22
国家自然科学基金面上项目(30772344)
刘玉霞,女(1985年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

