VEGF-C和CCR7的表达与卵巢癌淋巴结转移之间的关系
夏 欣 李鑫磊 杨树才 孔 建 马 晶*
VEGF-C和CCR7的表达与卵巢癌淋巴结转移之间的关系
夏 欣1,2李鑫磊1杨树才1孔 建1马 晶1*
(1哈尔滨医科大学解剖教研室,黑龙江150081;2黑龙江省医院,哈尔滨150036)
目的 观察血管内皮生长因子(VEGF)-C和趋化因子受体CCR7在卵巢癌组织内的表达情况,分析VEGF-C和CCR7的表达与癌淋巴结转移之间的关系。方法 取卵巢癌病例72例,其中,淋巴结转移组46例,无淋巴结转移组26例。应用免疫组化技术观察VEGF-C和CCR7在卵巢癌组织内的表达。结果 VEGF-C和CCR7主要表达于卵巢癌细胞胞浆或/和胞膜内,VEGF-C和CCR7在淋巴结转移组的阳性表达率分别是71.7%和78.2%,在无淋巴结转移组的表达率分别是30.8%和26.9%,二者在淋巴结转移组的表达率均明显高于无淋巴结转移组(P<0.01)。VEGF-C和CCR7蛋白同时阳性表达在淋巴结转移组和非淋巴结转移组中的表达率分别为65.2%和15.4%,VEGF-C和CCR7的表达具有显著的相关性(P<0.01),联合检测VEGF-C和CCR7诊断卵巢癌淋巴结转移具有较高的准确度,ROC曲线下面积达0.791。结论 VEGF-C和CCR7表达在卵巢癌淋巴结转移过程中发挥重要作用,VEGF-C和CCR7在促进卵巢癌淋巴结转移中可能具有一定的协同作用,二者联合检测有助于预示卵巢癌淋巴结转移的判断。
VEGF-C;CCR7;淋巴结转移;卵巢癌
血管内皮生长因子(VEGF)-C是在肿瘤淋巴结转移中起重要作用的分子,其蛋白的表达与淋巴管生成数量呈正比,与淋巴结转移呈显著正相关[1]。VEGF-C作为调控淋巴管发育及淋巴管生成的特异因子及其与淋巴结转移的相关性在动物实验及临床病理实验中已经得到证实[2]。CCR7是CC类趋化因子受体,近年来,研究者在多种肿瘤中检测到CCR7的表达,并发现CCR7的表达与肿瘤淋巴结转移密切相关[3,4]。但 VEGF-C和 CCR7在卵巢癌组织中的表达有没有相关性还需进一步研究。为此,本实验采用免疫组化法分别检测72例卵巢癌组织中VEGF-C和CCR7蛋白的表达及其与淋巴结转移的关系,并进一步探讨VEGF-C和CCR7联合检测在预示卵巢癌淋巴结转移风险中的价值。
材料和方法
1.材料
所有标本取自哈尔滨医科大学附属医院确诊为卵巢上皮癌患者的存档蜡块72例,临床病理资料完整,其中伴有淋巴结转移46例,无淋巴结转移26例。兔抗人VEGF-C和CCR7多克隆抗体购自Santa Cruz公司。PV-6001免疫组化试剂盒购自北京中杉金桥生物技术有限公司。
2.免疫组化染色
取4μm厚的组织切片,常规脱蜡至水,0.3%H2O2孵育30min,以阻断内源性过氧化物酶。0.01MPBS冲洗5min×3次,高压抗原修复:将切片浸入0.01M 柠檬酸盐抗原修复液(pH=6.0),高压2min,自然冷却至室温。0.01MPBS冲洗5min×3次,滴加一抗(VEGF-C的工作浓度为1:100;CCR7的工作浓度为1:200),4℃孵育过夜。0.01MPBS冲洗5min×3次,滴加生物素标记的二抗,室温孵育30min。0.01MPBS冲洗5min×3次,DAB显色,苏木素复染,中性树胶封片,光镜观察。PBS代替一抗作为阴性对照。
3.图像分析和统计学处理
VEGF-C和CCR7的表达以细胞膜或胞浆呈现棕黄色颗粒为阳性,以10个高倍视野中至少有10%的肿瘤细胞胞浆内出现棕黄色颗粒者判断为VEGF-C和CCR7表达阳性。VEGF-C和CCR7的表达与淋巴结转移的相关性采用Spearman秩相关分析,P<0.05表示差别具有统计学意义。
结 果
1.VEGF-C在卵巢癌组织中的表达
VEGF-C蛋白主要表达于卵巢癌组织原发灶癌细胞的胞浆内,为棕黄色细颗粒(图1),卵巢癌组织中 VEGF-C 表达的阳性率为56.8%(41/72)。其中,伴淋巴结转移的46例卵巢癌样本中,VEGF-C的阳性率为71.7%(33/46),无淋巴结转移的26例样本中,VEGF-C的阳性率30.8%(8/26),二者之间差异具有显著性(P<0.01),表明 VEGF-C的表达与卵巢癌淋巴结转移密切相关。
2.CCR7在卵巢癌组织中的表达
CCR7蛋白主要表达于卵巢癌组织癌细胞的胞浆或/和胞膜上,呈棕黄色颗粒(图2)。72例卵巢癌组织中CCR7蛋白表达的阳性率为59.7%(43/72),其中,伴淋巴结转移的46例卵巢癌组织中,CCR7的阳性率为78.2%(36/46),无淋巴结转移的26例样本中,CCR7的阳性率为26.9%(7/26),CCR7在淋巴结转移组的表达率明显高于在无淋巴结转移组的表达率(P<0.01)。
3.卵巢癌组织中VEGF-C和CCR7表达之间的关系
VEGF-C和CCR7蛋白同时表达在淋巴结转移组和非淋巴结转移组中阳性率分别为65.2%和15.4%,二者的表达具有显著的相关性(P<0.01),见表1。tochemistry×200

表1 卵巢癌组织内VEGF-C和CCR7的表达与淋巴结转移的关系Table 1 Relationship betweenVEGF-C and CCR7expression and lymph node metastasis in epithelial ovarian carcinoma

图1 卵巢癌组织内VEGF-C的表达 免疫组化法×400A:淋巴结转移组卵巢癌组织内VEGF-C的表达 B:无淋巴结转移组卵巢癌组织内VEGF-C的表达Fig.1 Expression of VEGF-C in ovarian carcinoma with lymph node metastasis group(A)and nonmetastasis group(B).Immunohistochemistry×400
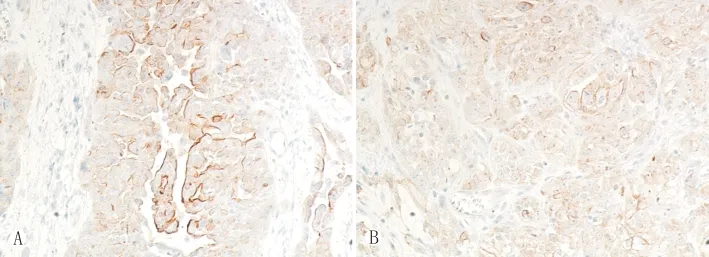
图2 卵巢癌组织内CCR7的表达 免疫组化法×200A:淋巴结转移组卵巢癌组织内CCR7的表达 B:无淋巴结转移组卵巢癌组织内CCR7的表达Fig.2 Expression of CCR7in ovarian carcinoma with lymph node metastasis(A)and nonmetastasis group(B).Immunohis-
4.VEGF-C和CCR7蛋白共同检测在预测卵巢癌淋巴结转移中的作用
在本回顾性研究中,VEGF-C与CCR7在诊断卵巢癌淋巴结转移中的灵敏度、特异性、阳性预测值(PPV)和 阴 性 预 测 值 (NPV)分 别 为 71.7%、30.8%、80.5%、41.9%和78.2%、26.9%、83.7%、34.5%。我们对结果进行ROC分析发现,联合检测VEGF-C和CCR7在预测卵巢癌淋巴结转移的准确度较高,ROC曲线下面积(AUC)达0.791(图3)。
讨 论
血道转移和淋巴道转移是肿瘤转移的两种主要方式。Stacker和Skobe[5,6]第一次用直接的实验数据证实,肿瘤细胞可以通过表达淋巴管生成的调控因子VEGF-C来诱导淋巴管新生,从而促进肿瘤细胞的淋巴道转移。此后,很多针对不同肿瘤的研究都陆续得出了相似的结论。肿瘤的侵袭和转移是一系列复杂的过程,在此过程中需要多种分子和细胞参与反应[7],其中包括血管和(或)淋巴管的诱导生成,肿瘤细胞脱落并进入血管或淋巴管,被靶组织微脉管随机或特异性捕获,离开脉管并向组织器官浸润,直至形成转移灶[8]。

图3 联合检测VEGF-C和CCR7预测卵巢癌淋巴结转移Fig.3 Combined examination of VEGF-C and CCR7for judging lymph node metastasis in ovarian carcinoma.
趋化因子C、CC、CXC和CX3C四个家族中CC和CXC家族占了已发现的趋化因子的大多数。趋化因子受体为G蛋白耦联受体,它们均具有7个跨膜区域。目前为止约发现了50种趋化因子和至少19种趋化因子受体近年的研究表明:趋化因子及其受体可能在肿瘤的发生和转移的关键步骤中发挥关键的作用[9]。
有研究表明[10],淋巴管内皮细胞通过分泌趋化因子吸引肿瘤细胞,进而主动引导肿瘤细胞淋巴转移,这一过程类似于免疫刺激过程中树突状细胞的定向迁移。在肿瘤细胞定向迁移过程中,趋化因子通过与肿瘤细胞表面相应受体的作用诱导肿瘤细胞骨架重排,促使肿瘤细胞紧密粘附于淋巴管内皮细胞,最终实现定向性迁移。由此推测CCR7的活化可能在肿瘤的淋巴结转移中发挥重要的作用。
Müller等[11]在乳腺癌组织中检测到CCR7的高表达,他们发现与淋巴细胞一样,一定浓度的CCR7的配体能够明显增加乳腺癌细胞内肌动蛋白的含量和聚合,在肿瘤细胞中高水平的肌动蛋白聚合是细胞形成伪足的必需条件,而伪足的形成是恶性肿瘤细胞侵袭组织和远处迁移的早期事件[12],这进一步证实了CCR7在肿瘤淋巴结转移中的重要作用。随后研究者在胃癌、食管癌、结肠癌及甲状腺癌等多种肿瘤中检测到CCR7的表达,而且其表达和淋巴结转移密切相关[13]。
本研究结果显示,VEGF-C和CCR7蛋白在卵巢癌组织中均有较高的表达,分别达56.8%和59.7%。CCR7阳性卵巢癌组织中VEGF-C蛋白阳性率明显高于CCR7阴性者中的VEGF-C蛋白阳性率,两者表达呈正相关。从目前的研究推断,VEGF-C在淋巴管生成和肿瘤淋巴结转移中的作用较明确,而且其起作用也较直接,可能是CCR7的活化促进了VEGF-C的表达,从而介导了卵巢癌淋巴结转移的过程[14]。当然,这还需要对CCR7因子的作用做进一步的研究才能确定。联合检测参与淋巴结转移的多个因子将更有助于精确预测卵巢癌的淋巴结转移。本研究显示,当联合检测VEGF-C和CCR7时,ROC曲线下面积达0.791,具有较高的诊断价值。综上所述,本研究表明VEGF-C和CCR7的表达与卵巢癌的淋巴结转移密切相关,通过对活检标本进行VEGF-C和CCR7联合检测将有助于卵巢癌淋巴结转移风险的早期预测。
[1]Tammela T,Petrova TV,Alitalo K.Molecular lym-phangiogenesis:new players.Trends Cell Biol,2005,15(8):434-441
[2]Deguchi K,Ichikawa D,Soga K,et al.Clinical significance of vascular endothelial growth factors C and D and chemokine receptor CCR7in gastric cancer.Anticancer Res,2010,30(6):2361-2366
[3]Kodama J,Hasengaowa,Kusumoto T,et al.Association of CXCR4and CCR7chemokine receptor expression and lymph node metastasis in human cervical cancer.Ann Oncol,2007,18(1):70-76
[4]Tsuzuki H,Takahashi N,Kojima A,et al.Oral and oropharyngeal squamous cell carcinomas expressing CCR7have poor prognoses.Auris Nasus Larynx,2006,33(1):37-42
[5]Stacker SA,Caesar C,Baldwin ME,et al.VEGF-D promotes the metastatic spread of tumor cells via the lymphatics.Nat Med,2001,7(2):186-191
[6]Skobe M,Hawighorst T,Jackson DG,et al.Induction of tumor lymphangiogenesis by VEGF-C promotes breast cancer metastasis.Nat Med,2001,7(2):192-198
[7]马勇,陈明伟,刘冰华,等 .VEGF-D的表达与膀胱移行细胞癌LVD及淋巴结转移的关系 .中国组织化学与细胞化学杂志,2010,19(1):81-84
[8]Nathanson SD.Insights into the mechanisms of lymph node metastasis.Cancer,2003,98(2):413-423
[9]Schimanski CC,Bahre R,Gockel I,et al.Chemokine receptor CCR7enhances intrahepatic and lymphatic dissemination of human hepatocellular cancer.Oncol Rep,2006,16(1):109-113
[10]Murphy PM.Chemokines and the molecular basis of cancer metastasis.N Engl J Med,2001,345(11):833-835
[11]Müller A,Homey B,Soto H,et al.Involvement of chemokine receptors in breast cancer metastasis.Nature,2001,410(6824):50-56
[12]Wiley HE,Gonzalez EB,Maki W,et al.Expression of CC chemokine receptor-7and regional lymph node metastasis of B16murine melanoma.J Natl Cancer Inst,2001,93(21):1638-1643
[13]Sancho M,Vieira JM,Casalou C,et al.Expression and function of the chemokine receptor CCR7in thyroid carcinomas.J Endocrinol,2006,191(1):229-238
[14]Brand S,Dambacher J,Beigel F,et al.CXCR4and CXCL12are inversely expressed in colorectal cancer cells and modulate cancer cell migration,invasion and MMP-9activation.Exp Cell Res,2005,310(1):117-130
The expression of VEGF-C and CCR7and their correlationship 7with lymph node metastasis in ovarian carcinoma
Xia Xin1,2,Li Xinlei1,Yang Shucai1,Kong Jian1,Ma Jing1*
(1Department of Anatomy,Harbin Medical University,Heilongjiang150081,
2Heilongjiang Provincial Hospital,Harbin150036,China)
ObjectiveTo investigate the effects of vascular endothelial growth factor(VEGF)-C and CCR7on tumor lymph node metastasis,we observed the expression of VEGF-C and CCR7in epithelial ovarian carcinoma.MethodsSeventy-two paraffin-embedded stored specimens from patients with ovarian carcinoma were included in this study.They were devided into the lymph node metastasis group(n=46)and the nonmetastasis group(n=26).The expressions of VEGF-C and CCR7were detected by immunohistochemical staining.ResultsVEGF-C and CCR7proteins were observed predominantly in the cytoplasm or/and on membrane of the tumor cells.The positive rate of VEGF-C and CCR7expression in the lymph node metastasis group was 71.7%and 78.2%respectively,but 30.8%and 26.9%in the nonmetastasis group,with significant diferences(P<0.01).The synergic expression rate of VEGF-C and CCR7was 65.2%and 15.4%in the lymph node metastasis group and the nonmetastasis group respectively,with statistical significance(P<0.01).High accuracy to predict lymph node metastasis was found in combined examination of VEGF-C and CCR7expressions with an area of 0.791under the ROC curve.Conclusion VEGF-C and CCR7play an important role in the lymph node metastasis of ovarian carcinoma.VEGF-C and CCR7act synergically in promoting tumor lymph node metastasis.Combined examination of VEGF-C and CCR7might be beneficial for judging lymph node metastasis in ovarian carcinoma.
VEGF-C;CCR7;Lymph node metastasis;Ovarian carcinoma
R737.31
A
10.3870/zgzzhx.2011.05.010
2011-04-26
2011-05-30
黑龙江省自然科学基金资助 (D201041)
夏欣,女(1985年),汉族,硕士研究生。
*通讯作者(To whom correspondence should be addressed)

