早期糖尿病大鼠晶状体和视网膜水通道蛋白4表达的研究
黄 焱 韩咪莎 郑卫东 徐国兴
早期糖尿病大鼠晶状体和视网膜水通道蛋白4表达的研究
黄 焱1*韩咪莎2郑卫东3徐国兴3
(1福建医科大学医技学院眼视光学系;2基础医学院人体解剖与组织胚胎学系;3附属第一医院眼科,福州 350004)
目的 观察早期糖尿病大鼠晶状体、视网膜水通道蛋白4(aquaporin 4,AQP-4)表达的变化,探讨糖尿病大鼠眼组织水代谢改变的机制。方法 SD大鼠分为正常对照组和糖尿病组。制作糖尿病大鼠模型,于第4、8周取材,用免疫组化法和计算机图像分析系统半定量分析各组大鼠晶状体、视网膜AQP-4表达的变化。结果 正常及糖尿病大鼠AQP-4在晶状体上皮均无表达。AQP-4在视网膜上有表达,正常大鼠主要表达于视网膜视杆视锥层、节细胞层和神经纤维层,糖尿病大鼠从内界膜延伸至视细胞层整个视网膜厚度均可见AQP-4阳性表达,特别是在神经节细胞层毛细血管内皮和神经纤维层阳性表达更明显。糖尿病大鼠视网膜组织AQP-4阳性表达标随周龄的延长而增强。结论 糖尿病大鼠视网膜AQP-4的表达较正常组增强,提示水通道蛋白的表达增加是糖尿病早期发生视网膜水肿的机制之一。
糖尿病;视网膜;晶状体上皮;水通道蛋白4
角膜、晶状体、玻璃体等都是含水很丰富的器官,它们的生理功能的完成依赖于细胞水转运的平衡。多种类型的水通道蛋白分布在眼组织,与维持水的正常转运有密切的关系。糖尿病眼病早期病变是否与细胞水转运的平衡失调有关?水通道蛋白表达有何变化?这些问题目前未见报道。本研究通过免疫组织化学法和计算机图像分析技术对AQP4在晶状体和视网膜中的分布作定性定量研究,观察糖尿病大鼠早期是否有AQP4的异常表达,探讨AQP4在糖尿病白内障和视网膜病等并发症中可能发挥的作用,为糖尿病眼病的早期防治提供理论依据。
材料和方法
1.实验动物
成年SD(Spague-Darley)大鼠30只,由福建医科大学实验动物中心提供。雄性,体重200-220g。自由摄食、饮水,室温饲养。
2.主要试剂与仪器
链脲佐菌素(STZ min≥98.89,SigmaS0130)购自Sigma公司,用罗氏血糖仪测血糖。普通饲料由福建医科大学动物实验中心提供。兔抗鼠水通道蛋白4(AQP4)购自武汉博士德生物工程有限公司,SP免疫组织化学试剂盒及DAB显色试剂均购自福州迈新生物技术开发公司。光学显微镜及摄像系统(日本Olympus公司)。
3.糖尿病大鼠模型的制备
SD大鼠30只,适应性饲养7d,测空腹血糖均低于7mmol/L,随机分为正常对照组(C组)10只,实验组20只。实验组用STZ诱发糖尿病,STZ临用前用0.1mol/L柠檬酸缓冲液配成1%浓度,经微孔滤膜过滤灭菌,按60mg/Kg左下腹腔注射。72h后取尾血测空腹血糖。凡血糖≥16.7mmol/L,为诱导成功的糖尿病大鼠,共有18只大鼠成模,随机分为A组和B组,A组于成模后饲养4周,B组于成模后饲养8周,取材用于下述实验。实验期间大鼠自由饮水、摄食,每周测量血糖1次,其中B组1只糖尿病大鼠在饲养6周时死亡。
4.免疫组织化学染色及计算机图像分析
大鼠以腹腔注射水合氯醛麻醉,摘除双侧眼球,经10%中性福尔马林固定,石蜡包埋,6μm连续切片。SP染色主要步骤:切片脱蜡水化后,以柠檬酸缓冲液高温修复抗原,入0.3%H2O210min,3%正常血清孵育10min,兔抗水通道蛋白4抗体孵育60min,HRP标记的羊抗鼠IgG孵育30min,DAB呈色,Mayer苏木素复染。阴性对照片以PBS替代抗体,其余过程同上。棕褐色为免疫组织化学阳性染色。图像分析:应用 Motic Images Advanced 3.0图像分析系统进行半定量分析,测定阳性细胞的平均灰度值。在同一光强度、放大倍数下,10张切片每张切片随机选取5个视野,对免疫组织化学阳性染色进行测定,灰度值(gray scale)与所含的阳性物质的总量成反比,即灰度值越大,阳性强度越弱。
5.统计学分析
实验数据采用(¯x±s)表示,组间差异选用最小显著差法(LSD法),统计软件是SPSS13.0软件包。
结 果
1. 各组大鼠体重情况
A、B组摄食量、饮水量比C组明显增加,而体重明显下降,差异有显著性(P<0.05),且毛色粗糙发黄。

表1 各组大鼠体重(g)Table 1 Weight of rats in different groups(g)
2.各组大鼠空腹血糖情况:注射STZ后的A、 B组大鼠血糖明显高于C组

表2 各组大鼠空腹血糖 (mmol/l)Table 2 Blood sugar of rats in different groups(mmol/l)
3.免疫组化结果:
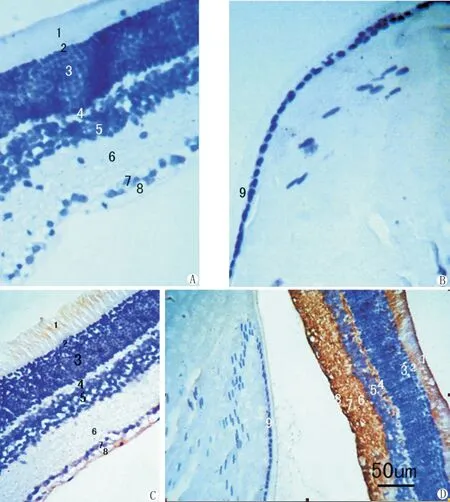
AQP4在正常及糖尿病大鼠晶状体上皮均无表达(见图B,D)。AQP-4在视网膜上有表达,正常大鼠主要表达在内网层以内的细胞膜(见图C),糖尿病大鼠从内界膜延伸至外界膜的整个视网膜厚度均可见AQP 4阳性表达,特别是在外网层、神经节细胞层毛细血管内皮和神经纤维层阳性表达更明显。成模8周糖尿病大鼠视网膜组织AQP4阳性表达比成模4周的明显增强(见图D)。
大鼠视网膜AQP4阳性表达灰度值计算机图像分析结果是:

表3 各组大鼠视网膜AQP4阳性表达灰度值Table 3 MOD of AQP4Positive express in retina of different group rats
讨 论
目前的研究表明,AQP4是视网膜内分布最多的水通道蛋白[1]。Jiang Li等[2]研究 AQP4基因缺失鼠的视网膜电流图时发现其视网膜电流图上b波的振幅有明显的降低,说明AQP-4参与了视细胞的光电信号传导,对维持视网膜的兴奋性有重要作用。Hamann等[3]用免疫荧光、免疫印迹方法研究了人及大鼠眼组织中AQP1-5的表达,他们认为在视网膜上AQP4表达于紧靠双极细胞的Müller细胞和星形胶质细胞,尤其是 Müller细胞包绕微血管周围和毗邻玻璃体的足突膜上表达最为丰富。视网膜Müller细胞是一种特殊的神经胶质细胞,也是视网膜内最主要的神经胶质细胞。而视网膜色素上皮细胞和视细胞上没有AQP4表达。Iandiev[6]等报道4~6个月糖尿病大鼠内层视网膜AQP4的表达减弱而AQP1表达增强。本研究结果表明,正常大鼠视网膜主要在视杆视锥层、节细胞层和神经纤维层有AQP4表达,而1~2个月的早期糖尿病大鼠的整个视网膜从内界膜延伸至的视细胞层均可见AQP4阳性表达,特别是在神经节细胞层毛细血管内皮和神经纤维层阳性表达更明显。本研究结果以Iandiev[4]等研究为基础,补充了糖尿病大鼠早期的AQP4的表达情况,提示AQP4应该是在调节视网膜水肿过程中,有一个应激性的增高到逐渐降低的表达过程。
晶状体的透明依赖于晶状体纤维蛋白质、水、电解质等的正常生理代谢,晶状体囊膜水通透性的改变是影响晶状体透明的一个重要因素。关于AQP4在晶状体是否有表达一直是有争议的。2005年Nature[5]以封面形式报道了脂与蛋白质在Aquaporin-0相互作用的结构学机制,对人类了解白内障的关键机制有很大的促进作用。Hamann等[3]认为晶状体纤维细胞膜上表达AQP0,晶状体前囊膜上皮表达AQP1,没有AQP4的表达。本实验组经过多年研究,对眼的组织切片和免疫化学技术有较丰富的经验,由于晶状体的硬度很高,视网膜薄而软,尤其是在进行免疫组化过程中的脱蜡和漂洗等步骤后,在同一张切片上保留视网膜和晶状体的难度很高,这也是本研究的特色之一。本研究的结果就如图D所示,在同样一张切片同样的染色方法和步骤,视网膜AQP4阳性表达很强而晶状体没有阳性表达的棕色呈现。本研究表明AQP4在正常及糖尿病大鼠的晶状体上皆没有表达。与Hamann等研究报道的一致。
研究通过免疫组化和图像分析,明确了正常及早期糖尿病大鼠晶状体上皮无AQP4的表达;正常视网膜AQP4有一定量的表达,早期糖尿病大鼠视网膜AQP4的表达较正常组增强,可能是糖尿病视网膜病变早期水肿的机制之一。目前对AQP4的研究主要在于确定其表达与视网膜水肿的形成相关,其在水肿发展及消退中的作用机制有待进一步研究。随着对AQP4定位、功能和调控研究的进一步深入,AQP4可能会成为视网膜水肿的治疗靶点,为有效预防和治疗早期糖尿病视网膜病变提供新的策略。
[1]Goodyear MJ,Crewther SG,Junghans BM,et al.A role for aquaporin-4in fluid regulation in the inner retina.Vis Neurosci,2009,26(2):159-165
[2]Jiang Li,Patil R V,Verkman A S,et al.Mildly abnormal retinal function in transgenic mice without Müller cell aquaporin-4water channels.J Invest Ophthalmol Vis Sci,2002,43(4):573-579
[3]Hamann S,Zeuthen T,La Cour M,et al.Aquaporins in complex tissues:distribution of aquaporins 1-5in human and rat eye.Am J Physiol Cell Physiol,1998,274(5):1332–1345
[4]Iandiev I,Pannicke T,Reichenbach A,et al.Diabetes alters the localization of glial aquaporins in rat retina.Neurosci Lett,2007,421(2):132-136.
[5]Tamir Gonen,Yifan Cheng,Piotr Sliz,et al.Lipid–protein interactions in double-layered two-dimensional AQP0crystals.Nature,2005,438(5):633-638
大鼠视网膜和晶状体上皮细胞免疫组化结果见图A-D。×400。
视网膜层次为:1视杆视锥层;2外界膜;3外核层;4外网层;5内核层;6内网层;7节细胞层;8神经纤维层;9晶状体上皮层。
图A 正常大鼠视网膜各层次,阴性对照
图B 正常大鼠晶状体上皮,未见AQP4阳性表达的棕色染色
图C 正常大鼠视杆视锥层、节细胞层和神经纤维层可见少量AQP4阳性表达的棕色颗粒
图D 糖尿病8周后大鼠晶状体上皮仍未见AQP4阳性表达的棕色颗粒;视网膜各层可见大量AQP4强阳性表达的棕色染色
EXPLANATION OF FIGURES
Immunocytochemical localization of aquaporin4in retina and lens of rat eye(A-D).Original magnification×400
Retinal layers are as follows:(1)rod-and-cone layer,(2)outer limiting membrane(3)outer nuclear layer,(4)outer plexiform layer,(5)inner nuclear layer,(6)inner plexiform layer,(7)ganglion cell layer,(8)nerve fiber layer,and(9)len epithelium.
Fig.A Retinal layers of normal rat,negative control.
Fig.B lenepithelium of normal rat,no AQP4expression.
Fig.C Retinal layers of normal rat,AQP4expressed on rod-and-cone layer,ganglion cell layer and nerve fiber layer,some brown dye.
Fig.D 8weeks-diabetic rats,no AQP4expression on len epithelium ,but AQP4strongly expressed on all layers of retina,much brown dye.
Expression of aquaporin-4 in retina and lens of early stage diabetic rats
Huang Yan1*,Han Misha2,Zheng Weidong3,Xu Guoxing3
(1Department of Ophthalmology and Optometry;2Department of Human Anatomy,Histology and Embryology;3Department of Ophthalmology,The First Affiliated Hospital,Fujian Medical University,Fuzhou350004,China)
ObjectiveTo investigate the changes of aquaporin-4(AQP4)expression in the retina and lens of early-stage diabetic rats,and study the pathological role of AQP4in water metabolism of diabetic rat eyes.MethodsSD rats were divided into a normal control group and a diabetic group.The diabetic model was induced by intraperitoneal STZ.Samples were collected 4and 8weeks later,and the expression of AQP4in lens and retina was observed by histochemistry and computer image semiquantitative analysis.ResultsThe expression of AQP4in the lens epithelium of both normal control and diabetic groups was negative.The outer and inner nuclear layer cells,the ganglion cells of the normal control rat retina showed positive immunoreactivity of AQP4.The positive reactivity of AQP4in the retina of early-stage diabetic rats was stronger than that of normal control rats.ConclusionThe expression of AQP4in the lens epithelium of both normal control and diabetic groups was negative.The expression of AQP4in the retina of early-stage diabetic rats was stronger than that of normal control rats,which shows that AQP4plays an import role in diabetic retinal edema.
Diabetes;Retina;Lens epithelium;Aquaporin-4
R329
A
10.3870/zgzzhx.2011.05.008
2011-04-05
2011-08-01
福建省卫生厅创新基金(2009CX-7)
黄焱,女(1971年),汉族,副教授。
*通讯作者(To whom correspondence should be addressed)

