野生型铜绿假单胞菌和新型mucA突变铜绿假单胞菌生物膜形成的动态观察
王晶晶 倪 明 田德英
野生型铜绿假单胞菌和新型mucA突变铜绿假单胞菌生物膜形成的动态观察
王晶晶 倪 明 田德英*
(华中科技大学同济医学院附属同济医院感染科感染性疾病研究所,武汉430030)
目的 观察新型mucA突变的粘液型菌株PA17和野生型菌株PAO1生物膜(biofilm,BF)形成的动态过程,并比较2株菌生物膜形成过程的差异。方法 SYTO9/PI荧光探针标记PAO1和PA17,体外建立1d,3d,5d,9d时间点PAO1及PA17的BF模型,激光共聚焦显微镜(CLSM)观察两株菌BF动态形成的过程。结果 通过SYTO9/PI双染可以动态观察PAO1菌株和PA17菌株的BF形成过程;PAO1菌株和PA17菌株的BF形成过程有差异:PAO1菌株1d时已形成微菌落,3d时形成覆盖整个玻片的生物膜结构,而PA17菌株1d时仅有散在的不可逆粘附细菌,3d时才形成微菌落,5d时形成生物膜结构;随着时间的推移,2株菌生物膜形成的厚度均逐渐增加,且死菌的比例也逐渐增加。结论 PAO1和PA17BF的动态形成过程存在差异,而PA17与PAO1生物膜形成存在的差异可能与其mucA基因突变造成大量藻酸盐的产生有关。
铜绿假单胞菌;生物膜;mucA;SYTO9/PI
铜绿假单胞菌是一种广泛存在于水和土壤环境中的革兰氏阴性菌,也是引起肺囊性纤维化和烧伤患者感染的条件致病菌[1,2]。铜绿假单胞菌有两种生存状态:浮游状态和生物膜状态。其中生物膜状态是细菌在自然界中存在的主要状态。生物膜状态下细菌形成微菌落聚集体,存在于胞外多聚基质中,且形成膜状并不可逆的粘附于有活性或无活性的物体表面[3,4]。生物膜是临床上引起反复难治性感染的一个重要原因[5]。本研究中新型mucA基因突变的铜绿假单胞菌是前期在我院呼吸科ICU病房从一名反复下呼吸道感染难以治愈的患者体内多次分离得到的菌株,命名为PA17,测序发现其mucA基因在166-333位核苷酸缺失,mucA蛋白的56个氨基酸丢失[12]。实验通过SYTO9/PI荧光探针标记技术,运用激光共聚焦显微镜观察不同时间点两株菌生物膜的动态变化。观察两株菌生物膜形成特点,比较两者的差异。
材料和方法
1.材料
1.1 菌株 新型mucA基因突变的菌株为华中科技大学同济医学院附属同济医院呼吸科临床分离(编 号 为 8974—2003),命 名 为 PA17,PAO1(ATCC15692)由本实验保存。
1.2 试剂与仪器 L-Broth(LB)培养基购自Oxiod公司,LIVE/DEAD®BacLight.Bacterial Viability Kits为 Molecular Probes公司产品,6孔培养板购自Constar公司,激光共聚焦显微镜为Olympus公司产品。
2.实验方法
2.1 BF体外生物模型构建 分别挑取PAO1和PA17菌株的单菌落接种LB培养基,37℃,200r/min振荡过夜培养8-12h后,调整 OD(600)值至0.5。用无菌预热LB培养液1:200稀释,取5ml置预先放置无菌盖玻片的6孔平底组织培养板中,37℃ 培养,每24h换液1次。
2.2 SYTO9/PI荧光探针标记BF 将上述不同时间点的盖玻片从培养液中取出,PBS漂洗3次,除去浮游细菌,按3μl/ml加入等体积混合配置好的染料,室温避光条件下孵育15min。
2.3 CLSM观察PAO1和PA17的BF LIVE/DEAD® BacLight.Bacterial Viability Kits含有SYTO9和PI两种染料。活菌具有完整的细胞壁,而死菌的细胞壁则不完整。其中SYTO9可以快速穿透任何细胞壁与DNA结合,PI不能穿透完整细胞壁,但透过不完整细胞壁后对DNA有更大的亲和力,故在死细胞中PI可以取代SYTO9与DNA结合。在488nm激光的激发SYTO9呈亮绿色,表征活菌,PI呈红色,表征死菌。因此SYTO9/PI标记不但可以反映细菌形态,还可以反映细菌的存活状态。生物膜的厚度通过沿Z轴扫描计算所得。
3.统计学分析
数据用平均值±标准差(¯x±s)表示,两组数据之间采用t检验,以P<0.05为差异有统计学意义。
结 果
1.CLSM观察PAO1和PA17的生物膜
激光共聚焦显微镜观察时,有三种颜色:代表活菌的绿色,代表死菌的红色,而橘黄色或者黄色可能是活菌和死菌重叠所致。从图可见:PAO1于1d时已经形成了微菌落,且具有一定的厚度,而PA17则仅有散在的不可逆粘附的细菌。PAO1主要以活菌为主,可见散在的死菌,而PA17几乎没有发现死菌。3d时,PAO1已形成了生物膜结构,厚度较1d时增加,呈水平状生长,同时可见死菌比例增加,PA17则形成微菌落,可以观察到散在死菌。随着时间的延长,PAO1生物膜厚度增加,结构更加成熟。5d时PA17也形成了具有三维结构的生物膜,与PAO1相似,呈水平膜状生长。两株菌在形成生物膜的过程中随着时间的推移,死菌的比例均增多,且死菌多在生物膜的底层,顶端以活菌为主。9d时PAO1的生物膜结构染色呈黄色,提示有大量死菌的存在,与活菌重叠;PA17生物膜结构中死菌量也较5d时明显增加(图1)。在生物膜形成的第9d观察到了树枝分差状线形结构,考虑是生物膜中输送营养、氧气以及维持生物膜结构的水通道。
2.PAO1和PA17生物膜厚度的变化
对PAO1和PA17不同时间点的生物膜厚度进行测量,发现随着时间的推移,生物膜厚度逐渐增加。1d时PAO1有微菌落形成,厚度约4.5μm,此时PA17仅有散在的不可逆附细菌。3d时PAO1形成了膜状生物膜结构,平均厚度达23.7μm,此时的PA17微菌落厚度约12.2μm。5d时PAO1的平均厚度达34μm,PA17的平均厚度达到了40.2μm。9d时PAO1的生物膜厚度为52.8μm,PA17的厚度则为45.4μm(见表)。可见在生物膜形成的初期,微菌落形成生物膜时的变化很快:PAO1从1d到3d时厚度增加了18.2μm;PA17则增加了29μm(3d到5d)。随着时间的推移,生物膜的厚度继续增加,但是较前期缓慢。5d时PA17的生物膜厚度大于PAO1,而9d时PAO1的生物膜厚度则大于PA17。
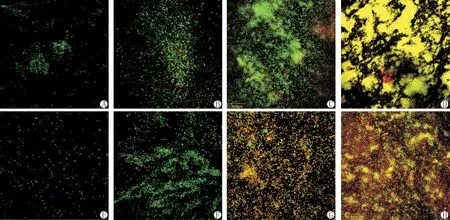
图1 A,B,C,D分别代表PAO1生物膜形成的1d,3d,5d和9d;E,F,G,H分别代表PA17生物膜形成的1d,3d,5d和9d。×100Fig.1 A,B,C,D are SYT09/PI double staining results of biofilm of PAO1at 1d,3d,5d,and 9drespectively;E,F,G,H are double staining results of biofilm of PA17.×100
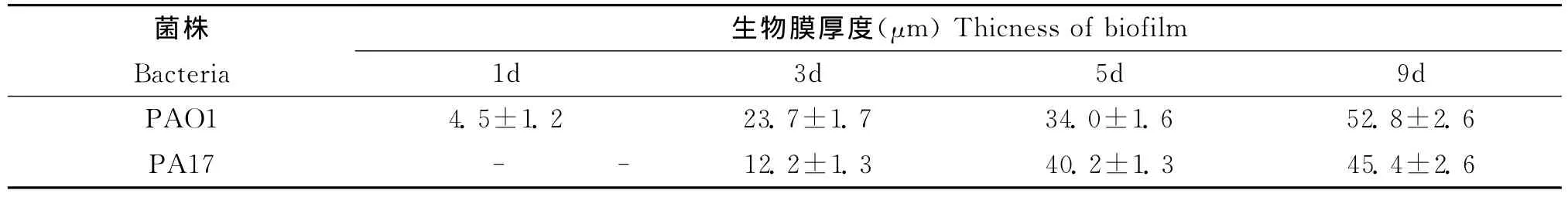
表 不同时间点PAO1菌株和PA17菌株的生物膜平均厚度 (¯x±s)Table The mean thickness of biofilm in PAO1and PA17at different time (¯x±s)
讨 论
藻酸盐是生物膜的重要组分,其在生物膜形成和维持方面的作用举足轻重。铜绿假单胞菌藻酸盐的生物合成非常复杂,最重要的2个调节基因是mucA和algU,algU编码的蛋白AlgU可促进藻酸盐合成基因及其调节基因的转录而使得藻酸盐合成增加。mucA基因的编码产物MucA蛋白是AlgU的负性调节因子[6],当mucA基因出现突变造成终止密码子提前出现时,编码不完整的MucA蛋白对AlgU的表达失去阻遏作用,从而导致藻酸盐大量产生,形成粘液型铜绿假单胞菌[7]。本文所用菌株PA17与正常MucA蛋白相比,其第166-333位核苷酸缺失,造成MucA蛋白中56个氨基酸缺失,产生大量的藻酸盐,表现为粘液表型,且该突变位置之前从未有过报道。
生物膜的形成过程主要分为四个阶段:细菌到附着物表面;早期粘附阶段;微菌落形成阶段;成熟生物膜形成阶段[8]。通过荧光探针标记,我们观察到了两株菌生物膜形成的动态过程。PAO1无论是初始粘附阶段还是微菌落形成阶段均早于PA17。在生物膜形成的初始阶段,鞭毛介导细菌在可粘附表面形成单层细菌,随后菌毛在生物膜形成的后继阶段发挥重要的作用,如微菌落的形成[9],此外有研究证实大量藻酸盐的产生可以抑制细菌的早期粘附[10]。本研究中PA17是新型的mucA突变株,是稳定的粘液型菌株,能产生大量的藻酸盐,而这可能是PA17不可逆粘附晚于PAO1的原因之一。
生物膜是细菌为适应环境而形成的一种状态,利于细菌的生存。生物膜形成后,细菌对抗菌药物的抵抗力大大增强,具有保护作用的细胞外多聚基质合成增加,且抵抗机体的免疫清除[5]。本研究发现PAO1第3d时已形成了生物膜结构,而PA17则是5d形成。且前3d生物膜厚度增加比较快,5d到9d时,生物膜的厚度增加较慢。另PA17第5d到9d时生物膜的增加的厚度明显小于PAO1(P<0.05)。可能由于生物膜初期环境中的养分尚充足,细菌生长较快,产生胞外多聚基质也较多。而随着时间的推移,因为生物膜养分有限,代谢产物堆积,不利于细菌的生长繁殖,故表现为生物膜厚度增长变慢,甚至随着时间的推移也出现大量的死菌。虽然PA17典型的生物膜形成时间晚于PAO1,但5d时可见PA17的生物膜厚度大于PAO1,可能原因是PA17较之PAO1能产生大量藻酸盐。本实验通过CLSM,结合SYTO9/PI双染可以直观的观察到生物膜中死菌多处于生物膜底层,而活菌则多处于表层。可能与生物膜营养物质渗透屏障有关,表层细菌容易获得养分和氧气,代谢产物也容易排出,故比较活跃,分裂较快,活菌较多,而里层则处于营养或氧气相对缺乏的状态,生长缓慢,死菌也较多,这也可能是生物膜结构中细菌的一种自身防御手段[11]。
本实验成功的建立了PAO1及PA17的体外生物膜模型,通过SYTO9/PI双染动态的观察了两株菌生物膜的形成过程,比较了两株菌生物膜形成的差异,为生物膜的研究提供一定的理论基础。
[1]Van Delden C,Iglewski BH.Cell-to-cell signaling and Pseudomonas aeruginosa infections.Emerging infectious diseases,1998,4(4):551-560
[2]Kipnis E,Sawa T,Wiener-Kronish J.Targeting mechanisms of Pseudomonas aeruginosa pathogenesis.Medecine et maladies infectieuses,2006,36(2):78-91
[3]Hoiby N,Krogh Johansen H,Moser C,et al.Pseudomonas aeruginosa and the in vitro and in vivo biofilm mode of growth.Microbes and infection/Institut Pasteur,2001,3(1):23-35
[4]Donlan RM.Biofilms:microbial life on surfaces.Emerging infectious diseases.2002,8(9):881-890
[5]Parsek MR,Singh PK.Bacterial biofilms:an emerging link to disease pathogenesis.Annual review of microbiology,2003,57:677-701
[6]Gacesa P.Bacterial alginate biosynthesis--recent progress and future prospects.Microbiology,1998,144 (Pt 5):1133-1143
[7]Mathee K,Ciofu O,Sternberg C,et al.Mucoid conversion of Pseudomonas aeruginosa by hydrogen peroxide:a mechanism for virulence activation in the cystic fibrosis lung.Microbiology,1999,145(Pt 6):1349-1357
[8]Sauer K,Camper AK,Ehrlich GD,et al.Pseudomonas aeruginosa displays multiple phenotypes during development as a biofilm.J bacteriology,2002,184(4):1140-1154
[9]O'Toole GA,Kolter R.Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development.Molecular microbiology,1998,30(2):295-304
[10]Hay ID,Gatland K,Campisano A,et al.Impact of alginate overproduction on attachment and biofilm architecture of a supermucoid Pseudomonas aeruginosa strain.Applied and environmental microbiology,2009,75(18):6022-6025
[11]Mai-Prochnow A,Evans F,Dalisay-Saludes D,et al.Biofilm development and cell death in the marine bacterium Pseudoalteromonas tunicata.Applied and environmental microbiology,2004,70(6):3232-3238
[12]倪明,田德英,余兵,等.一株含新的mucA基因突变的铜绿假单胞菌生物学特性研究.中华医学杂志,2004,84(19):1649-1653
Sequential development of biofilm formation of wild type pseudomonas aeruginosa and pseudomonas seruginosa with the new mucA gene mutation
Wang Jingjing,Ni Ming,Tian Deying*
(Department of Infectious Diseases,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China )
ObjectiveTo observe the sequential biofilm development and compare the features of two strains of Pseudomonas aeruginosa:mucus-type PA17with the new mucA gene mutation and non-mucoid PAO1with wild-type mucA gene.MethodsIn vitro biofilm models of PAO1and PA17tagged with SYTO9/P1were established on glass slices,and the biofilm development was monitored at different time points(1d,3d,5dand 9d).The fluorescence images of different layers in the biofilm models were obtained by confocal laser scanning microscopy (CLSM)based on fluorophores from PAO1and PA17.ResultsThe PAO1and PA17biofilm development was investigated successfully by CLSM after the genetical tagging with SYTO9/P1.There were differences between PAO1and PA17in the development of the biofilm.The thickness of the biofilm was increased significantly during biofilm growth,and the ratio of dead bacteria was increased gradually in each layer as well.ConclusionThe sequential development of biofilm formation is different between PAO1and PA17,which may be associated with the mutation of the mucA gene in PA17.
Pseudomonas Aeruginosa;Biofilm;MucA;SYTO9/PI
R378
A
10.3870/zgzzhx.2011.05.005
2011-02-26
2011-06-29
国家自然科学基金资助(3090127);新教师基金资助(200804871069)
王晶晶,女(1984年),汉族,博士研究生。
*通讯作者(To whom correspondence should be addressed)

