氟伐他汀改善嘌呤霉素作用下足细胞β1整合素的表达
柴玉萍 刘 佳 赵秀芬 钱 军 孙 彬 邢昌赢 王笑云
蛋白尿是肾小球滤过屏障受损的重要标志。足细胞是构成肾小球滤过膜机械和电荷屏障的重要组成部分[1]。足细胞从肾小球基膜(GBM)脱落、数目减少是导致蛋白尿和肾小球硬化最重要的病理基础之一[2]。α3β1整合素是一种有两个膜蛋白亚单位的异二聚体,包括一条较大的α链和一条较小的β链,是足细胞黏附于GBM的主要受体,对抑制足细胞的剥离和脱落,维持GBM结构和功能的完整性起重要作用[3,4]。
他汀类药物又称HMG-CoA还原酶抑制剂,是目前临床应用最广泛的一类降脂药。对该类药物的深入研究发现,除了降脂外,他汀类药物还具有更重要的非降脂依赖性肾保护作用,包括抗增生、抗炎、抗氧化、免疫调节等。但其对足细胞的直接作用及机制目前尚未完全阐明。
局灶节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)是激素抵抗性肾病综合征和终末期肾病的主要原因[5]。文献报道大鼠注射嘌呤霉素(PAN)后产生与人类FSGS相似的严重蛋白尿,特别是PAN特定损伤足细胞,导致足突缺失,细胞骨架破坏及滤过膜蛋白的异常分布,从而为研究FSGS的发生机制提供了很好的实验模型[6]。本研究用PAN作为刺激因素诱导足细胞损伤模型,观察氟伐他汀(FLV)对足细胞β1整合素表达的影响及可能机制。
材料与方法
材料 永生化人足细胞株由英国Bristol大学Moin.A.Saleem教授惠赠。RPMI 1640培养基,胎牛血清、青链霉素(美国Gibco公司),胰岛素转铁蛋白亚硒酸钠(ITS,美国Sigma公司),抗β1整合素抗体(美国 R&D公司),抗甘油醛 3磷酸脱氢酶(GAPDH)及辣根过氧化物酶(HRP)标记的小鼠IgG二抗(武汉博士德),BCA全蛋白提取试剂盒(凯基生物),BCA蛋白测定试剂盒(凯基生物),ECL发光液(Millipore),DCFHDA(美国 Sigma公司),噻唑蓝(MTT,美国Sigma公司),FLV由诺华公司馈赠。
方法
足细胞培养 人足细胞培养参照文献方法[7]:细胞生长在含 ITS(胰岛素 5μg/ml、转铁蛋白5μg/ml和亚硒酸钠5 ng/ml)、10%胎牛血清、100 U/ml青链霉素、100mg/L链霉素的RPMI 1640培养液中,在33℃、5%CO2培养孵箱传代培养。然后转入37℃、5%CO2培养孵箱分化培养14 d后进行实验。FLV用二甲亚砜(DMSO)溶解,配成的FLV溶解液DMSO终浓度 <1mg/ml。PAN用 PBS溶解。DCFHDA用DMSO溶解,配成浓度为100 uM的原液-20℃保存,使用时以无血清培养液稀释至所需浓度。
细胞处理及分组 将已分化的足细胞用不含胎牛血清的RPMI 1640培养液同步化处理12h后分为以下四组:(1)正常对照组;(2)DMSO(1mg/ml)对照组;(3)PAN(1.0μg/ml)组:PAN分别培养足细胞 12h、24h、48h、72h;(4)PAN(1.0 μg/ml)+FLV(1×10-8~1×10-5M)组:PAN分别与不同浓度FLV共同培养足细胞48h。每组实验设置两个复孔,同一实验重复三次。MTT法分组:(1)正常对照组;(2)DMSO对照组;(3)PAN(1.0μg/ml)组;(4)PAN(1.0μg/ml)+FLV(1×10-8~1×10-5M)组;(5)FLV(1×10-8~1×10-5M)组,每组设两个复孔,同一实验重复三次。
Western印迹 各组处理结束后分别收集细胞,每孔加入100μl含PMSF的裂解液(按1 ml裂解液加10 μl含 PMSF(100 mM)、5 μl蛋白酶抑制剂、1 μl磷酸酶抑制剂),用橡皮刮子刮下细胞,4℃ 12 000 r/min离心15 min,取上清液,用BCA蛋白测定试剂盒测定蛋白浓度。加上样缓冲液,以10%SDS聚丙烯酰胺凝胶电泳分离,100v电转移至硝酸纤维素膜。5%脱脂牛奶室温封闭60 min,加一抗于4℃过夜,然后加HRP标记的二抗室温孵育60 min,洗膜,用ECL化学发光剂在x线片上曝光,显影、定影、冲洗晾干后扫描蛋白条带的吸光度,以GAPDH为内参,采用 Bio-Rad 2000凝胶成像系统,应用Quantity one软件进行吸光度分析。
全自动定量酶标仪检测活性氧簇(ROS)[8]将对数生长期足细胞用胰酶消化,用细胞计数板计数后,按1×104~5×104/孔的密度接种到96孔板,33℃孵箱生长至70%~80%融合后,移入37℃孵箱分化14d后用于实验。细胞用不含胎牛血清的培养液同步化处理12h后,按照不同的时间点加入药物干预,然后用PBS洗涤细胞三次,加入终浓度为20 uM的DCFHDA,37℃避光孵育30 min,然后用无血清细胞培养液洗涤细胞三次,上全自动定量酶标仪检测。实验485 nm激发波长,545 nm发射波长检测。
MTT比色法检测足细胞活力 对数生长期足细胞用胰酶消化,用细胞计数板计数后以1×104~5×104/孔接种于96孔板,33℃孵箱生长至70%~80%融合后,移入37℃孵箱分化14d后用于实验。无血清培养液孵育12h使细胞同步化后,细胞处理不同时间,弃去培养液,加入 MTT(5mg/ml)20μl/孔,置于5%CO2的37℃细胞培养箱中继续孵育4h后,弃去MTT,然后加入DMSO 150μl/孔,摇床震荡10 min溶解颗粒染料结晶,酶标仪490 nm波长测定每孔的吸光度(OD)值。实验重复三次。OD值的高低表示细胞活力的高低。
统计学处理 分析采用SPSS 13.0统计软件,计量资料用均数±标准差表示,单变量两组资料间比较采用t检验,多组资料间比较采用单因素方差分析,相关性分析采用Pearson相关分析,P<0.05为差异有统计学意义。
结 果
PAN对足细胞β1整合素表达的影响 与正常对照组相比,PAN刺激足细胞24h,β1整合素表达始有明显下降(P <0.05),48h、72h β1 整合素表达继续下降(P<0.05),PAN作用12h足细胞 β1整合素表达无显著改变(P>0.05)(图1)。
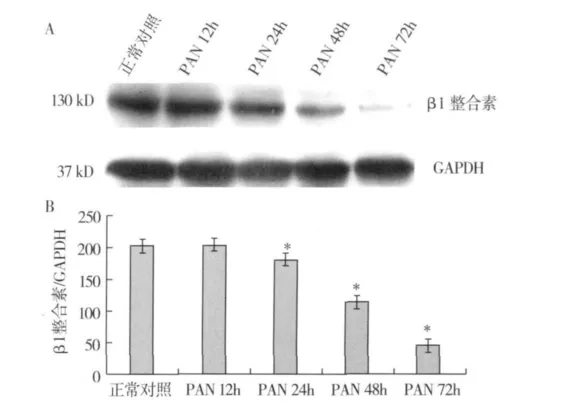
图1 不同时间嘌呤霉素(PAN)刺激对体外培养足细胞β1整合素表达的影响(A:Western blot法;B:灰度定量分析,其中GAPDH为内参)
FLV对PAN刺激下足细胞β1整合素表达的影响 各组分别作用48h后,与正常对照组相比,DMSO对足细胞β1整合素表达无明显影响(P>0.05);PAN作用48h,β1整合素表达明显下降(P<0.05)。FLV干预后,β1整合素表达有明显上调,且FLV浓度为1×10-7M作用最显著(P<0.05)(图2)。
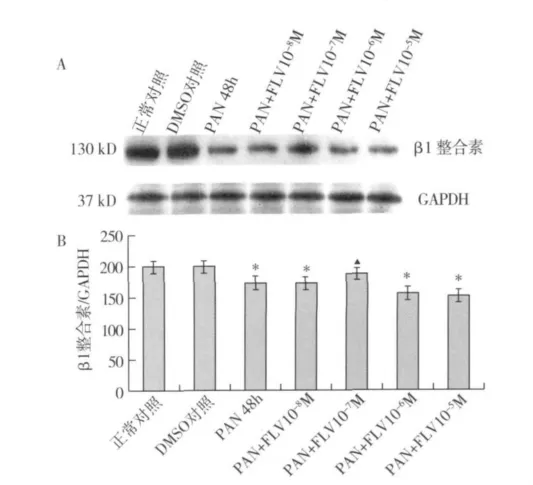
图2 不同浓度氟伐他汀对嘌呤霉素刺激下足细胞β1整合素表达的影响(A:Western blot法;B:灰度定量分析,其中GAPDH为内参)
PAN对足细胞内ROS表达的影响 与正常对照组相比,PAN作用12h,细胞内ROS水平开始升高,但无统计学差异(P>0.05),至24h有统计学意义(P<0.05),48h达峰值,72h足细胞内 ROS水平开始下降,但仍高于正常对照组(P<0.05)(图3)。

图3 不同刺激时间嘌呤霉素(PAN)对足细胞内活性氧簇表达的影响(全自动定量酶标仪检测)
FLV对PAN刺激下足细胞内ROS表达的影响 与正常对照组比较,PAN作用48h后,足细胞内ROS表达显著升高(P<0.05)。DMSO作用48h后,足细胞内ROS表达无显著改变(P>0.05)。经FLV干预,足细胞内ROS的表达下降,且FLV浓度为1×10-7M作用最显著(P<0.05)(图4)。
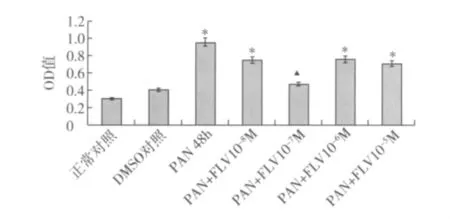
图4 不同浓度氟伐他汀对嘌呤霉素刺激下足细胞ROS表达的影响(全自动定量酶标仪检测)
足细胞β1整合素表达与ROS表达相关性分析见表1。
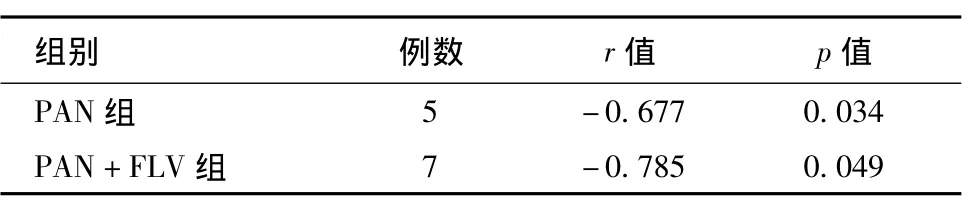
表1 足细胞β1整合素表达与活性氧簇表达相关性分析
FLV及PAN对足细胞活力的影响 与正常对照组比较,DMSO以及FLV浓度为1×10-8M和1×10-7M对足细胞的活力无明显影响(P>0.05),FLV浓度为1×10-6M和1×10-5M、PAN组、PAN+FLV组,在24h均明显抑制足细胞活力(P<0.05)。与PAN组相比,PAN与FLV 1×10-7M汀共同作用48h足细胞活力有明显的改善(P<0.05)(图5)。
讨 论
肾小球是肾脏的主要滤过单位,滤过屏障由内皮细胞、足细胞以及介于二者之间的基膜组成[9]。细胞组分以及基膜是保持滤过屏障完整性必要条件,任何部分的破坏都会导致肾功能障碍。足细胞与基膜之间黏附功能的改变是导致足细胞损伤脱落的重要原因,也是微小病变性肾病(MCD)、FSGS进展的机制之一。整合素是介导足细胞连接至基膜的主要受体。整合素是由α和β亚单位组成的异二聚体跨膜受体。α3β1整合素是足细胞上唯一的β1类整合素,它将足突细胞黏附于GBM基质上,而且还参与细胞内、外信号传导,对足细胞与GBM的结合起重要作用[10]。Kreidberg等[11]通过体内实验发现α3β1整合素是肾小球足细胞连接于基膜的主要整合素。特异性敲除α3整合素基因的小鼠出生后第1周出现大量蛋白尿,6周龄时出现肾小球硬化,肾脏病理发现其基膜不完整并分为多层,足细胞足突缺失[12]。虽然α3β1整合素是肾小球形成过程中足细胞连接于基膜的主要受体,有研究发现,β1整合素基因缺陷小鼠出现更为严重的表现,一出生即有蛋白尿,严重的足细胞丢失,最终进展为肾小球硬化[13],说明β1整合素在维持足细胞的黏附中起着更为重要的作用。研究FSGS患者肾脏病理发现,足细胞中α3β1整合素的表达明显低于正常人群,而由此导致的足细胞脱落,是肾小球硬化进展的关键因素[14]。由此可见由足细胞表达的整合素在维持肾单位完整性中起重要作用,但各类疾病中足细胞整合素表达下降的原因还未完全阐明。

图5 氟伐他汀(FLV)及嘌呤霉素(PAN)对足细胞活力的影响
活性氧产物是细胞损伤的重要介质。近年来,氧化应激在足细胞损伤中的作用越来越受到关注。研究发现,在 PAN模型、Heyman肾炎模型以及Mpv17(-/-)模型(激素抵抗FSGS模型)均发现ROS表达上调,预防性给予抗氧化剂可阻止足细胞融合和蛋白尿的发生[15]。体外培养的足细胞研究表明,ROS可直接攻击足细胞,并激活足细胞还原型尼克酰胺腺嘌呤核苷酸磷酸(NADPH)氧化酶产生过多的ROS,从而造成恶性循环[16]。PAN模型中,给予卵磷脂结合的超氧化物歧化酶(SOD)可减少蛋白尿并增加足细胞密度,该酶和人重组SOD相比有更高的细胞膜亲和力,亦可缓解由于PAN所导致的α3整合素异常表达[17]。
FLV作为经典的降脂药在临床上广泛应用,近年来其非降脂依赖性肾保护作用得以深入研究。他汀类药物通过抑制HMG-CoA还原酶阻断了甲羟戊酸途径的中间产物合成,抑制类异戊二烯的产生,从而阻碍各种蛋白酶及介质等转变为活性形式,并减少其与细胞膜的结合,导致细胞内二脂酰甘油-蛋白激酶C(DAG-PKC)激活减少,氧化自由基的产生减少,氧化损伤减轻。他汀类药物可抑制NADPH氧化酶的活性及通过影响氧化应激的多个环节,在糖尿病肾病早期就能起到肾脏保护作用。Mason等[18]发现治疗剂量的阿托伐他汀的O-羟基代谢产物,进入脂代谢后经质子传递直接清除ROS。西立伐他汀可减少链脲佐菌素(STZ)诱导的糖尿病大鼠的氧化应激,通过降低肾脏核因子κB活性从而抑制巨噬细胞浸润和ICAM-1在肾小球表达。罗苏伐他汀可减少肾和足细胞的NADPH氧化酶的激活,从而减少ROS的产生,减少蛋白尿。辛伐他汀可通过PI3K途径减少由NF-E2相关因子(Nrf2)导致的ROS升高[19]。随着永生化足细胞株的出现,使我们能够更直接的观察他汀类药物对足细胞的影响。
本实验发现,PAN刺激下,体外培养的人足细胞β1整合素表达下降,细胞内ROS表达上调,且具有时间依赖性。用FLV干预后,足细胞β1整合素表达上调,而ROS表达下降,且FLV浓度为1×10-7M作用48h效果最明显。ROS参与细胞信号传导,可从基因表达、增生、迁移和凋亡等各个方面影响细胞功能。Zheng等[6]研究发现在PAN干预下足细胞早期即可发现 ROS表达的增加。Wang等[20]发现NADPH氧化酶来源的ROS上调瞬间受体电位阳离子通道蛋白6(TRPC6)的表达在PAN诱导的足细胞损害中起了重要作用。另有文献报道,FLV能够通过上调Bcl-2来减轻由氧化应激导致的血管内皮细胞损伤[21]。本实验亦观察到FLV干预后PAN诱导的ROS表达下降,而通过β1整合素表达水平和足细胞内ROS表达水平的相关性分析发现,二者成负相关关系,由此可推测PAN诱导的足细胞内ROS表达增加可能是β1整合素表达下降的原因。但这仅是从统计学角度得出的结果,本实验未设立阳性对照组以及抗氧化剂组,所以FLV是否是通过抑制ROS的表达来上调β1整合素表达还需要进一步实验证明。进一步分析本实验结果发现,FLV对ROS的影响强于对β1整合素表达的影响,其可能原因是PAN诱导的β1整合素下降不只有ROS参与,可能还存在其他机制,有待进一步研究。Asuka等发现脂溶性的他汀类药物能够诱导肝细胞凋亡,导致肝细胞的减少[22]。本实验MTT结果表明低浓度的FLV对足细胞活力无明显影响,而高浓度FLV可明显抑制足细胞的活力,说明高浓度脂溶性FLV对足细胞有一定的毒性,而且其毒性与浓度呈正比,提示FLV在临床应用中应当采取合适的治疗剂量以避免产生明显的不良反应。由MTT结果可知PAN与FLV共同培养足细胞,对其活力有明显影响,与PAN组相比,PAN与1×10-7M FLV作用48h时足细胞活力有明显的改善,但仍低于正常对照组,说明PAN对足细胞有明显的损伤作用,而较低浓度的FLV对足细胞有保护作用,但其保护作用不完善。我们今后将进一步探索FLV对足细胞的保护机制。
1 Pavenstädt H,Kriz W,Kretzler M.Cell biology of the glomerular podocyte.Physiol Rev,2003,83(1):253-307.
2 Kojima K,Davidovits A,poczewski H,et al.Podocyte flattening and disorder of glomerular basement membrane are associated with splitting of dystroglycan-matrix interaction.J Am Soc Nephrol,2004,15(8):2079-2089.
3 Kretzler M.Regulation of adhesive interaction between podocytes and glomerular basement membrane.Microsc Res Tech,2002,57(4):247-253.
4 Chen J,Gui D,Chen Y,et al.Astragaloside IV improves high glucoseinduced podocyte adhesion dysfunction viaα3β1 integrin upregulation and integrin-linked kinase inhibition.Biochemical Pharmacol,2008,76(6):796-804.
5 Pollak MR.Focal segmental glomerulosclerosis:Recent advances.Curr Opin Nephrol Hypertens,2008,17(2):138-142.
6 Zheng CX,Chen ZH,Zeng CH,et al.Triptolide protects podocytes from puromycin aminonucleoside induced injury in vivo and in vitro.Kidney Int,2008,74(5):596-612.
7 Pan J,Huang ZM,Zhao XF,et al.Effect of silibinin on the expression of vascular endothelial growth factor(VEGF)in human podocytes induced by high glucose.Jiangsu Med J,2010,36(10):1124-1127.
8 Wang H,Joseph JA.Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader.Free Radic Biol Med,1999,27(5-6):612-616.
9 Miner JH.Building the glomerulus:a matricentric view.J Am Soc Nephrol,2005,16(4):857-861.
10 Hynes RO.Integrins:bidirectional,allosteric signaling machines.Cell,2002,110(6):673-687.
11 Kreidberg JA,Donovan MJ,Goldstein SL,et al.Alpha 3 beta 1 integrin has a crucial role in kidney and lung organogenesis.Development,1996,122(11):3537-3547.
12 Sachs N,Kreft M,van den Bergh Weerman MA,et al.Kidney failure in mice lacking the tetraspanin CD151.JCell Biol,2006,175(1):33-39.
13 Pozzi A,Jarad G,Moeckel GW,et al.Beta1 integrin expression by podocytes is required to maintain glomerular structural integrity.Dev Biol,2008,316(2):288-301.
14 Chen CA,Hwang JC,Guh JY,et al.Reduced podocyte expression of alpha3beta1 integrins and podocyte depletion in patients with primary focal segmental glomerulosclerosis and chronic PAN-treated rats.JLab Clin Med,2006,147(2):74-82.
15 Oba S,Hino M,Fujita T.Adrenomedullin protects against oxidative stress-induced podocyte injury as an endogenous antioxidant.Nephrol Dial Transplant,2008,23(2):510-517.
16 Vega-Warner V,Ransom RF,Vincent AM,et al.Induction of antioxidant enzymes in murine podocytes precedes injury by puromycin aminonucleoside.Kidney Int,2004,66(5):1881-1889.
17 Kojima K,Matsui K,Nagase M.Protection of alpha(3)integrinmediated podocyte shape by superocide dismutase in the puromycin aminonucleoside nephrosis rat.Am J Kidney Dis,2000,35(6):1175-1185.
18 Mason RP,Walter MF,Jacob RF.Effects of HMG-CoA reductase inhibition of endothelial function:role of microdomains and oxidative stress.Circulation,2004,109(21 Suppl 1):1134-1141.
19 Schaefer CA,Kuhlmann CR,Weiterer S,et al.Statins inhibit hypoxiainduced endothelial proliferation by preventing calcium-induced ROS formation.Atherosclerosis,2006,185(2):290-296.
20 Wang Z,Wei X,Zhang Y,et al.NADPH OXidase-derived ROS contributes to upregulation of TRPC6 expression in puromycin aminonucleoside-induced podocyte injury.Cell Physiol Biochem,2009,24(5-6):619-626.
21 Xu SZ,Zhong W,Watson NM,et al.Fluvastatin reduces oxidative damage in human vascular endothelial cells by upregulating Bcl-2.J Thromb Haemost,2008,6(4):692-700.
22 Asuka M,Takahisa Y,Yoshinori I,et al.Down-regulation of RhoA is involved in the cytotoxic action of lipophilic statins in HepG2 cells.Atherosclerosis,2009,7(33):1-7.

