肾素-血管紧张素-醛固酮系统与腹膜透析
陈伊文 综述 俞雨生 审校
腹膜是全身毛细血管最丰富的部位之一,腹膜间皮细胞可表达肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)成分,并在急、慢性炎症状态下发挥作用。长期腹膜透析(peritoneal dialysis,PD)可引起腹膜纤维化及腹膜血管增生。长期PD后腹腔局部RAAS激活,有效阻断RAAS能预防或延缓腹膜形态结构的变化,本文就RAAS在腹膜损伤中的作用机制及阻断RAAS对腹膜和残余肾功能的影响作一综述。
PD患者腹膜的形态结构特点
腹膜薄而光滑,主要由单层间皮细胞和间皮下结缔组织构成,是腹膜弥散和渗透超滤(ultrafiltration,UF)的结构基础。间皮细胞呈单层排列覆盖整个腹腔,形成一道机械防御屏障;间皮下结缔组织层是由细胞外基质(extracellular matrix,ECM)等大分子物质构成的一层复杂的网络结构层,主要成分为纤维连接蛋白(fibronectin,FN)、弹性蛋白和胶原等,此外还有不同管径的血管和细胞成分,如成纤维细胞、肥大细胞和巨噬细胞。生理状态下间皮下结缔组织厚度为40μm,尿毒症时增至150μm,PD后可厚达270μm,且与透析时间成正比。有研究者对尿毒症患者分别于PD治疗前后行腹膜活检发现,尿毒症时腹膜间皮细胞形态改变明显,间皮下结缔组织层显著增厚;PD后腹膜间皮细胞形态改变更大,可见上皮细胞间质化、细胞脱落、腹膜小血管壁透明样变、管腔狭窄甚至闭锁,静脉病变较动脉更为明显,且与透析时间呈正相关,透析6年以上者89%可见显著的血管病变[1-3]。
腹膜的另一形态改变是血管增生,该现象由Rubin等[4]首次报道。此后研究发现,与暴露于林格式乳酸盐透析液相比,暴露于4.25%葡萄糖透析液的大鼠腹膜新生血管数目明显增多,其中腹膜硬化者血管数目最多[5]。长期PD患者腹膜间皮细胞受损、脱落,向间充质转化,获得类似成纤维细胞特征,细胞外基质分泌增多,间皮下结缔组织层增厚,深层的疏松组织富含脂肪细胞,血管网丰富,小动脉、静脉管壁发生透明样变性,管腔狭窄或闭锁(图1)。
Davies等[7]发现长期PD患者的腹膜小分子溶质转运增加,而超滤能力下降。前者可能与腹膜血管增生、总有效交换表面积扩大及血管通透性增加等有关。而超滤功能下降则由多种因素引起,如血管增生导致葡萄糖渗透压梯度迅速消散,腹膜纤维化导致腹膜对葡萄糖的电导下降等。Kawaguchi等[5]报道24%患者因超滤功能衰竭退出PD,其中PD 6年以上者占51%。故有必要详细了解腹膜形态结构改变,从而采取相应措施以提高技术存活率。
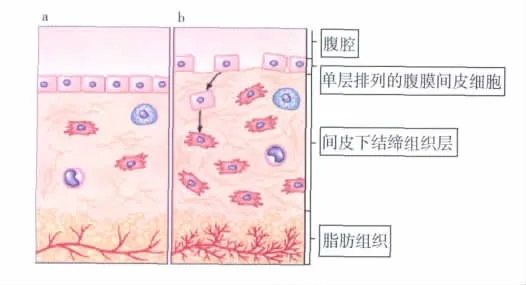
图1 生理及腹膜透析(PD)后腹膜组织学特点[6]
腹膜局部RAAS
RAAS作为内分泌系统,在调节血压、电解质和血容量稳定等方面起着重要作用。近年研究表明,局部RAAS过度活化是导致肾、心、肺等重要脏器纤维化的主要因素。Gilbert等[8]证实肾小管上皮细胞分泌的肾素、血管紧张素(angiotensin,Ang),以自分泌或旁分泌形式与其相应受体结合,将信号向细胞内传递,使细胞内的smad蛋白磷酸化,形成二聚体进入细胞核,调控靶基因转录,直接刺激ECM的生成,同时既可通过抑制降解基质的酶如胶原酶等合成,又可通过促进纤溶酶原激活物抑制物1(PAI-1)、金属蛋白酶组织抑制物(TIMP)等蛋白酶抑制物的表达促进ECM积聚。腹膜间皮细胞拥有自己的RAAS系统,Noh等[9]的研究表明,体外培养的人腹膜间皮细胞可表达血管紧张素原、血管紧张素转换酶(angiotensin converting enzyme,ACE)、AngⅡ1 型和2型受体、转化生长因子β(transforming growth factor-β,TGF-β)和 FN。Ang 还可诱导血管内皮生长因子(vascular endothelial growth factor,VEGF)Ⅰ型受体和醛固酮表达,前者可促进腹膜新生血管的生成及重塑,增加内皮通透性,促进ECM在内皮细胞外堆积,直接导致间质纤维化。
腹膜RAAS激活
腹膜间皮细胞能表达RAAS的所有组成成分,灌入的PD液能上调这些基因的表达。RAAS激活与PD液的生物不相容性有关,包括高糖、低pH、乳酸盐和葡萄糖降解产物(glucose degradation products,GDPs)等。RAAS激活导致间皮细胞受损脱落,微绒毛减少,粗面内质网和高尔基体增加,细胞由扁平变为柱状,细胞间结合部位加长加宽,干扰细胞损伤后的修复。
高糖 葡萄糖是RAAS系统最重要激活剂之一,1.5%透析液中葡萄糖浓度为 76 mmol/L,4.25%透析液糖高达215 mmol/L。体外研究表明高糖促进血管紧张素原、ACE、Ang Ⅱ、TGF-β、VEGF和 FN 分泌增加[9,10],而甘露醇无此作用,说明RAAS的激活与透析液的渗透压无关。这些研究均提示腹腔局部存在RAAS,长期PD患者腹膜组织学改变与典型的糖尿病微血管病变相似,均可观察到局部RAAS的活化。
低pH 葡萄糖作为渗透剂必须保持透析液为酸性,可使腹膜间皮细胞活力下降,TGF-β表达增加,从而激活RAAS,参与腹膜纤维化。体外研究表明,酸性环境下大鼠腹膜增厚,间皮细胞脱落,而使用RAAS阻断剂后,这种现象可减弱甚至消失[11]。
乳酸盐和葡萄糖降解产物(GDPs) 体内多种蛋白质与还原糖发生非酶糖基化反应,最终生成不可逆的糖基化终末产物(advanced glycation end products,AGE),AGE通过与细胞受体结合发挥生物学作用,引起腹膜间质纤维化和超滤衰竭。长期使用酸性和葡萄糖透析液的患者其腹膜间皮层、血管壁、结缔组织层均可见AGE沉积,而使用中性pH及低GDPs透析液时TGF-β、VEGF的表达较低于使用1.5%透析液时。
腹膜炎 大鼠模型腹膜炎时,AngⅡ、TGF-β、纤维蛋白原水平升高,ECM成分合成增加,而使用厄贝沙坦和醛固酮后能有效抑制腹膜纤维化[12]。
RAAS在腹膜损伤中的作用
腹膜 RAAS激活,引起 TGF-β、VEGF表达上调。Margetts等[13]发现置于 TGF-β 浓度较高微环境中的腹膜间皮细胞下紧密结缔组织层厚度明显增厚,PD引流液中VEGF含量更高,腹膜血管数目增加,而净超滤量减少。在另一个实验中,将编码抗纤维化和抗血管增生的基因转移到正常小鼠腹膜中,产生的TGF-β蛋白多糖抑制剂,能有效减轻腹膜纤维化程度,抑制新生血管形成,改善腹膜超滤功能。在局部或系统性刺激因子的作用下,腹膜局部RAAS激活,以自分泌或旁分泌形式与相应受体结合,将信号向细胞内传递,产生促进腹膜纤维化或血管增生的细胞因子,从而引起腹膜纤维化及腹膜血管增加(图2)。

图2 RAAS对腹膜的影响[6]
Margetts等[14]将携带活性 TGF-β 腺病毒载体转染至大鼠腹膜间皮细胞,28d后与对照组相比发现,腹膜显著增厚,大量胶原沉积,证实腹膜间皮细胞过度表达TGF-β使ECM沉积增加,是腹膜纤维化的主要原因。随着PD时间延长,腹膜间皮上皮细胞表型逐渐丧失,获得类似成纤维细胞特征,并向间皮下紧密结缔组织层迁移,引起 ECM堆积和VEGF高表达。Aroeira等[15]认为促进上皮细胞-间充质转化的因素包括炎症、AGE、GDPs、AngⅡ、低pH、机械损伤及腹腔积血。AngⅡ可直接或间接介导TGF-β而发挥促纤维化作用,是参与RAAS激活的另一重要介质,抑制RAAS的活化对阻止或限制上皮细胞-间充质化有重要意义。
尽管目前有很多动物实验研究表明腹膜机械损伤能引起RAAS的激活,但这些研究观察时间较短,而且动物的肾功能大多是正常的。目前尚缺乏对终末期肾病长期PD患者的观察研究。
腹膜保护策略
长期PD使腹膜间皮细胞受损,腹膜局部RAAS激活,针对其活化途径可采取以下措施抑制RAAS的启动:(1)阻断全身RAAS;(2)阻断腹膜局部RAAS。
全身RAAS的阻断 体外、动物和临床试验证实RAAS阻断剂对腹膜功能有保护作用,阻断RAAS系统的生理病理作用有以下三个位点:血管紧张素转换酶抑制剂(ACE inhibitor,ACEI)减少血管紧张素原向Ang I转化;血管紧张素受体拮抗剂(angiotensin-receptor blocker,ARB)阻断 Ang II的作用;肾素抑制剂(RI)则从源头上阻断RAAS系统,与前两种阻断剂相比,其优点在于比ACEI更有效减少AngⅡ生成,消除ARB致AngⅡ堆积效应及AngⅡ对各种亚型受体的激活。醛固酮受体拮抗剂可抑制心肌、肺和肝纤维化,但在腹膜纤维化中的作用未见报道。
除经典的ACE途径外,AngⅡ还有其他生成旁路,组织蛋白酶G、组织纤溶酶原激活剂、弹性蛋白酶和糜蛋白酶等均可催化其生成。长期应用ACEI,导致AngⅠ堆积,可使旁路激活,循环及组织的AngⅡ浓度逐渐回升到治疗前水平,即出现所谓的“血管紧张肽Ⅱ逃逸”现象[16]。
Noh等[9]在大鼠实验中发现,氯沙坦可抑制大鼠腹膜TGF-β和VEGF的合成和分泌,延缓腹膜的硬化,并改善腹膜的超滤功能,具有腹膜保护作用。Duman等[17]在动物实验中在腹腔内注入高渗性葡萄糖发现,依那普利可部分抑制大鼠腹膜纤维化和炎症细胞浸润,因此推测ACEI和ARB可通过抑制TGF-β预防腹膜纤维化。
侯凡凡等[18]对血肌酐为265.2~442μmol/L(3~5mg/dl)的非糖尿病肾病患者的随机对照研究表明,应用贝那普利20mg/d平均治疗3.4年后,与安慰剂组比较,达到主要终点的危险率降低43%(P=0.005),蛋白尿水平降低52%,肾功能减退速度降低23%,主要不良事件的总发生率与安慰剂组相似。
目前有关ACEI/ARB用于PD患者的临床研究较少。Kolesnyk等[19]对PD治疗两年以上的66例患者回顾性分析发现,使用ACEI/ARB治疗组小分子溶质转运增加,但ACEI/ARB治疗前后两组患者的技术存活率没有差异。而2008年Fang等[20]发现使用ARB/ACEI前后两组患者的生存率有差别。Li等[21]观察到 PD患者使用用雷米普利12个月后,rGFR下降速度较对照组明显减慢。Snzuki等[22]观察了接受非卧床持续性腹膜透析(CAPD)治疗患者应用ARB(缬沙坦)治疗24个月的疗效,治疗前ARB组与对照组的肌酐清除率水平相当,治疗24个月后两组间肌酐清除率的差异有统计学意义(P<0.01),缬沙坦可明显延缓RRF减退。上述结果表明,RAAS阻断剂延缓肾功能减退的作用在PD患者也依然持续存在。
阻断局部RAAS
生理性透析液 有研究提示使用艾考糊精PD液后反映腹膜间皮细胞功能和增生的指标得到明显改善[23]。但也有学者认为艾考糊精透析液和含糖透析液对腹膜间皮细胞均有毒性作用[24]。而Kim等[25]的体外大鼠模型表明使用艾考糊精透析液组的腹膜厚度、TGF-β含量低于2.5%葡萄糖透析液组。EAPOS对177例APD患者观察两年发现,与葡萄糖透析液组相比,即使在基线时艾考糊精组的腹膜超滤能力较差,但两年后其小分子溶质转运率仍上升较慢,因此腹膜功能保护较好[26]。
中性pH值、低GDPs透析液 动物模型表明中性pH值、低GDPs的透析液与TGF-β和VEGF的表达减少有关[27],意味着腹膜纤维化减弱及血管生成减少。较多研究显示,与传统透析液相比,使用中性pH值透析液后引流液中CA125水平更高[28]。然而,PD纤维化的标志物如引流液中TGF-β和ICTP等,并不受 pH、GDPs含量的影响[25]。值得关注的是,前期随机对照试验表明,使用中性 pH值、低GDPs的透析液后,腹膜超滤有减少的趋势,而腹膜转运速度加快[28]。
维生素 D(vitamin D,Vit D)制剂 Vit D是调节RAAS及活化肾脏组织的因子之一,Vit D的缺乏与RAAS系统活性上调相关,补充Vit D可抑制RAAS活化[29,30]。绝大部分 PD 患者缺乏 25(OH)Vit D 和 1,25(OH)2Vit D[31],补充活性和(或)非活性的Vit D在减轻腹膜局部RAAS活化方面的潜在作用还有待进一步研究。
小结:腹膜间质细胞拥有RAAS,可表达 Ang、ACE及其相关受体、TGF-β和FN,有可能对腹膜纤维化及血管新生的发生起重要作用。RAAS系统阻断剂如ACEI和ARB在腹膜保护方面可能发挥重要作用,部分临床研究证实ACEI/ARB能延缓RRF下降速率,其确切临床效果有待进一步研究证实。
1 Williams JD,Craig KJ,Topley N,et al.Morphologic changes in the peritoneal membrane of patients with renal disease.J Am Soc Nephrol,2002,13(2):470 - 479.
2 Williams JD,Craig KJ,Topley N,et al.Peritoneal dialysis:changes to the structure of the peritoneal membrane and potential for biocompatible solutions.Kidney Int,2003,84(Suppl):S158 -161.
3 Contreras-Velazquez JC,Soto V,Jaramillo-Rodriguez Y,et al.Clinical outcomes and peritoneal histology in patients starting peritoneal dialysis are related to diabetic status and serum albumin levels.Kidney Int,2008,108(Suppl):S34 - 41.
4 Rubin J,Herrera GA,Collins D.An autopsy study of the peritoneal cavity from patients on continuous ambulatory peritoneal dialysis.Am JKidney Dis,1991,18(1):97 -102.
5 Kawaguchi Y,Hasegawa T,Nakayama M,et al.Issues affecting the longevity of the continuous peritoneal dialysis therapy.Kidney Int,1997,62(Suppl):S105 -107.
6 Nessim SJ,Perl J,Bargman JM.The renin-angiotensin-aldosterone system in peritoneal dialysis:is what is good for the kidney also good for the peritoneum?Kidney Int,2010,78(1):23 -28.
7 Davies SJ.Longitudinal relationship between solute transport and ultrafiltration capacity in peritoneal dialysis patients.Kidney Int,2004,66(6):2437 -2445.
8 Gilbert RE,Wu LL,Kelly DJ,et al.Pathological expression of renin and angiotensin II in the renal tubule after subtotal nephrectomy.Implications for the pathogenesis of tubulointerstitial fibrosis.Am J Pathol,1999,155(2):429 -440.
9 Noh H,Ha H,Yu MR,et al.Angiotensin II mediates high glucoseinduced TGF-beta1 and fibronectin upregulation in HPMC through reactive oxygen species.Perit Dial Int,2005,25(1):38 -47.
10 Chitalia VC,Almeida AF,Rai H,et al.Is peritoneal dialysis adequate for hypercatabolic acute renal failure in developing countries?Kidney Int,2002,61(2):747 -757.
11 Nakamoto H,Imai H,Fukushima R,et al.Role of the reninangiotensin system in the pathogenesis of peritoneal fibrosis.Perit Dial Int,2008,28(Suppl 3):S83 -87.
12 Ersoy R,Celik A,Yilmaz O,et al.The effects of irbesartan and spironolactone in prevention of peritoneal fibrosis in rats.Perit Dial Int,2007,27(4):424 -431.
13 Margetts PJ,Kolb M,Galt T,et al.Gene transfer of transforming growth factor-beta1 to the rat peritoneum:effects on membrane function.JAm Soc Nephrol,2001,12(10):2029 -2039.
14 Margetts PJ,Bonniaud P,Liu L,et al.Transient overexpression of TGF-{beta}1 induces epithelial mesenchymal transition in the rodent peritoneum.J Am Soc Nephrol,2005,16(2):425 -436.
15 Aroeira LS,Aguilera A,Sanchez-Tomero JA,et al.Epithelial to mesenchymal transition and peritoneal membrane failure in peritoneal dialysis patients:pathologic significance and potential therapeutic interventions.JAm Soc Nephrol,2007,18(7):2004 -2013.
16 Sica DA.Combination angiotensin-converting enzyme inhibitor and angiotensin receptor blocker therapy:its role in clinical practice.J Clin Hypertens(Greenwich),2003,5(6):414 -420.
17 Duman S,Sen S,Duman C,et al.Effect of valsartan versus lisinopril on peritoneal sclerosis in rats.Int JArtif Organs,2005,28(2):156 -163.
18 Hou FF,Zhang X,Zhang GH,et al.Efficacy and safety of benazepril for advanced chronic renal insufficiency.N Engl J Med,2006,354(2):131-140.
19 Kolesnyk I,Dekker FW,Noordzij M,et al.Impact of ACE inhibitors and AII receptor blockers on peritoneal membrane transport characteristics in long-term peritoneal dialysis patients.Perit Dial Int,2007,27(4):446 -453.
20 Fang W,Oreopoulos DG,Bargman JM.Use of ACE inhibitors or angiotensin receptor blockers and survival in patients on peritoneal dialysis.Nephrol Dial Transplant,2008,23(11):3704 - 3710.
21 Li PK,Chow KM,Wong TY,et al.Effects of an angiotensin-converting enzyme inhibitor on residual renal function in patients receiving peritoneal dialysis.A randomized,controlled study.Ann Intern Med,2003,139(2):105 -112.
22 Suzuki H,Kanno Y,Sugahara S,et al.Effects of an angiotensin II receptor blocker,valsartan,on residual renal function in patients on CAPD.Am J Kidney Dis,2004,43(6):1056 -1064.
23 Bajo MA,Selgas R,Castro MA,et al.Icodextrin effluent leads to a greater proliferation than glucose effluent of human mesothelial cells studied ex vivo.Perit Dial Int,2000,20(6):742 -747.
24 Posthuma N,Verbrugh HA,Donker AJ,et al.Peritoneal kinetics and mesothelial markers in CCPD using icodextrin for daytime dwell for two years.Perit Dial Int,2000,20(2):174 -180.
25 Kim S,Oh J,Chung W,et al.Benefits of biocompatible PD fluid for preservation of residual renal function in incident CAPD patients:a 1-year study.Nephrol Dial Transplant,2009,24(9):2899 -2908.
26 Davies SJ,Brown EA,Frandsen NE,et al.Longitudinal membrane function in functionally anuric patients treated with APD:data from EAPOSon the effects of glucose and icodextrin prescription.Kidney Int,2005,67(4):1609 -1615.
27 Mortier S,Faict D,Lameire NH,et al.Benefits of switching from a conventional to a low-GDP bicarbonate/lactate-buffered dialysis solution in a rat model.Kidney Int,2005,67(4):1559 - 1565.
28 Fusshoeller A,Plail M,Grabensee B,et al.Biocompatibility pattern of a bicarbonate/lactate-buffered peritoneal dialysis fluid in APD:a prospective,randomized study.Nephrol Dial Transplant,2004,19(8):2101-2106.
29 Freundlich M,Quiroz Y,Zhang Z,et al.Suppression of reninangiotensin gene expression in the kidney by paricalcitol.Kidney Int,2008,74(11):1394 -1402.
30 Kong J,Qiao G,Zhang Z,et al.Targeted vitamin D receptor expression in juxtaglomerular cells suppresses renin expression independent of parathyroid hormone and calcium.Kidney Int,2008,74(12):1577-1581.
31 Taskapan H,Ersoy FF,Passadakis PS,et al.Severe vitamin D deficiency in chronic renal failure patients on peritoneal dialysis.Clin Nephrol,2006,66(4):247 - 255.

