肥胖相关性肝肾疾病的新机制
陈慧梅 综述 曾彩虹 审校
肥胖的发病率逐年增加,已成为严重的全球性健康问题。美国肥胖发生率20年间从12%增至20%[1];中国肥胖问题也正以“令人担忧”的速度增长,现有近15%人口体重超标,肥胖者数目也已超过9 000万,预计未来十年将超过2亿[2]。更重要的是,肥胖会直接引发或加重慢性肾脏病、心血管疾病以及恶性肿瘤。
研究表明,肥胖除直接引发肥胖相关性肾病外,还通过高血糖、高血压以及动脉粥样硬化等因素,间接加重慢性肾脏损伤的风险[3]。流行病学研究证实了肥胖的直接致病效应。1974年,Weisinger等[4]报道首例肥胖引发的肾病综合征。Hsu等[5]大规模的随访研究发现,在排除种族、抽烟和心血管疾病等影响因素,超重及肥胖显著增加终末期肾病(ESRD)的风险;即使排除高血压和糖尿病的影响,肥胖仍使ESRD的风险增加3倍;并随着肥胖的严重程度,风险进一步增高。近5年来,随着我国肥胖人数急速增加,肥胖相关性肾病的发病率也从0.6%快速增至1.0%[6],临床往往出现蛋白尿,不一定合并糖尿病和高血压,病理表现为足细胞和肾小球的肥大,系膜扩张,部分伴有局灶节段性肾小球硬化[7]。肝脏是肥胖容易损伤的另一个靶器官,非酒精性脂肪肝是西方国家最多的肝脏疾病,发病率高达15%~30%,我国的发生率也正逐年上升[8]。
肝脏和肾脏疾病进程相互影响,肥胖同是这两类疾病的发病基础,其共同机制的研究便尤为重要[9]。最新研究表明,血清胎球蛋白 A、脂联素和5'-AMP激活的蛋白激酶(AMPK),协同参与脂肪、肾脏和肝脏间的调节。因此,本文就这一通路的研究进展作一综述,探讨肥胖相关性肝、肾疾病的共同发病机制,为找寻新的治疗靶点提供可能。血清胎球蛋白A与胰岛素抵抗
血清胎球蛋白A上是分子质量为64kD的糖蛋白,包括两个胱抑素样区域,广泛存在于大鼠、小鼠、兔、羊、牛等物种。人在胚胎期达到峰值,成人期主要由肝脏分泌,聚集于骨骼系统和血液系统[10]。血清胎球蛋白A曾被认作异位钙化抑制剂,近年来,它诱发胰岛素抵抗和肾脏损伤的作用越来越受到关注[11]。
血清胎球蛋白A抑制胰岛素受体酪氨酸激酶(receptor tyrosine kinase,RTKs),下调肝脏、骨骼肌的胰岛素信号转导通路,引发胰岛素抵抗[10]。血清胎球蛋白A敲除小鼠的血糖清除率和胰岛素敏感性显著增加;高脂饮食下体重增加不明显[12]。外源性补充血清胎球蛋白A会直接诱导野生型小鼠出现胰岛素抵抗[13]。临床研究表明,无论一般人群、慢性肾脏病或ESRD患者,血清血清胎球蛋白A增加均与肥胖、胰岛素抵抗显著正相关,增加糖尿病的发病风险[14]。非酒精性脂肪肝也与血清胎球蛋白A水平关系密切。短期饮食控制和运动治疗,可有效降低血清中胎球蛋白A含量,从而改善肥胖状态和肝脏病变[15]。然而,血清胎球蛋白A参与胰岛素抵抗的具体机制尚不清楚,作为肝脏分泌的蛋白,其诱导胰岛素抵抗究竟是非酒精性脂肪肝发病的原因,还是该疾病的结果,亦或是其他因素同时引发非酒精性脂肪肝和血清胎球蛋白A增加,都属未知。
血清胎球蛋白A与脂联素具有协同调节胰岛素通路的作用。编码血清胎球蛋白A和脂联素的基因同位于3号染色体q27,是糖尿病和代谢综合征的易感区域[16]。血清中这两种蛋白水平均与代谢综合征直接相关,但作用相反[17]。如体质量指数增加以及高三酰甘油等代谢紊乱时,血清胎球蛋白A含量上升,而脂联素水平显著下降;吡格列酮可降低血清胎球蛋白A水平,而增加脂联素水平。963例临床研究发现,血清胎球蛋白A与脂联素水平负相关(r= -0.27,P <0.001)[13];多个小样本分析也证实了上述结论。此外,血清胎球蛋白A可直接抑制脂肪细胞脂联素mRNA转录,并且特异性地降低小鼠血清脂联素水平,对其他脂肪因子(如leptin和resistin)无抑制作用。总之,肝脏分泌的血清胎球蛋白A抑制脂肪组织生成脂联素,血清胎球蛋白A和脂联素协同作用,参与肥胖介导的胰岛素抵抗和糖尿病的发生。
脂联素是联系脂肪、肾脏和肝脏的枢纽
脂联素是脂肪组织特异性分泌的胶原样细胞因子,相对分子质量为30 kD[18]。研究表明,脂联素能够增加胰岛素敏感性,对抗炎症及动脉粥样硬化,调节体重和游离脂肪酸(FFA)的氧化[19]。在外周循环中,脂联素往往以3个球形结构域单体连接成三聚体,4~6个三聚体以结构域进一步形成高级结构,多聚体的球形结构有效地改善胰岛素抵抗,增加脂肪酸氧化[18]。
有趣的是,尽管脂联素是一种脂肪因子,但随着肥胖患者体内脂肪堆积,血清脂联素含量反而进行性下降,基因表达和蛋白分泌均受抑制[20,21]。脂联素缺乏的小鼠表现为高脂饮食诱导的胰岛素抵抗,补充脂联素则能显著地增加胰岛素敏感性[22]。
脂联素主要通过与受体结合而发挥作用,其中,AdipoR1和AdipoR2是研究最多的两类受体[23],两者结构高度相似,有66.7%的同源性,均包含了七个跨膜结构域。与G蛋白偶联受体(GPCRs)的结构相反,其N端在细胞内,C端在细胞外。因此AdipoR可能不通过G蛋白偶联通路,而直接与下游信号分子作用,但具体的细胞内信号传导并不清楚。
人体多种组织细胞表面分布、表达脂联素受体,不同的脂联素与不同的受体结合,敏感性也不同。AdipoR1在体内分布较广,主要表达于骨骼肌细胞;AdipoR2则主要分布于肝细胞。若同时高表达两种受体,能有效改善db/db小鼠的胰岛素敏感性[24]。其中,增加AdipoR1可抑制肝糖原异生的酶系;增加AdipoR2会刺激葡糖激酶和过氧化物酶体增殖活化受体-α(peroxisome proliferator-activated receptorα,PPAR-α),及其下游基辅酶 A氧化酶1(acyl-CoA oxidase 1)和解偶联蛋白2(uncoupling protein 2),增加糖吸收。特异性地敲除AdipoR1或AdipoR2证实,AdipoR1主要参与AMPK活化,而AdipoR2则介导了PPAR-α通路。
脂联素与白蛋白尿关系密切。Looker等[25]比较2型糖尿病患者发现,血脂联素水平与尿白蛋白/肌酐比率(ACR)正相关,而与肾脏功能负相关。Tsioufis等[26]对高血压的研究证实,血脂联素水平与尿白蛋白的排泄直接负相关。因此,脂联素是脂肪与肾脏间的调节剂,随着脂肪组织的累积而减少,参与调节肾小球的功能。除了脂联素与肾脏功能直接负相关外,两者的间接作用也值得关注。例如,脂联素能介导炎症、营养不良以及动脉粥样硬化等,加重肾脏功能恶化、诱导ESRD的发生。脂联素敲除小鼠出现明显白蛋白尿,病理上表现为足细胞的足突融合。足细胞是肾脏内表达AdipoR1的靶细胞,补充脂联素能有效地缓解白蛋白尿,恢复正常足突结构[27]。
研究表明,脂联素与AdipoR1结合,通过活化AMPK介导脂联素的作用[28]。AMPK是存在于大多数哺乳动物组织的一种蛋白激酶,其激活有利于增加葡萄糖的摄入,脂肪酸氧化和胰岛素的敏感性。脂联素能直接激活 AMPK,抑制 NADPH氧化酶(Nox4),维持足细胞的正常结构和功能。5/6肾切除模型证实,补充脂联素对治疗小鼠白蛋白尿和肾纤维化的作用明显[29]。因此,脂联素通过与AdipoR1结合,刺激肾小球固有细胞(内皮细胞、系膜细胞、足突细胞)AMPK的磷酸化,抗氧化、维持细胞功能。尚不清楚AdipoR2受体通路是否参与了脂联素的肾脏保护作用。
另一方面,胰岛素抵抗、肥胖与非酒精性脂肪肝的发病关系密切[30]。非酒精性脂肪肝病包括单纯性脂肪肝和脂肪性肝炎、肝硬化。尽管脂肪炎症是一种相对良性的病理类型,但肝脏脂质的超氧化和相应线粒体损伤,促使其向脂肪纤维化及结节性硬化发展[31]。
临床研究显示,非酒精性脂肪肝病患者血浆中脂联素水平显著低于健康对照者,并随着肝脏炎症和纤维化的加重进一步下降[32]。Adachi等[33]发现,伴随AMPK活化脂联素体外可直接抑制肝星状细胞的增生及迁移,并呈现剂量依赖性;相应抑制AMPK,则能有效地逆转细胞增生,下调抗氧化酶超氧化物歧化酶2(superoxide dismutase 2,SOD2)和过氧化氢酶(catalase)。Nox2途径可能参与NADPH氧化及非酒精性脂肪肝的发病,但与疾病发生的关系尚不明确[34]。研究提示转化生长因子β可刺激肝细胞中Nox4的表达,推测Nox4可能参与了肝脂肪变性向脂肪性肝炎及脂肪性肝硬化的发展过程,但Nox4与非酒精性脂肪肝病发生的直接研究相对较少[35]。总之,脂肪因子脂联素是通过AMPK依赖的途径,降低氧化应激反应,从而抑制非酒精性脂肪肝病的发生发展。这一过程与脂联素作用于足细胞的反应相一致。
AMPK活性降低与肥胖相关性疾病
尽管肥胖引发白蛋白尿和非酒精性脂肪肝病的机制并不十分清楚,但AMPK通路调节葡萄糖代谢和脂肪酸氧化等作用,被公认为肥胖相关性疾病形成的原因之一。AMPK作为一种蛋白激酶,广泛存在于骨骼肌、肝脏、胰腺和脂肪组织中,参与细胞对营养和环境变化的适应性调节等多种代谢过程。其本质是高度保守的丝氨酸/苏氨酸蛋白激酶,调节过程复杂:当体内葡萄糖水平下降、能量缺乏,AMPK被激活,短期关闭能量消耗途径的mRNA转录和蛋白质翻译,开启部分能量合成的备用途径,维持细胞内能量平衡;一旦能量供给恢复,AMPK被抑制,基因转录和表达重新开启甚至上调,细胞又回到活跃的生长和分裂阶段[36]。由于低等动物都存在能量缺乏的威胁,AMPK活化对于物种的保存和进化有着重要意义。然而,在物质水平极大丰富的今天,持续和过多的能量供给则更值得关注,它会导致AMPK一直处于慢性失活状态,上调细胞内多种蛋白的表达,引发肾脏等靶器官的损伤[37]。
AMPK通路的研究在肾脏领域才刚刚起步,最新报道提示AMPK活性的降低会出现细胞肥大,系膜扩张和系膜基质积聚等肥胖相关性肾病的特征性改变[27]。正常情况下,足细胞AMPK处于活化状态,而脂联素的缺失会引起AMPK失活,继而出现足突融合。体外研究进一步证实,抑制AMPK会显著地改变足细胞表型。而AMPK类似物,氨基咪唑羧基酰胺核糖核苷酸(aminoimidazole carboxamide ribonucleotide,AICAR),可通过活化 AMPK恢复脂联素缺失引起的足细胞损伤,改善蛋白尿等肾脏损伤。
AMPK通路在肝脏疾病中的研究相对透彻,AMPK的活化参与调节脂联素作用于肝脏,减缓肝脏的脂肪变性,而高脂饮食诱导的非酒精性脂肪肝与AMPK的失活关系密切[38]。肝脏中AMPK活化往往引发下游脂肪酸氧化,抑制糖原生成及相关脂质和蛋白合成。对基因缺陷型慢性肝病的小鼠而言,AMPK活化能有效地对抗高脂饮食引发的脂肪堆积和肝脏脂肪变性。
目前,许多研究者正基于血清胎球蛋白A降低、脂联素升高和AMPK活化的通路,探寻治疗肥胖以及相关性肾病和肝病的可能措施和药物[39]。饮食控制、运动和胰岛素增敏剂(如吡格列酮)都能有效地降低血清胎球蛋白A水平,相应增加脂联素含量、活化AMPK。血管紧张素Ⅱ可降低脂联素水平,而血管转化酶抑制剂和血管紧张素受体拮抗剂则通过影响血管内脂肪组织,增加脂联素。白藜芦醇作为一种去乙酰化酶(sirtuin)激动剂,可部分活化AMPK,改善高脂喂养动物的心、肝和肾等器官功能。越来越多的研究直接或利用一些药物(如去乙酰化酶激动剂)间接增加体内的脂联素水平,探讨对肥胖相关性肾病和(或)肝病患者的临床应用价值,希望有效改善器官功能,减轻社会医疗资源负荷。
总之,过多能量摄入会导致脂肪堆积和后续一系列反应,最终出现器官功能障碍,包括肥胖相关性肾病和非酒精性脂肪肝。这类疾病有着共同的致病机制,其中血清胎球蛋白A和脂联素是联系脂肪组织、肝脏及肾病的关键蛋白组分,并通过激活AMPK而发挥作用(图1)。然而,现有的研究远未能阐明肥胖相关性疾病的机理,包括血清胎球蛋白A、脂联素和AMPK途径其自身的调节与leptin、resistin等脂肪因子、游离脂肪酸、葡萄糖及内皮细胞功能间的影响,多种因素网络状参与调节疾病的发生、发展,将是今后研究的重点和方向。
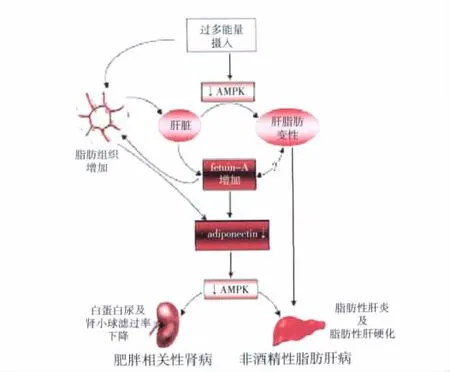
图1 血清胎球蛋白A、脂联素和AMPK途径与肥胖相关性肾病和肝病
1 Mokdad AH,Ford ES,Bowman BA,Prevalence of obesity,diabetes,and obesity-related health risk factors,2001.JAMA,2003,289(1):76-79.
2 Li X,Zheng C,and Rosenthal RJ.The new concept of bariatric surgery in China—reevaluation of surgical indications and criteria of therapeutic effect of laparoscopy for treatment of obesity.Obes Surg,2008,18(9):1180 -1182.
3 陈慧梅,刘志红.肥胖相关性肾病的发病机制.肾脏病与透析肾移植杂志,2005,12(3):1 -10.
4 Weisinger JR,Kempson RL,Eldridge FL,et al.The nephrotic syndrome:a complication of massive obesity.Ann Intern Med,1974,81(4):440-447.
5 Hsu CY,Iribarren C,McCulloch CE,et al.Risk factors for end-stage renal disease:25-year follow-up.Arch Intern Med,2009,169(4):342-350.
6 Chen HM,Li SJ,Chen HP,et al.Obesity-related glomerulopathy in China:a case series of 90 patients.Am JKidney Dis,2008,52(1):58-65.
7 陈慧梅,刘志红,李世军,等.肥胖相关性肾病患者流行病学资料及临床病理特征分析.肾脏病与透析肾移植杂志,2008,15(1):1-10.
8 Chitturi S,Farrell GC,Hashimoto E,et al.Non-alcoholic fatty liver disease in the Asia-Pacific region:definitions and overview of proposed guidelines.J Gastroenterol Hepatol,2007,22(6):778-787.
9 Chang Y,Ryu S,Sung E,et al.Nonalcoholic fatty liver disease predicts chronic kidney disease in nonhypertensive and nondiabetic Korean men.Metabolism,2008,57(4):569 -576.
10 Hermans MM,Brandenburg V,Ketteler M,et al.Association of serum fetuin-A levels with mortality in dialysis patients.Kidney Int,2007,72(2):202-207.
11 Auberger P,Falquerho L,Contreres JO,et al.Characterization of a natural inhibitor of the insulin receptor tyrosine kinase:cDNA cloning,purification,and anti-mitogenic activity.Cell,1989,58(4):631-640.
12 Mathews ST,Rakhade S,Zhou X,et al.Fetuin-null mice are protected against obesity and insulin resistance associated with aging.Biochem Biophys Res Commun,2006,350(2):437 -443.
13 Hennige AM,Staiger H,Wicke C,et al.Fetuin-A induces cytokine expression and suppresses adiponectin production.PLoS One,2008,3(3):e1765.
14 Ix JH,Shlipakmg,Brandenburg VM,et al.Association between human fetuin-A and the metabolic syndrome:data from the Heart and Soul Study.Circulation,2006,113(14):1760 -1767.
15 Stefan N,Hennige AM,Staiger H,et al.Alpha2-Heremans-Schmid glycoprotein/fetuin-A is associated with insulin resistance and fat accumulation in the liver in humans.Diabetes Care,2006,29(4):853-857.
16 Vionnet N,Hani EH,Dupont S,et al.Genomewide search for type 2 diabetes-susceptibility genes in French whites:evidence for a novel susceptibility locus for early-onset diabetes on chromosome 3q27-qter and independent replication of a type2-diabetes locus on chromosome 1q21-q24.Am JHum Genet,2000,67(6):1470 -1480.
17 Laughlin GA,Barrett-Connor E,May S,et al.Association of adiponectin with coronary heart disease and mortality:the Rancho Bernardo study.Am J Epidemiol,2007,165(2):164 -174.
18 Scherer PE.Adipose tissue:from lipid storage compartment to endocrine organ.Diabetes,2006,55(6):1537 -1545.
19 Kizer JR,Barzilay JI,Kuller LH,et al.Adiponectin and risk of coronary heart disease in older men and women.J Clin Endocrinol Metab,2008,93(9):3357 -3364.
20 蔡珂丹,闫 蕾,孙子林,等.2型糖尿病肾病患者血清脂联素水平的变化.肾脏病与透析肾移植杂志,2009,15(3):1-10.
21 Kanaya AM,Wassel Fyr C,Vittinghoff E,et al.Serum adiponectin and coronary heart disease risk in older Black and White Americans.J Clin Endocrinol Metab,2006,91(12):5044 -5050.
22 Maeda N,Shimomura I,Kishida K,et al.Diet-induced insulin resistance in mice lacking adiponectin/ACRP30.Nat Med,2002,8(7):731-737.
23 Lee MH,Klein RL,El-Shewy HM,et al.The adiponectin receptors AdipoR1 and AdipoR2 activate ERK1/2 through a Src/Rasdependent pathway and stimulate cell growth.Biochemistry,2008,47(44):11682-11692.
24 Mao X,Kikani CK,Riojas RA,et al.APPL1 binds to adiponectin receptors and mediates adiponectin signalling and function.Nat Cell Biol,2006,8(5):516 -523.
25 Looker HC,Krakoff J,Funahashi T,et al.Adiponectin concentrations are influenced by renal function and diabetes duration in Pima Indians with type 2 diabetes.J Clin Endocrinol Metab,2004,89(8):4010-4017.
26 Tsioufis C, Dimitriadis K, Chatzis D, et al. Relation of microalbuminuria to adiponectin and augmented C-reactive protein levels in men with essential hypertension.Am J Cardiol,2005,96(7):946-951.
27 Sharma K,Ramachandrarao S,Qiu G,et al.Adiponectin regulates albuminuria and podocyte function in mice.J Clin Invest,2008,118(5):1645-1656.
28 Albano E,Mottaran E,Occhino G,et al.Review article:role of oxidative stress in the progression of non-alcoholic steatosis.Aliment Pharmacol Ther,2005,22(Suppl 2):71 -73.
29 Ohashi K,Iwatani H,Kihara S,et al.Exacerbation of albuminuria and renal fibrosis in subtotal renal ablation model of adiponectin-knockout mice.Arterioscler Thromb Vasc Biol,2007,27(9):1910 -1917.
30 陈 燕,刘志红,陈慧梅,等.肥胖相关性肾病患者胰岛素抵抗状态评估指标的分析.肾脏病与透析肾移植杂志,2006,13(3):1-10.
31 Begriche K,Igoudjil A,Pessayre D,et al.Mitochondrial dysfunction in NASH:causes,consequences and possible means to prevent it.Mitochondrion,2006,6(1):1 -28.
32 Musso G,Gambino R,Durazzo M,et al.Adipokines in NASH:postprandial lipid metabolism as a link between adiponectin and liver disease.Hepatology,2005,42(5):1175 -1183.
33 Adachi MBrenner DA.High molecular weight adiponectin inhibits proliferation of hepatic stellate cells via activation of adenosine monophosphate-activated protein kinase.Hepatology,2008,47(2):677-685.
34 Carmiel-Haggai M,Cederbaum AI,Nieto N.A high-fat diet leads to the progression of non-alcoholic fatty liver disease in obese rats.Faseb J,2005,19(1):136 -138.
35 Carmona-Cuenca I,Roncero C,Sancho P,et al.Upregulation of the NADPH oxidase NOX4 by TGF-beta in hepatocytes is required for its pro-apoptotic activity.J Hepatol,2008,49(6):965 -976.
36 Kasinath BS,Feliers D,Sataranatarajan K,et al.Regulation of mRNA translation in renal physiology and disease.Am J Physiol Renal Physiol,2009,297(5):F1153 - F1165.
37 Kasinath BS,Mariappan MM,Sataranatarajan K,et al.mRNA translation:unexplored territory in renal science.J Am Soc Nephrol,2006,17(12):3281 -3292.
38 Viollet B,Foretz M,Guigas B,et al.Activation of AMP-activated protein kinase in the liver:a new strategy for the management of metabolic hepatic disorders.J Physiol,2006,574(Pt 1):41 -53.
39 Takekoshi K,Fukuhara M,Quin Z,et al.Long-term exercise stimulates adenosine monophosphate-activated protein kinase activity and subunit expression in rat visceral adipose tissue and liver.Metabolism,2006,55(8):1122 -1128.

