APP695-siRNA慢病毒载体构建及其对SH-SY5Y细胞中APP695基因的沉默作用*
温丽君,滕军放#,赵莘瑜,崔月梅,巴庆华,张爱玲
1)郑州大学第一附属医院神经内科郑州450052 2)郑州人民医院神经内科郑州450003
(2010-10-20收稿 责任编辑 赵秋民)
淀粉样肽前体蛋白(amyloid protin precursor,APP)基因位于21号染色体长臂,转录后mRNA经不同剪接方式编码得到695~770个氨基酸多肽,其主要形式为APP695、APP751和APP770,其中在人脑中主要是APP695[1]。3种APP都含有β-淀粉样肽(β-amyloid,Aβ)结构区,但是 APP75l和 APP770含有一个Kunitz型丝氨酸蛋白酶抑制因子的结构域,而APP695则没有。研究[2]表明,阿尔茨海默病(Alzheimer’s disease,AD)患者脑部基底核和蓝斑神经元中APP mRNA升高达2倍,并确认是由于APP695 mRNA的选择性升高所致。RNA干扰(RNA interference,RNAi)技术已经成为基因功能研究中非常重要的工具,为治疗神经系统退行性病变(如AD)提供了重要的手段[3-4]。而慢病毒载体介导的RNAi技术则可以提供长期的基因表达抑制,因此更适合于体内实验及临床研究的需要[5]。作者构建了针对APP695的siRNA慢病毒载体,并在人神经纤维母细胞瘤SH-SY5Y细胞中验证其沉默效率,为APP695的后续研究奠定基础。
1 材料与方法
1.1 材料与试剂 293T细胞、SH-SY5Y细胞、pFUGW-iRNA载体、2种辅助包装原件载体质粒(pHeper1.0、pHeper2.0)、寡核苷酸序列及引物(上海吉凯基因技术有限公司),Lipofectamine 2000以及RNA提取试剂盒(Invitrogen公司),大肠杆菌菌株DH5α、DMEM(GIBCO公司),胎牛血清(杭州四季青公司),胰蛋白酶(上海化学试剂公司),限制性内切酶HpaⅠ、XhoⅠ和T4 DNA连接酶(New England Biolabs公司);QIHPA IN Plasmid大抽试剂盒(荷兰Qiagen公司),M-MLV逆转录试剂盒(Promga公司),实时荧光定量PCR仪(FQ-RT-PCR,TaKaRa公司),实验设备由河南省医药科学研究所实验室提供。
1.2 靶向APP695基因siRNA的设计及合成 根据GenBank中人APP695基因核苷酸序列(NM_A33292.1),设计针对人APP695基因的siRNA靶序列 5’-CATGCACATGAATGTCCAG-3’,同时设计一段不与人其他cDNA序列同源的阴性对照序列5’-TTCTCCGAACGTGTCACGT-3’。再根据以上序列分别合成2对寡核苷酸序列,每对包含一条正义链和一条反义链,2对寡核苷酸序列退火产物均在5’端含HpaⅠ酶切残基,3’端含XhoⅠ酶切残基。
1.3 APP695-siRNA重组质粒的构建 pFU-GW-iRNA载体用HpaⅠ、XhoⅠ行双酶切,将酶切产物回收并和上述寡核苷酸退火后的产物混合,然后经T4 DNA连接酶于16℃连接过夜。连接后的重组质粒转化感受态大肠杆菌菌株DH5α,经含氨苄霉素抗性的LB琼脂培养基筛选后,挑取菌落并进行阳性克隆PCR鉴定,然后用QIHPA IN Plasmid大抽试剂盒抽提质粒并通过DNA测序进一步鉴定。
1.4 siRNA慢病毒颗粒的包装生产 293T细胞置于含体积分数为10%胎牛血清的DMEM培养液中,37℃、体积分数为5%CO2培养箱内培养。待细胞密度达 70% ~80%时,按 Invitrogen公司 Lipofectamine 2000说明书将慢病毒重组质粒分别与pHeper1.0、pHeper2.0 共感染293T 细胞,感染后8 h更换完全培养基,培养48 h后,收集富含慢病毒颗粒的细胞上清液,于4℃ 4 000 r/min离心10 min,取病毒上清液,以0.45μm滤器过滤后即得到重组慢病毒载体pAPP695-siRNA-LV和阴性对照载体pFU-siRNA-NC-LV,冻存于-80℃冰箱中备用。
1.5 细胞培养及感染 按1.3的方法培养 SHSY5Y细胞。感染前24 h接种于24孔板上,每孔接种5×104个细胞。将各孔细胞随机分为3组:未经病毒感染组(CON组,细胞不经过任何处理,正常生长),阴性对照病毒感染组(NC组,用 pFU-siRNANC-LV感染细胞),慢病毒介导阳性干扰组(APP695-siRNA组,用 pAPP695-siRNA-LV感染细胞)。每组均设3个复孔。
1.6 siRNA对 APP695 mRNA干扰效率的 FQRT-PCR检测 病毒感染72 h后,从24孔板中收集细胞,应用RNA提取试剂盒抽提总RNA,用逆转录试剂盒进行逆转录反应,然后用FQ-RT-PCR仪进行PCR扩增。采用Beacon designer 2软件设计actin和 APP695引物。APP695上游引物序列:5’-CTGATGCGGAGGAGGATGAC-3’,下游引物序列5’-TCTCTGTGGCTTCTTCGTAGG-3’;actin上游引物序列5’-GGCGGCACCACCATGTACCCT-3’,下游引物序列5’-AGGGGCCGGACTCGTCATACT-3’。PCR 反应条件:95℃预变性15 s,之后每一步95℃变性15 s,60℃退火延伸30 s,共进行45个循环。参考文献[6]计算各组细胞中APP695 mRNA的相对表达量。
1.7 统计学处理 采用SPSS17.0进行分析,应用单因素方差分析和LSD-t检验比较各组细胞中APP695 mRNA相对表达量的差异,检验水准α=0.05。
2 结果
2.1 重组质粒的PCR鉴定 见图1。结果表明目标片段已正确插入pFU-GW-iRNA质粒载体。
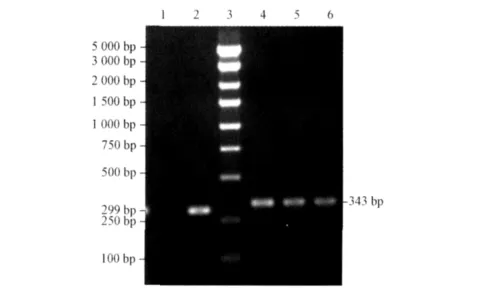
图1 慢病毒表达载体的PCR鉴定1:阴性对照;2:pFU-siRNA-NC-LV;3:Marker;4~6:pAPP695-siRNA-LV。
2.2 各组病毒感染效率 SH-SY5Y细胞感染病毒72 h后观察荧光,各组病毒感染效率均在70%左右。
2.3 siRNA对APP695 mRNA的干扰结果 干扰72 h后,APP695-siRNA组APP695 mRNA相对表达量(0.20 ±0.01)低于 CON 组(0.95 ±0.02)和 NC组(1.00 ±0.05),差异有统计学意义(F=554.442,P<0.001),CON组与NC组APP695 mRNA的相对表达量相比差异无统计学意义(P=0.112)。
3 讨论
质粒介导RNAi有一定的局限性,感染率低,基因抑制表达作用弱,持续时间短[7],而慢病毒载体是一种复制缺陷型逆转录病毒载体,以HIV-1为基础发展而得,具有许多优点,该载体不仅能够提供包装时所需要的蛋白成分和具有插入目的基因的多克隆位点的载体成分,同时,重组病毒是一类缺陷病毒,离开包装的细胞后病毒颗粒仅能转导细胞,但不能自我复制,这就为其安全性提供了更有效的保证[8]。慢病毒载体既能够感染分裂活跃期的细胞,又能高效率感染分裂缓慢或非分裂期的细胞,并且慢病毒RNAi作用持久,不易诱发宿主免疫反应,因此慢病毒载体是当前基因治疗载体研究的工具[9-10]。
作者成功构建了人APP695基因siRNA慢病毒载体,其可有效地沉默SH-SY5Y细胞中APP695基因表达,为进一步进行APP695基因的体内外研究奠定了基础。
[1]薛卫国.电针对APP转基因鼠脑Aβ水平及脑微血管病变影响的研究[D].北京:北京中医药大学,2010.
[2] Jazaq A,Ijichi H,Kanai F,et al.Smad4 silencing in pancreatic cancer cell lines using stable RNA interference and gene expression profiles induced by transforming growth factor-β[J].Oncogene,2005,24(4):662
[3]赵月莹,程肖蕊,周文霞,等.RNAi在神经退行性疾病发病机制及防治研究中的应用[J].国外医学:药学,2007,34(2):81
[4]胡海涛,董炜疆.阿尔茨海默病防治研究的现状与展望[J].西安交通大学学报:医学版,2007,28(1):1
[5] Kong Q.RNAi:a novel strategy for the treatment of prion diseases[J].JClin Invest,2006,116(12):3101
[6]刘玉涛,宋波,王亚仑,等.靶向ICP4的小干扰RNA对HSV-1病毒复制能力的影响[J].病毒学报,2010,26(3):163
[7]刘朝晖,杨宇,庄鹏辉,等.反转录病毒载体介导的EGFP基因在SK-N-SH神经母细胞瘤细胞中的表达[J].西安交通大学学报:医学版,2007,28(1):10
[8] Dissen GA,Lomniczi A,Neff TL,et al.In vivo manipulation of gene expression in non-human primates using lentiviral vectors as delivery vehicles[J].Methods,2009,49(1):70
[9] Morris KV,Rossi JJ.Lentiviral mediated delivery of siRNAs for antiviral therapy[J].Gene Ther,2006,13(6):553
[10]Warnock JN,Merten OW,Al-Rubeai M.Cell culture processes for the production of viral vectors for gene therapy purposes[J].Cytotechnology,2006,50(1/3):141

