壳聚糖纳米纤维支架对猪肝细胞分泌猪内源性逆转录病毒的影响
韩 冰 施晓雷 肖江强 张 悦 褚薛慧 顾劲扬 顾忠泽 丁义涛*
1(南京大学医学院附属鼓楼医院肝胆外科,南京 210008)
2(南京医科大学鼓楼临床学院肝胆外科,南京 210008)
3(东南大学生物电子学国家重点实验室,南京 210096)
引言
虽然肝移植目前被认为是急性肝功能衰竭和终末期肝病最有效的治疗方法,但供体器官的缺乏限制了其临床应用[1-2]。而生物人工肝(BAL)以其独特的生物替代作用被认为是等待肝移植患者的一项有效的暂时性肝脏支持治疗[3-4]。
目前,猪肝细胞因其充足的来源、方便的可获性以及与人肝细胞相似性仍然是BAL的主要细胞来源[5-7]。然而 BAL 的临床试验并不理想[4],所以如何利用合适的支架增强体外培养肝细胞的功能成为目前的研究热点。已有一些新型支架被报道具有增强肝细胞功能的作用,其中也包括本中心研发的壳聚糖纳米纤维支架[8-10]。
但作为异源性细胞,猪内源性逆转录病毒(porcine endogenous retrovirus,PERV)传播问题一直是猪肝细胞应用中不可忽视的安全问题。PERV发现于1971年并随后确认能体外感染多种人类细胞[11]。但新型支架对猪肝细胞的 PERV分泌量和感染性的影响并无研究报道。在以前的试验中已经证实壳聚糖纳米纤维支架能够增强肝细胞在体外的粘附性、存活性以及功能[12]。在此将进一步研究其对肝细胞的PERV分泌量和感染性产生的影响。
1 材料和方法
1.1 材料
体重介于15~20 kg的杂种大白猪购于南京大学医学院附属鼓楼医院动物中心。细胞培养相关的所有试剂均购于 GIBCO(USA)。实验所用壳聚糖(脱乙酰度88%)购自济南海得贝海洋生物工程有限公司,所有材料均为分析纯。
1.2 方法
1.2.1 壳聚糖纳米纤维电纺膜的制备
采用静电纺丝的方法制备壳聚糖纳米纤维电纺膜。首先制备壳聚糖溶液,溶质为质量比9∶1的壳聚糖与聚氧化乙烯粉末,溶剂为体积比7∶3的甲酸和无水乙醇混合液。在室温下配备质量分数为216%的溶液,并搅拌充分溶解。将配备好的溶液装入20 g针头的玻璃注射器内,在距针头10~20 cm处放置直径为24 mm的盖玻片收集纺丝。针头与玻片之间附加115 kV/cm的电场,在微量注射泵的推动下,壳聚糖溶液被均匀地喷射到盖玻片表面,形成壳聚糖纳米纤维电纺膜(Nano组)。空白玻片作为对照组(Hep组)。
1.2.2 肝细胞分离、鉴定和培养
原代肝细胞分离采用原位两部胶原酶灌注分离法[13-14]。首先通过门静脉向猪肝内灌入无 Ca2+和 Mg2+的 D-Hanks液,然后灌入 37℃ 预热的0.05% Ⅳ型胶原酶消化45 min,过滤收集细胞并离心洗涤3次。分离的猪肝细胞活性采用台盼蓝排除法确定存活细胞大于95%。通过形态学和免疫细胞化学分析(白蛋白及细胞角蛋白18)完成肝细胞鉴定。分离的肝细胞重悬于无血清 RPMI-1640培养液,以106cells/mL密度接种于铺有盖玻片的6孔板内培养。每日以低糖DMEM+10%FBS换液,连续7 d。每日收集的培养液和细胞存放于80℃备用。
1.2.3 逆转录聚合酶链式反应(RT-PCR)
将细胞培养培养液离心去除其中残留细胞及碎片,采用Trizol法(Invitrogen,US)提取总 RNA并用 DNase I(Invitrogen,U)处理,取OD 260/280介于1.6到 2.0的 RNA样本 60 ng,用 RT试剂盒(Biouniquer,China)逆转录成 cDNA,然后行 PCR。其中引物为 protease特异性引物(正向5'-GCTACAACCATTAGGAAAACTAAAAG-3';反向 5'-AACCAGGACTGTATATCTTGATCAG-3'),polymerase特异性引物 (正向 5'-CTACAACCATTAG GAAAACTAAAAG-3';反向 5'-AACCAGGACTGTAT ATCTTGATCAG-3'),猪 GAPDH特异性引物(正向5'-CATCACCATCTTCCAGGAG-3';反 向 5'-TGCCCACAGCCTTGGCAGC-3')。PCR 条 件 为50℃,30 min;95℃,5 min;94℃,30 s;55℃,45 s;72℃,30 s × 35 个循环,72℃ ,5 min[15-16]。扩增产物用2%琼脂糖电泳EB显影。
1.2.4 PERV特异性实时定量PCR
采用Roche SuperScript III platinium系统和MX3000P thermocycler(Stratagene)对上述 cDNA进行实时定量PCR,其中采用PERV protease特异性基因(GenBank accession number DQ845171)和猪特异性 β-actin基 因 (GenBank accession number DQ845171),分别设计引物 protease(正向 5'-GGACTTCGAGCAGGAGATGG-3';反 向 5'-AGG AAGGAGGGCTGGAAGAG-3')和 β-actin(正向 5'-GGACTTCGAGCAGGAGATGG-3';反 向 5'-AGGA AGGAGGGCTGGAAGAG-3')。PCR条件为95℃,10 min;95℃,15 s;60℃,1 min ×40个循环,95℃,1 min;65℃,30 s;95℃,30 s。采用 protease/βactin值表作为标准化PERV RNA表达量。
1.2.5 Western Blot分析
将收集细胞的裂解液进行 Western Blot分析。一抗采用1∶1 500稀释的与PERV gag p30蛋白交叉反应的 mouse anti-FeLV p27抗体(ABcam,San Francisco,US)4℃孵育过夜;二抗采用 1∶10 000稀释的辣根过氧化物酶偶联的goat anti-mouse IgG(KeyGEN,Nanjing,China)37℃孵育 1 h。胶片曝光并用软件ImageJ测定每条条带的亮度。
1.2.6 体外感染实验
依照文献中的方法进行细胞培养液的体外感染实验[17-18]。首先将 HEK293细胞接种于24孔板内过夜培养,然后换液加入离心去除游离细胞和细胞碎片的肝细胞培养液及8 mg/mL聚凝胺孵育6 h。同时采用PK15上清液孵育 HEK293细胞作为阳性对照。6 h后移除孵育液并用PBS洗涤细胞两遍,然后采用含10%FBS的DMEM-HG培养液传代培养1个月收集细胞。
1.2.7 DNA提取和PCR
采用 DNA提取试剂盒(Axygen,California,US)提取 HEK293细胞总 DNA。用人 β-actin引物(正向 5'-GCTCGTCGTCGACAACGGCTC-3',反向 5'-CAAACATGATCTGGGTCATCTTCTC-3')(KeyGEN,Nanjing,China)、猪细胞色素 B((SsCytB)引物(正向 5'-CATTGGAGTAGTCCTACTATTTACCG-3',反向5'-GTAGGATTAGTATTATAAATAAGGCTCCT-3')[19]以及上述PERV特异性protease引物和polymerase引物,PCR及结果观测条件同上。
1.2.8 逆转录酶(RT)活性测定
分别利用C型逆转录酶活性测定试剂盒(Cavidi-Tech,Uppsala,Sweden)的定量和定性法测定肝细胞和HEK293细胞培养液的RT活性。
1.2.9 统计方法
所有试验均重复5次。数值采用平均值±标准差表示,并采用 Student t检验比较两组差异,P<0.05认为有统计学差异。
2 结果
2.1 肝细胞上清液中的PERV RNA
RT-PCR产物电泳结果见图1(a)和图1(b),可见两端 PERV特异性序列protease和polymerase具有相似的变化趋势。实时定量PCR中以protease/β-actin的比值表示标准化的PERV RNA水平,结果绘制于图1(c)。可见猪肝细胞在10 h和第2 d各有一个PERV RNA分泌高峰,第2 d后逐渐下降。实验组和对照组于第6 d和第5 d后无PERV分泌。除第6 dPERV RNA水平具有统计学差异外,其余各天均无差异。
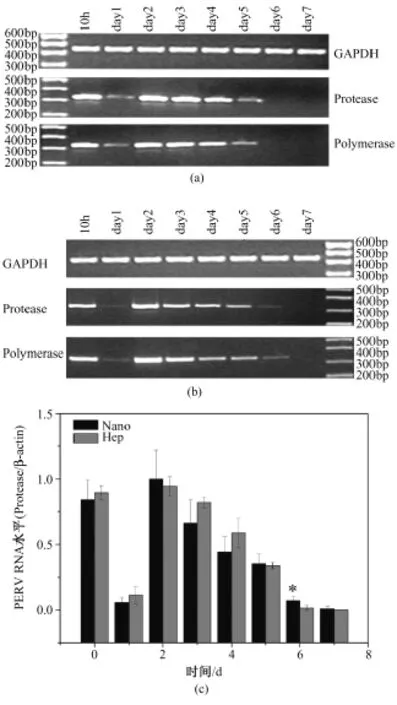
图1 培养液中的PERV RNA。(a)和(b)分别为实验组和对照组RT-PCR的结果例图;(c)为实时定量PCR的结果(“*”表示P<0.05)Fig.1 PERV RNA in the supernatants.(a)and(b)the representative results of RT-PCR electrophoresis with the RNA extracted from the supernatantsin Hep group and Nano group,respectively;(c)the results of real time PCR(* P<0.05)
2.2 PERV壳体蛋白gag p30表达水平
图2中(a)和(b)分别表示 western blot结果样图以及 ImageJ软件对条带亮度测定的结果。和RNA分泌情况相似,gag蛋白表达在10 h和第2 d存在两个高峰,然后呈下降趋势。实验组和对照组的gag蛋白表达分别消失于第5 d和第4 d,仅第5 d两组间具有统计学差异。
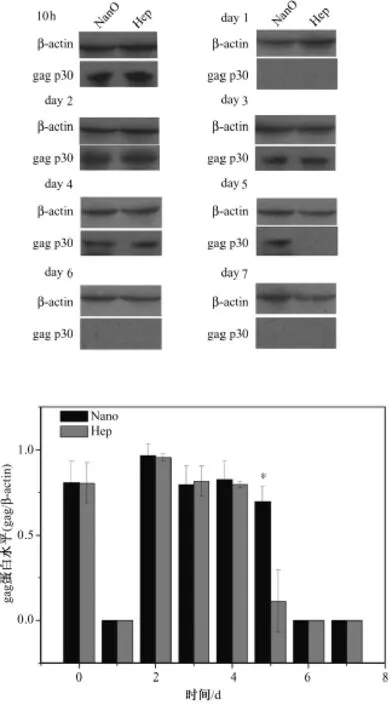
图2 细胞裂解液中的PERV gag p30蛋白检测。(a)western blot结果例图;(b)ImageJ测量下的标准化蛋白量(“*”表示P<0.05)Fig.2 Western blot of the PERV gag protein in the cell lysates.(a)representative results of western blot with the cell lysates in both groups;(b)the normalized protein amount in different days(*P<0.05)
2.3 肝细胞上清液RT活性
所有培养液样本的RT活性测定均重复一次,取平均值。图3为猪肝细胞培养上清液RT活性变化,可以看出其同样存在10 h和第2 d的高峰,但各天的RT活性经比较均无明显差异。
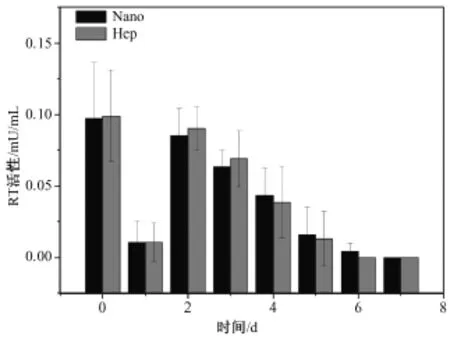
图3 猪肝细胞培养液RT活性定量测定结果Fig.3 RT activity ofthe cultured porcine hepatocytes on different substrata
2.4 HEK293细胞体外感染情况
PCR结果显示,HEK293细胞DNA中并未发现PERV特异性的protease和 polymerase序列,也没有查出猪特异性SsCytB序列(见图4)。RT活性测定结果显示处理后的HEK293细胞的培养液RT活性全为阴性。
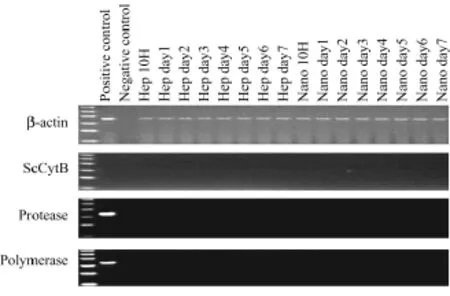
图4 体外感染实验中HEK293细胞DNA PCR检测结果例图(C+:PK15感染的HEK293细胞;C-:纯水。DNA Ladder为100~600 bp)Fig.4 Representative results of PCR electrophoresis with the DNA extracted from HEK293 cells of in vitro infection experiments(C+,PERV-infected HEK-293 cells;C-,pure water.The ladder ranged from 100 bp to 600bp.“Hep” and“Nano” meant the incubating supernatant from the simple culture of hepatocytes and the hepatocyte culture on chitosan nanofiber scaffolds)
3 讨论
目前,猪肝细胞仍是生物人工肝的主要细胞来源[5-7]。目前已有一些报道就如何依靠支架提高肝细胞体外培养的功能作出了探索[8-10]。良好的生物兼容性使壳聚糖支架收受到广泛关注[20-21],本研究已证实壳聚糖纳米支架能够有效地提高肝细胞的附着性、生物兼容性,以及有效改善其体外培养功能[10]。然而,也有学者对纳米材料的安全性提出质疑[22],本研究从支架对病毒分泌及感染性的影响方面对其安全性进行了研究。
1971年,Amstrong等首次从 PK15细胞中分离出 PERV[23]。1997 年,Patience发现 PK15 细胞释放的PERV能够在体外感染 HEK293细胞[24]。随后的研究发现PERV广泛存在于各种猪系的基因组中,而且各种猪细胞均能分泌PERV颗粒[11]。同时发现PERV可在体外感染多种人类细胞,如内皮细胞、成纤维细胞、骨髓干细胞等[25-30]。Nyberg 等报道新鲜分离的猪肝细胞能够分泌PERV,但是并不能在体外感染 HEK293细胞,而且猪肝细胞的PERV分泌量及感染性并不受肝功能肝衰竭血清影响[17]。
本研究旨在探讨壳聚糖纳米纤维支架对猪肝细胞PERV分泌量和感染性的影响。采用了RTPCR和RT活性测定检测培养液中的PERV RNA和RT活性,western blot检测细胞表达PERV壳体蛋白gag p30的水平。目前,RT-PCR仍然是检测 PERV最敏感最特异的检测方法[11]。RT活性已证明与逆转录病毒颗粒量有一定联系[31],本研究检测到的低RT活性同时提示猪肝细胞释放入上清液中的PERV颗粒较少。此外,以前的报道多是采用蔗糖密度梯度离心从培养液中聚集 PERV,然后通过westernblot定性检测 PERV壳体蛋白 gag p30[32-33]。但这种浓缩的 PERV并不适用于定量或半定量分析蛋白表达量,因为它不能够通过内参蛋白标准化。所以我们先尝试了直接采用上清液行western blot,但是因为病毒量太少检测不出。又选择细胞裂解液作为上样标本以间接的检测病毒蛋白在细胞内表达的水平,以此来反映病毒的复制水平。
本研究中,实时定量 PCR、RT活性测定和western blot结果都显示了相似的变化趋势,这也表明了猪肝细胞表达分泌PERV的变化。在蛋白测定中,可以看出蛋白的表达检测不出比RNA测定提前一天,这可能是因为蛋白表达量太少而western blot检测本身的灵敏性不高所致。结果显示PERV的表达分泌存在10 h和第2 d两个高峰,然后逐渐下降,但在前5 d内其RNA和RT活性均无明显差异。结果中的第1个分泌高峰可能是新鲜分离的猪肝细胞分泌PERV以及未贴壁细胞破裂释放PERV的结果,本研究选择10 h作为第1个检测时间点以此减少破裂细胞对结果产生的影响。而第2分泌高峰应该是 PERV的真实分泌高峰。此外,实验组中PERV RNA和蛋白均比对照组迟一天消失,这说明该支架能够延长病毒的分泌时间,这可能跟该支架能够更好的保持细胞粘附性及活性有关[12,34]。
PERV感染性的变化是猪肝细胞应用中最重要的问题。Nyberg等研究表明猪肝细胞释放的PERV并不能在体外感染HEK293细胞,且这种低感染性不受肝衰血清的影响[17]。同样,本研究也发现HEK293细胞在经过猪肝细胞培养液孵育后并未检出PERV和SsCytB基因序列,同时RT活性也为阴性。这表明并无 HEK293细胞感染 PERV,也没有微嵌合形式的存在。此结果显示了壳聚糖纳米纤维支架对猪肝细胞分泌的PERV的感染性并无影响。
4 结论
综上,猪肝细胞在普通条件下可表达分泌PERV持续5 d,而在壳聚糖纳米纤维支架上可延长分泌至第6 d。但是,猪肝细胞PERV的表达量和感染性并不会受壳聚糖纳米纤维支架影响。该支架可安全地应用于BAL系统。
[1]Lee WM,Squires RH,Jr.,Nyberg SL,et al.Acute liver failure:Summary of a workshop [J].Hepatology,2008,47(4):1401-1415.
[2]Riordan SM,Williams R.Perspectives on liver failure:past and future[J].Semin Liver Dis,2008,28(2):137 -141.
[3]Gerlach JC, ZeilingerK, PatzerIiJF. Bioartificialliver systems:why,what,whither?[J].Regen Med,2008,3(4):575-595.
[4]McKenzie TJ, Lillegard JB, Nyberg SL. Artificialand bioartificial liver support[J].Semin Liver Dis,2008,28(2):210-217.
[5]Chamuleau RA,Deurholt T,Hoekstra R.Which are the right cells to be used in a bioartificial liver?[J].Metab Brain Dis,2005,20(4):327-335.
[6]Tsiaoussis J,Newsome PN,Nelson LJ,et al.Which hepatocyte will it be?Hepatocyte choice for bioartificial liver support systems[J].Liver Transpl,2001,7(1):2 -10.
[7]Kobayashi N,Okitsu T,Tanaka N.Cell choice for bioartificial livers[J].Keio J Med,2003,52(3):151 -157.
[8]Hochleitner B,Hengster P, Bucher H, et al. Significant survival prolongation in pigs with fulminanthepatic failure treated with a novel microgravity-based bioartificial liver[J].Artif Organs,2006,30(12):906 -914.
[9]Hochleitner B,Hengster P,Duo L,et al.A novel bioartificial liverwith culture ofporcine hepatocyte aggregates under simulated microgravity[J].Artif Organs,2005,29(1):58 -66.
[10]褚薛慧,施晓雷,顾劲扬,冯章启,顾忠泽,丁义涛.壳聚糖纳米纤维电纺膜体外对肝细胞作用的研究[J].中国生物医学工程学报,2010,29(1):144-149.
[11]Wilson CA. Porcine endogenous retroviruses and xenotransplantation[J].Cell Mol Life Sci,2008,65(21):3399-3412.
[12]Chu Xuehui, Shi Xiaolei, Feng Zhangqi, et al. Chitosan nanofiber scaffold enhances hepatocyte adhesion and function[J].Biotechnol Lett,2009,31(3):347 -352.
[13]Gu Jinyang,Shi Xiaolei,Zhang Yue,et al.Establishment of a three-dimensional co-culture system by porcine hepatocytes and bone marrow mesenchymal stem cells in vitro.Hepatol Res,2009,39(4):398-407.
[14]Gu Jinyang, ShiXiaolei, ZhangYue, etal. Heterotypic interactions in the preservation of morphology and functionality of porcine hepatocytes by bone marrow mesenchymal stem cells in vitro[J].J Cell Physiol,2009,219(1):100 - 108.
[15]Moscoso I,Hermida-Prieto M,Manez R,et al.Lack of crossspecies transmission of porcine endogenous retrovirus in pig-tobaboon xenotransplantation with sustained depletion of antialphagal antibodies[J].Transplantation,2005,79(7):777 -782.
[16]van de Kerkhove MP, Germans MR, Deurholt T, et al.Evidence for Galalpha(1-3)Gal expression on primary porcine hepatocytes:implications for bioartificial liver systems[J].J Hepatol,2005,42(4):541 -547.
[17]Nyberg SL,Hibbs JR,Hardin JA,et al.Influence of human fulminant hepatic failure sera on endogenous retroviral expression in pig hepatocytes[J].Liver Transpl,2000,6(1):76 - 84.
[18]Kuddus R,Patzer JF,2nd,Lopez R,et al.Clinical and laboratory evaluation of the safety of a bioartificial liver assist device for potential transmission of porcine endogenous retrovirus[J].Transplantation,2002,73(3):420-429.
[19]Blusch JH,Roos C,Nitschko H.A polymerase chain reactionbased protocol for the detection of transmission of pig endogenous retroviruses in pig to human xenotransplantation [J].Transplantation,2000,69(10):2167-2172.
[20]孔祥烨,郑静,王晓军,等.壳聚糖在组织工程中的应用[J].中国医学工程,2009,17(3):185-188.
[21]孙晓春,蔡花,许文荣,等.脐带间质干细胞与壳聚糖支架的生物相容性研究[J].中国生物医学工程学报,2010,29(3):464-467.
[22]吴秋云 唐,谢彦昕,石亚娟,杨红.不同粒径纳米二氧化硅的体外细胞膜毒性作用[J].中国生物医学工程学报,2010,29(3):438-445.
[23]Armstrong JA,Porterfield JS,De Madrid AT.C-type virus particles in pig kidney cell lines [J].J Gen Virol,1971,10(2):195-198.
[24]Patience C,Takeuchi Y,Weiss RA.Infection of human cells by an endogenous retrovirus of pigs[J].Nat Med,1997,3(3):282-286.
[25]Martin U,Kiessig V,Blusch JH,et al.Expression of pig endogenous retrovirus by primary porcine endothelial cells and infection of human cells[J].Lancet,1998,352(9129):692-694.
[26]Takeuchi Y,Patience C,Magre S,et al.Host range and interference studies of three classes of pig endogenous retrovirus[J].J Virol,1998,72(12):9986 -9991.
[27]Wilson CA,Wong S,Muller J,et al.Type C retrovirus released from porcine primary peripheral blood mononuclear cells infects human cells[J].J Virol,1998,72(4):3082 -3087.
[28]Martin U,Winkler ME,Id M,et al.Productive infection of primary human endothelial cells by pig endogenous retrovirus(PERV)[J].Xenotransplantation,2000,7(2):138-142.
[29]Wilson CA,Wong S,VanBrocklin M,et al.Extended analysis of the in vitro tropism of porcine endogenous retrovirus[J].J Virol,2000,74(1):49 -56.
[30]Specke V,Rubant S,Denner J.Productive infection of human primary cells and cell lines with porcine endogenous retroviruses.Virology,2001,285(2):177-180.
[31]Pyra H,Boni J,Schupbach J.Ultrasensitive retrovirus detection by a reverse transcriptase assay based on product enhancement[J].Proc Natl Acad Sci USA,1994,91(4):1544-1548.
[32]Czauderna F,Fischer N,Boller K,et al.Establishment and characterization ofmolecularclonesofporcine endogenous retroviruses replicating on human cells[J].J Virol,2000,74(9):4028-4038.
[33]Galbraith DN,Kelly HT,Dyke A,et al.Design and validation of immunological tests for the detection of Porcine endogenous retrovirus in biological materials [J].J Virol Methods,2000,90(2):115-124.
[34]Chu Xuihui, ShiXiaolei, FengZhangqi, etal. In vitro evaluation ofa multi-layerradial-flow bioreactorbased on galactosylated chitosan nanofiber scaffolds [J].Biomaterial,2009,30(27):4533-4538.
——猪肝泥

