电穿孔过程中细胞膜电导率变化条件下的跨膜电压研究
李成祥 孙才新 姚陈果 米 彦 周 玮 熊正爱
1(重庆大学输配电装备及系统安全与新技术国家重点实验室,重庆 400030)
2(重庆医科大学附属第二医院,重庆 400061)
引言
美国学者James C.Weaver等研究发现,在一定剂量(场强为 kV/cm级、脉宽为 μs级)的脉冲电场作用下,当细胞膜两侧所承受的跨膜电压超过其绝缘强度时,膜上将出现的一些被称为“微孔”的暂时性亲水性通道[1-2]。此时,细胞膜的渗透性将大大增强,电导率亦随之激增。脉冲电场取消后,大多数情况下微孔会关闭而不会对细胞造成任何影响,这种细胞膜出现暂时微孔的物理过程称为可逆电穿孔(reversible electroporation,RE)。若脉冲电场剂量较大,细胞膜会出现不可恢复的破裂而导致细胞死亡,这就是不可逆电穿孔 (irreversible electroporation,IRE)[3-5]。目前,RE 已广泛用于生物技术、基因工程和临床医学等许多领域[5-7],而IRE则以其独特的优势和疗效开始应用于肿瘤的临床治疗[8-9]。
与应用研究相比,微秒脉冲电场电穿孔效应的机理研究相对滞后。现有的机理研究大多围绕细胞外膜(细胞膜)和内膜(细胞器膜)的跨膜电压而展开。Tadej建立了球形单细胞三层介电模型[10-11],推导了不同波形脉冲电场作用下细胞外膜跨膜电压的计算公式。Schoenbach等在Tadej模型基础上,建立了脉冲电场与细胞相耦合的球形单细胞电路模型,解释了高强度窄脉冲电场作用于胞内细胞器并产生胞内电处理效应的机理[12]。Yao等建立了考虑细胞核并适用于全频段分析的球形单细胞五层电场模型,研究了细胞内外膜跨膜电压的频率响应特性,提出了全频段脉冲电场的窗口效应理论[13-14]。Yao等认为微秒脉冲电场含有较多的低频分量,其主要作用靶点为细胞外膜,难以透入细胞而对胞内的线粒体及细胞核等细胞器产生影响;只有当脉冲宽度减少至纳秒甚至皮秒级时,脉冲电场的靶点才会跨过细胞外膜而作用于胞内细胞器并最终导致细胞发生凋亡[13-16]。
然而,上述研究均忽略了电穿孔过程中细胞各组成部分电参数的变化,即假设包括膜电导率在内的电参数在外加脉冲电场作用过程中保持恒定,并以此为基础展开研究。事实上,电穿孔过程中,由于微孔的出现,细胞膜的通透能力大大增强,其屏障功能减弱或失去,电导率随之激增,此外,随着孔洞尺寸的增大和数量的增多,电导率亦会不断增大[17]。而细胞膜的电导率一旦发生改变,必然会导致脉冲电场诱导的细胞内外膜的跨膜电压发生变化。跨膜电压的这种变化是否可以忽略,这种变化是否会影响甚至改变微秒脉冲电场的生物学效应,迄今尚无定量研究,而这些问题正是微秒脉冲电场生物学效应机理研究中所必须回答的问题。
为此,本研究基于目前广泛采用的经典球形单细胞五层介电模型[13,15,16],仿真分析穿孔过程中由于细胞膜电导率的变化而导致的细胞内外膜跨膜电压的变化规律,并由此探讨穿孔过程中细胞膜电导率的变化对微秒脉冲电场生物学效应的影响。最后,通过宫颈癌系 Hela的细胞实验,验证理论分析的正确性。
1 材料与方法
1.1 细胞模型及内外膜跨膜电压的仿真计算
1.1.1 细胞模型
仿真计算中采用经典球形单细胞五层介电模型,如图1所示。图中,E(t)为外加电场,箭头方向为电场方向;Rc和Rn分别为细胞及细胞核的半径;dm和dn分别为细胞膜及细胞核膜的厚度;γnc、γnm、γc、γm、γo分别为核质、核膜、细胞质、细胞膜和细胞外介质的电导率;εnc、εnm、εc、εm、εo分别为核质、核膜、细胞质、细胞膜和细胞介质的介电常数;θ为极轴方向和外加电场方向的夹角。假设球心为零电位。
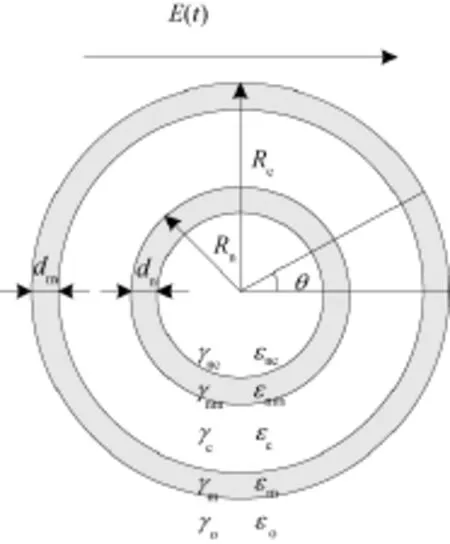
图1 球形单细胞五层介电模型Fig.1 Multilayer dielectric model of spherical cell
1.1.2 细胞内外膜的跨膜电压
当外加时变电场E(t)作用于细胞悬液时,流过细胞各部分的电流由传导电流和位移电流两部分组成。根据全电流定律[18],有
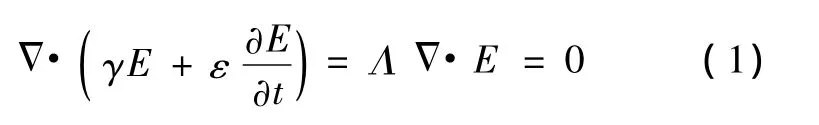
式中,

假设细胞上任意一点的电位为φ,则电场强度与电位有如下关系:

由于微分算子的引入将使时域中跨膜电压的计算过程变得极为复杂。为简化计算,对式(1)~式(3)进行拉普拉斯变换,得到如下复频域方程:
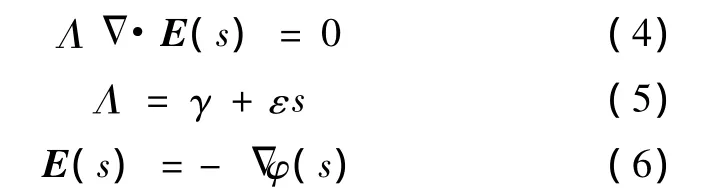
以球心为原点建立球坐标系(r,θ,α),联立式(4)~式(6),结合细胞五层介电模型各层分界面上电位连续和电流密度法向量连续的边界条件,即可解得细胞内、外膜的跨膜电压。本研究仅选择θ=0处细胞膜和细胞器膜的跨膜电压进行分析。
1.1.3 跨膜电压的仿真计算
细胞各部分的化学成分极为复杂,各部分的电参数有较大差异,同时,不同种类细胞的电参数也存在一定差异。为使仿真具有一般性,选择国内外文献[13-16]中细胞参数的典型值作为仿真参数,如表1所示。

表1 细胞典型电参数Tab.1 Typical cell parameters
细胞膜发生电穿孔前,通常设定其电导率为1×10-5S/m,而当发生穿孔即细胞膜上出现孔洞后,细胞膜的电导率将会增大,且其增幅与孔的尺寸和数量有关,文献[17]曾报道当细胞膜出现“孔洞”时,其电导率可激增几倍甚至数十倍。因此,考虑选用3×10-4S/m(穿孔前的30倍)作为穿孔达一定程度时的细胞膜电导率,并由此来模拟分析穿孔过程中电导率的增加对细胞内、外膜跨膜电压的影响。
1.2 细胞实验
1.2.1 细胞培养
实验用细胞系为人宫颈癌细胞Hela(由重庆医科大学超声工程研究所提供),贴壁生长,以RPMI1640培养基培养,培养液中含有10%的标准胎牛血清,置于37℃、5%CO2细胞培养箱内培养,2~3 d传代一次。取处于对数生长期的Hela细胞,用0.25%的胰蛋白酶消化培养瓶内细胞,置10 mL离心管中,1 000 r/min离心5 min,弃去上清,用PBS平衡液洗涤2~3次,重悬细胞,调整浓度为2×106/mL,分装在1.8 mL的EP管内备用。以上细胞培养过程中所用培养基、血清及 PBS平衡液均为美国Hyclone公司产品,胰蛋白酶为美国 GIBCO公司产品。
1.2.2 脉冲电场处理
实验装置为重庆大学输配电装备与系统安全及新技术国家重点实验室自行开发、研制的微秒脉冲发生器。该发生器输出脉冲电压峰值可达3 kV,上升时间为 ns级,脉宽为 μs级,重复频率1~100 Hz,电压峰值、脉冲宽度和重复频率在取值范围内任意可调。实验时,将不可逆电穿孔肿瘤治疗仪的输出端与电极杯(美国BIO-RAD伯乐公司,电极间距为0.4 cm)的两电极相连,输出方波脉冲电场至Hela细胞悬液。
1.2.3 细胞凋亡的检测
将实验分成8组,未施加脉冲电场的1组细胞悬液,为空白对照组。参照电穿孔脉冲电场的常规剂量[19],其余 7组分别施加重复频率 1 Hz、脉宽100 μs的 8个电场脉冲,场强依次为 750、1 000、1 250、1 500、1 750、2 000、2 250 V/cm。各实验组分别于处理后2 h加入Annexi V-FITC和PI(凋亡试剂盒购于美国BIO-RAD伯乐公司),孵育10 min后送流式细胞仪。以FITC和PI荧光做双参数点图,将细胞分为四种:机械损伤细胞(Annexin V-/PI+)、正常细胞(Annexin V-/PI-)、早期凋亡细胞(Annexin V+/PI-)和晚期凋亡与坏死细胞(Annexin V+/PI+)。
1.2.4 统计学分析
2 结果
2.1 细胞内外膜跨膜电压的仿真结果
根据前述模型和仿真参数,基于 Matlab软件(美国Mathworks公司)编写相应程序,选择脉冲宽度为1 μs、幅值为1 000 V/cm的微秒方波脉冲电场作为外加电场进行仿真。两种不同细胞膜电导率下,细胞内外膜的跨膜电压波形如图2所示。
由图2可见,在微秒脉冲电场作用过程中及作用后,两种情况下内外膜跨膜电压的变化趋势大致相同。外膜跨膜电压都经历一个由0增至最大值再减小到0的过程。内膜跨膜电压的变化较为复杂,脉冲电场作用后的短时间内,内膜跨膜电压迅速增大至最大值,随后缓慢减小并维持在某一大于0的数值。脉冲电场撤消瞬间,内膜上的跨膜电压迅速反向,然后该数值为负的内膜跨膜电压再缓慢变化至0。
然而,两种情况下,跨膜电压的数值以及内、外膜跨膜电压的相对大小有显著差异。当细胞膜电导率为1×10-5S/m时(图2(a)),外膜跨膜电压的最大值约1.3 V,内膜上正向和反向跨膜电压的最大值分别为0.6 V及-0.5 V,而当细胞膜电导率为3×10-4S/m时(图 2(b)),以上三个数值分别为0.4 V、0.62 V及 -0.1 V。特别是,当细胞膜电导率为1×10-5S/m时,即未发生穿孔时,除了脉冲电场作用初期的约0.2 μs之外,外膜的跨膜电压均明显大于内膜;而当细胞膜电导率增加至3×10-4S/m,即细胞膜上出现一定数量的“孔洞”后,在脉冲电场作用的整个1 μs内,内膜电压的数值始终大于外膜。
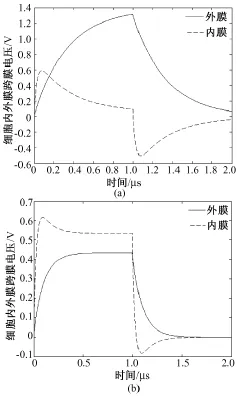
图2 脉冲电场诱导的细胞内外膜跨膜电压。(a)细胞膜电导率1×10-5S/m;(b)细胞膜电导率3×10-4S/mFig.2 Transmembrane voltages induced by pulsed electric field for variations of membrane conductivity.(a)1 × 10-5S/m;(b)3 ×10-4 S/m
电穿孔程度不同,细胞膜电导率的大小有所差异。为进一步直观反映不同程度的电穿孔对细胞内外膜跨膜电压的影响,考虑不同大小的细胞膜电导率,按前述方法计算跨膜电压,得到的细胞内、外膜跨膜电压的幅值之比如图3所示。可见,随着细胞膜电导率增加,即随着穿孔程度加剧,内、外膜跨膜电压的比值持续增加,且当细胞膜电导率大于1.8×10-4S/m 后,该比值大于1。
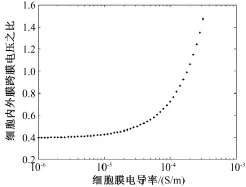
图3 内、外膜跨膜电压的比值与细胞膜电导率的关系Fig.3 Ratios between internal and external transmembrane voltage vs.membrane conductivities
2.2 细胞实验结果
连接素Annexin V是一种相对分子质量为35~36 kD的Ca2+依赖性磷脂结合蛋白,能与细胞凋亡时翻转到膜外的PS(正常细胞的PS处于膜内)高亲和力特异性结合。标记了异硫氰酸荧光素(FITC)的Annexin V可与凋亡细胞膜外的PS特异性结合而出现绿色荧光,但是单靠Annexin V-FITC无法区分凋亡细胞和细胞结构已被破坏的坏死细胞。因此,还需结合能分辨细胞膜完整性的荧光染料PI。
根据流式细胞术检测的结果,得到如表2所示的统计数据。可见,随外加脉冲电场场强的增加,即随着电穿孔程度的不断增加,各实验组细胞的早期凋亡比例随之增大。从1 250 V/cm实验组开始,与对照组相比,处理组的凋亡率出现显著性差异(P<0.05),且1 500 V/cm实验组的凋亡率与对照组和750 V/cm、1 000 V/cm实验组均有统计学差异。然而,当进一步增加场强,伴随着凋亡率增加的同时,坏死细胞比例亦明显增加。

表2 脉冲电场致Hela细胞凋亡与坏死的统计数据Tab.2 Apoptosis statistical data by flow cytometry
3 讨论
由前述的仿真分析可见,随着细胞膜电导率增加,即随着穿孔程度加剧,内、外膜跨膜电压的比值持续增加,且当细胞膜电导率大于1.8×10-4S/m后,该比值大于1。由此可知,随着细胞穿孔程度加剧,外加脉冲电场对胞内细胞器膜的作用相对不断增强,而对外膜(细胞膜)的作用则不断减弱,即外加脉冲电场作用靶点逐渐由细胞外膜移到细胞内膜,而这与现有研究认为微秒脉冲难以透入细胞而对细胞器产生作用的观点不一致[13-16]。
为验证理论分析的正确性,基于以下思路设计并开展了细胞实验。前期研究已经证实[2,20],细胞电穿孔的程度与外加脉冲电场的场强呈正相关,而穿孔程度的增加又会导致细胞膜电导率增大。因此,通过施加不同强度的脉冲电场,就可以模拟细胞膜电导率变化的情形。同时,前期研究也表明[12-14],当外加脉冲电场对细胞内膜跨膜电压的作用增强至一定程度时,将会使细胞器膜出现不可逆性过度开放并产生相应的生物学效应。例如,线粒体膜的不可逆性过度开放,将会导致线粒体基质渗透压不断升高,释放出促凋亡蛋白,从而增大细胞发生凋亡的可能性。因此,前述细胞实验对于细胞凋亡率的检测结果,可以说明外加脉冲电场对细胞内膜的作用,从而在一定程度上反映穿孔过程中电导率变化对细胞内外膜跨膜电压的不同影响。
细胞实验结果显示,随外加脉冲电场场强的增加,即伴随着细胞膜电导率的增加,各处理组细胞的早期凋亡率不断增大。由此说明,在电穿孔过程中,随着穿孔程度的不断加剧,脉冲电场的作用靶点由细胞外膜逐渐转移到细胞内膜,与仿真分析的结论一致。
此外,值得注意的是,随着外加脉冲电场场强的增大,伴随着凋亡率增加的同时,晚期凋亡和坏死细胞的比例逐渐增加。推测其原因,可能是当外加脉冲电场强度继续增加,外膜上孔洞大小将超过一定尺寸而无法愈合,即发生不可逆电穿孔现象,胞外基质以及其他分子涌入细胞内,最终导致细胞崩解坏死。
4 结语
考虑电穿孔过程中细胞膜电导率的变化,基于球形单细胞五层介电模型,对微秒脉冲电场作用下细胞内外膜的跨膜电压进行了仿真研究。研究发现,随着细胞穿孔程度加剧,细胞膜电导率不断增加,导致脉冲电场对内膜的作用不断增强,即微秒脉冲电场的作用靶点透过细胞外膜而进入了胞内细胞器。同时,以人宫颈癌细胞系Hela为对象的细胞实验验证了仿真分析的结果。
现有研究大多认为,微秒脉冲电场的生物学效应主要表现为细胞膜的电穿孔现象;而凋亡现象则是脉宽更小的纳秒级脉冲电场所独有的生物学效应。本研究考虑了穿孔过程中细胞膜电导率的变化,仿真发现并用实验证实了微秒脉冲电场对胞内细胞器的作用以及由此引发的细胞凋亡现象,在一定程度上丰富并拓展了现有的脉冲电场的生物学效应理论。
需要注意的是,本研究采用了比较多的简化条件,如假设细胞各部分均为简单理想的均一介质,穿孔后整个细胞膜的电导率均匀增加,等等。而事实上,细胞各部分的组成极为复杂,绝非均一介质,而穿孔后细胞膜上的孔洞分布不均匀,膜上各处电导率的增加亦不一致。因此,为更加准确地描述电穿孔过程中电导率变化所造成的影响尚需建立更为详细的模型。
[1]ChenC, Smye SW, Robinson MP, etal. Membrane electroporation theories:a review[J].Medical and Biological Engineering and Computing,2006,44(1):5-14.
[2]Weaver JC,Chizmadzhev YA.Theory of electroporation:a review [J].Bioelectrochemistry and Bioenergetics,1996,41(2):135-160.
[3]Weaver JC.Electroporation of cells and tissues[J].IEEE Transactions on Plasma Science,2000,28(1):24-33.
[4]Zimmermann U, Friedrich U, Mussauer H, et al.Electromanipulation ofmammalian cells:fundamentalsand application [J].IEEE Transactions on Plasma Science,2000,28(1):72-82.
[5]WeaverJC. Electroporation ofbiologicalmembranes from multicellular to nano scales[J]. IEEE Transactions on Dielectrics and Electrical Insulation,2003,10(5):754 -768.
[6]Michel M,Gregor S,Jean RG,et al.Electro-chemotherapy-an easy,highly effective and safe treatment of cutaneous and subcutaneous metastases:Results of ESOPE(European Standard Operating Procedures ofElectrochemotherapy)study [J].European Journal of Cancer Supplements,2006,11(4):3 -13.
[7]Gregor S,Maja C,Damijan M,et al.Electrochemotherapy of tumours.Radiol Oncol,2006,40(3):163 -174.
[8]Boris R. Irreversible electroporation in medicine [J].Technology in Cancer Research and Treatment,2007,6(4):255-259.
[9]Boris R.Irreversible electroporation[M].New York:Springer.2009:249-254.
[10]Tadej K,Damijan M,Tomaz S.Time course of transmembrane voltage induced by time-varying electric fields-a method for theoretical analysis and its application[J].Bioelectrochemistry and Bioenergetics,1998,45(1):3 -16.
[11]Tadej K,Feda B,Damijian M.Sensitivity of transmembrane voltage induced by applied electric fields-a theoretical analysis[J].Bioelectrochemistry and Bioenergetics,1997,43(2):285-291.
[12]Schoenbach KH,Katsuki S,Stark RH,et al.Bioelectrics-new applications for pulsed power technology [J]. IEEE Transactions on Plasma Science,2002,30(1):293 -300.
[13]Yao Chenguo,Hu Xiaoqian,Mi Yan,et al.Window effect of pulsed electric field on biological cells[J].IEEE Transactions on Dielectrics and Electrical Insulation,2009,16(5):1259 -1266.
[14]米彦.纳秒脉冲电场诱导肿瘤凋亡的窗口效应与实验研究[D].重庆:重庆大学,2009.
[15]姚陈果,李成祥,孙才新,等.脉冲电场诱导细胞内外膜电穿孔模型与跨膜电位的仿真[J].中国电机工程学报,2006,26(13):123-128.
[16]TadejK, Damijan M. Theoreticalevaluation ofvoltage inducement on internal membrane of biological cells exposed to electric fields[J].Biophysical Journal,2006,90(2):480 -491.
[17]Kakorin S,Neumann E.Ionic conductivity of electroporated lipid bilayer memebranes[J].Bioelectro-chemistry,2002,56(1):163-166.
[18]冯慈璋.电磁场[M].北京:高等教育出版社.1994.
[19]Damijan M,Dejan S,Halima M,et al.A validated model of in vivo electric field distribution in tissues for electrochemotherapy and for DNA electrotransfer for gene therapy[J].Biochimica et Biophysica Acta,2000,1523(1):73-83.
[20]Gehl J,Sorensen TH,Nielsen K,et al.In vivo electroporation of skeletal muscle:threshold,efficacy and relation to electric field distribution [J].Biochimica et Biophysica Acta,1999,1428(2):233-240.

