抑胶素对C6脑胶质瘤细胞形态学影响的研究
林卫红,谢晓娜,崔 俐,张伯民,王 绍
(1.吉林大学第一医院神经内科,吉林长春 130021;2.吉林大学中日联谊医院心外科;3.吉林大学基础医学院生理学教研室)
抑胶素对C6脑胶质瘤细胞形态学影响的研究
林卫红1,谢晓娜1,崔 俐1,张伯民2*,王 绍3
(1.吉林大学第一医院神经内科,吉林长春 130021;2.吉林大学中日联谊医院心外科;3.吉林大学基础医学院生理学教研室)
目的探讨不同浓度的抑胶素对C6脑胶质瘤细胞形态学的影响。方法体外培养C6脑胶质瘤细胞,通过光镜及电镜技术观察不同浓度的抑胶素对C6脑胶质瘤细胞形态的影响。结果倒置显微镜及图像分析议下观察各组细胞形态变化:不同浓度抑胶素处理组可见细胞大小、形态趋向一致,有的接近正常胶质细胞,并且细胞数逐渐减少,随着抑胶素浓度的增大此种改变越明显。HE染色后可见抑胶素处理组细胞肿胀,坏死,胞核为很深的蓝色或消失,细胞膜的连续性破坏。电镜结果显示应用抑胶素后肿瘤细胞出现凋亡及坏死改变,并且随着抑胶素浓度的升高而此种改变越明显。结论抑胶素能够促使C6脑胶质瘤细胞发生凋亡及坏死,同时可使肿瘤细胞的形态向正常细胞转化,提示抑胶素具有抑制脑胶质瘤细胞生长的作用。
抑胶素;脑胶质瘤细胞;形态学
(Chin J Lab Diagn,2010,14:1056)
神经胶质瘤是中枢神经系统最常见的原发肿瘤之一,由于胶质瘤浸润生长的特性,常规的手术方法不能完全切除,并且术后极易复发。本研究即通过体外培养C6脑胶质瘤细胞,观察抑胶素对其形态学的影响,研究报告如下:
1 实验材料及方法
1.1 主要试剂及其来源 C6细胞株是由雄性Wistar大鼠静脉注射硝甲基脲而诱发产生的恶性胶质瘤细胞株(吉林大学病理毒理学教研室提供);抑胶素(吉林大学基础医学院生理教研室提供)。
1.2 C6胶质瘤细胞培养 C6为大鼠脑胶质瘤细胞株,采用单层贴壁培养法[2]。所有实验均在细胞处于对数生长期时进行。
1.3 实验分组和时相点设置以及样本采集 生长旺盛的C6胶质瘤细胞经处理后,接种于预先置有干净消毒盖玻片的6孔培养板,按照以下分组进行试验:①抑胶素处理组:于接种后12小时加入浓度分别为 2、4、8、16 ng/L抑胶素溶液。 ②PBS对照组:于接种后12小时加入等体积、等pH值的PBS溶液。③顺铂处理组:于接种后12小时加入3 μ g/ml顺铂溶液。各组细胞均在同种条件下培养,观测时相点包括处理后1 d、3 d、5 d、7 d。每组每个时相点设 3个复孔。在各时相点末取出盖玻片,用PBS液洗涤,冷丙酮固定,4℃保存,用于常规HE染色和免疫细胞化学染色。
1.4 C6胶质瘤细胞形态学观察
1.4.1 普通光学显微镜观察 将培养在6孔培养板中的细胞置于倒置显微镜下,在加药前后观察细胞的生长密度和形态学的变化。培养细胞进行HE染色:置于光学显微镜下观察。
1.4.2 电子显微镜观察 将在培养瓶中传代培养的C6细胞,用常规电镜标本制备方法处理后在JEM1200-EX透射电镜上进行细胞形态学的观察。
2 结果
2.1 C6胶质瘤细胞的鉴定 传代培养的C6胶质瘤细胞,采用免疫组化技术检测神经胶质纤维酸性蛋白(GFAP),对胶质瘤细胞进行鉴定。结果显示:胶质瘤细胞的胞浆中可见明显的棕黄色颗粒,即GFAP表达阳性。
2.2 抑胶素作用后C6胶质瘤细胞的形态学改变
2.2.1 光镜观察 利用倒置显微镜及图像分析议下观察各组细胞形态变化:PBS对照组C6细胞均质而透明,成扁平不规则的多边形,单层密集排列,细胞大小、形态表现出多样性,以梭形细胞及有相对较大的细胞核的多角形细胞较为多见,胞质丰富,细胞核异型性明显,核大小不一,细胞核与细胞质的比例较大,核染色质增加,核仁增大,细胞间粘连完好,相互接壤成片;顺铂处理组和不同浓度抑胶素处理组(图1-2)均可见细胞排列稀疏,细胞大小、形态趋向一致,细胞核、质比例较前变小,部分细胞体积变小,收缩变圆,轮廓更加清楚,细胞膜完整,有的接近正常胶质细胞。同时可见有皱缩变形,细胞出现成泡现象。以上变化随着抑胶素浓度的增大而改变明显。用药后1 d,药物处理组与对照组即有明显的差别,以后随着时间的延长,抑胶素处理组的细胞数明显减少,而且,随着抑胶素浓度的增加,其对C6胶质瘤细胞的抑制作用也明显增强。
HE染色后可见:PBS对照组细胞排列紊乱,细胞形态不一,呈多角形或不规则形,胞质红染,细胞核深染,异型核较多,核分裂像多见,可见瘤巨细胞。顺铂处理组和不同浓度抑胶素处理组可见部分细胞变圆,体积变小,细胞核深染,呈深蓝色或蓝黑色,可见核固缩,核碎裂。抑胶素浓度为8 ng/L时,上述结果最明显,而抑胶素浓度为16 ng/L时,则同时可见细胞肿胀,坏死,胞核为很深的蓝色或消失,细胞膜的连续性破坏(图3,4)。

图1 4 ng/L抑胶素浓度处理7 d

细胞数量明显减少,轮廓更加清楚,细胞膜完整×200

图3 4 ng/L抑胶素浓度7 d
2.2.2 电镜观察 传代培养的C6胶质瘤细胞分别予抑胶素(8 ng/L)、顺铂作用3 d后,收集细胞,进行电镜观察。结果显示:PBS对照组细胞整体结构清晰完整,细胞形态不规则,细胞表面可见微绒毛结构,细胞核较大,几乎占据整个细胞,核膜光滑完整,核质比较大,核仁明显,一个或多个,呈网团状。核内常染色质占多数,只有少量异染质呈颗粒状散在分布,细胞核与细胞质的界限明显,细胞质内可见到许多细胞器,如线粒体,粗面内质网及游离核糖体等结构。抑胶素处理组和顺铂处理组可见细胞整体致密暗淡,表面的微绒毛消失,细胞核极不规则,核固缩明显,可见细胞核有切迹,核异染色质增多,沿核膜内侧排列,边集而形成半月形,细胞质内多数线粒体肿胀、空化,线粒体嵴断裂,内质网扩张,同时有一些髓样小体出现(图5、6)。
3 讨论
在对脑胶质瘤的发生学研究中,Ullrich等发现,人脑星形细胞胶质瘤细胞的电压依赖性氯通道开放,这种氯通道在正常胶质细胞以及非神经胶质来源的人体肿瘤细胞中均不存在[3]。这一特殊的变化成为鉴定胶质瘤细胞的客观指标,同时也为判断治疗胶质瘤的药物或其它治疗措施效果的精确指标。也就是说凡是可以抑制氯通道开放(氯电流减少)的举措应该对治疗胶质瘤都是有效的。
氯毒素对胶质瘤上的氯离子通道有特异性的结合能力。给有神经胶质瘤的动物注射125I和131I标记的氯毒素后,放射性物质选择性地积累在脑肿瘤内。这种选择性地结合在神经胶质瘤细胞上,发挥其药理作用[4]。由于这些发现为氯毒素治疗脑胶质瘤提供了有意义的线索。但我们国内所用的东亚钳蝎毒抑胶素对C6胶质瘤细胞是否有抑制作用尚无报道。
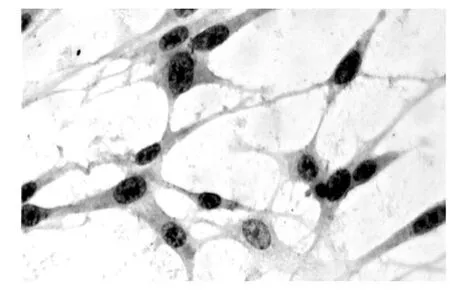
图4 16 ng/L抑胶素浓度7 d

图5 抑胶素处理 C6细胞(×6000)

图6 抑胶素处理C6细胞(×7500)
本研究中,传代培养的C6胶质瘤细胞贴壁后,经不同浓度的抑胶素以及顺铂处理后,细胞的形态学发生了明显的改变。倒置显微镜下可见对照组细胞贴壁状况良好,铺满瓶底。而抑胶素处理组和顺铂处理组均可见细胞数目减少,排列稀疏,细胞贴壁状况不好,细胞膜完整,细胞体积变小,收缩变圆,轮廓更加清楚,同时可有皱缩变形。HE染色后,抑胶素处理组和顺铂处理组均可见部分细胞变圆,体积变小,细胞核深染,可见核固缩,核碎裂。电镜下可见,对照组细胞形态不规则,突触发达,细胞表面可见微绒毛结构,细胞核形态不规整,核内异染色质较多,细胞质内可见到许多细胞器,如线粒体,粗面内质网及游离核糖体等结构。抑胶素处理组和顺铂处理组细胞整体显得致密暗淡,表面的微绒毛消失,细胞核极不规则,核固缩明显,可见细胞核有切迹,核内异染色质凝集增多,细胞质内出现多数排列整齐的粗面内质网,并有细胞突起出现。内质网是细胞内高度分化的结构,分化良好的内质网代表照细胞的再分化和功能的恢复。
顺铂是目前临床常用的化疗药物,有研究证明[5]:顺铂可以使线粒体凋亡信号途径的关键基因Bax表达增高,Bax与Bcl-2的比值增大,从而诱导胶质瘤细胞出现凋亡。马文斌等人[6]也用顺铂成功地诱导大鼠C6胶质瘤细胞发生凋亡。本实验的结果显示,抑胶素作用于胶质瘤细胞后,肿瘤细胞出现了凋亡的形态学改变,因此提示抑胶素对C6胶质瘤细胞的抑制作用可能是通过诱导凋亡实现的。抑胶素浓度为8 ng/L时,细胞凋亡最明显,而抑胶素浓度为16 ng/L时,则同时可见细胞肿胀,坏死,胞核为很深的蓝色或消失。提示在一定浓度的抑胶素作用下,肿瘤细胞发生凋亡,而较高浓度的抑胶素作用后,则可以引起肿瘤细胞的坏死。许多抗肿瘤药物引起的肿瘤细胞死亡中,既存在部分凋亡特征,抑或凋亡和坏死共存现象,在凋亡晚期当巨噬细胞无法吞噬凋亡小体时,细胞常常继发坏死,因此凋亡的最终结局也是坏死。而从治疗的角度看,诱导凋亡的药物剂量是可取的。因为大剂量的化疗药物在杀伤肿瘤细胞的同时也损伤正常的组织细胞。
通过以上抑胶素对C6脑胶质瘤细胞形态学的作用观察明确了抑胶素能够抑制肿瘤细胞的生长以及诱导肿瘤细胞的凋亡及浓度越大此种作用越明显。为药物的开发奠定了理论基础。
[1]张守涛,郭霭光,肖乐义,等.东亚钳蝎神经毒素基因BmKCT的克隆与表达[J].西北农林科技大学学报(自然科学版),2002,12(30):631.
[2]林卫红,崔 俐,张伯民,等.抑胶素对大鼠脑胶质瘤P16蛋白表达影响第实验研究[J].中国实验诊断学,2007,11(7):881.
[3]Ullrich N,Vrdey A,Gillespie GY,Sontheimer H.Expression of volfageactivated chloride currets in acute slices of human gliomas[J].Neuroscience,1998,83:1161.
[4]Sococeanu L,Gillespie Y,Khagaeli MB,Sontheimer H.Use of chlorotoxin for targeting of primarg brain tuzuors[J].Caucer Res,1998,58:4871.
[5]Lee JU,Hosotani R,Wada M,et al.Michanism of apoptosis induced by cisplatin and VP-16 in PANC-1 cells[J].Anticancer Res,1997,17:3445.
[6]马文斌,陈松森,任祖渊,等.顺铂诱导大鼠、C6胶质瘤细胞凋亡[J].基础医学与临床,2000,20(3):80.
Research of Antigliomation's effect on the morphology of C6 glioma cells
LIN Wei-hong,XIE Xiao-na,CUI Li,et al.(Department of Neurology,the First Hospital of Jilin University,Changchun130021,China)
ObjectiveExplore the effects of Antigliomation in different concentration on the morphology of C6 brain glioma cells.MethodsCulture C6 glioma cells in vitro and detect the effectsof Antigliomation in different concentration on the morphology of C6 glioma cells by electron-light microscopic technique.ResultsObserve morphological changesof each group cells under the invert microscope and quantimet:in control group withAntigliomation in different concentration,observe that both size andmorphology of glioma cells are inclined to consistency,and some of those are similar to normal glioma cells and the number of the cells gradually decreased.as the concentration of Antigliomatin increasing,such changes become more apparent.by HE staining method,the cells in control group with the treatment of Antigliomation become swelling and necrosis,the karyons are deeply stained to blue or even disappear,the membrane was defective in continuity.by electronmicroscopic resulte show,tumor cells with the treatment of Antigliomation,become apoptosis accompanied by necrosis and as the concentration of Antigliomatin increasing,this change is more obvious.ConclusionAntigliomation canhelp brain glioma cells to apoptosis andrecrosis and can help the morphology of the tumor cells transform into normal morphological cells and show that Antigliomation can inhibit the growth of brain glioma cells.
antigliomation;brain's glioma cells;morphology
R739.41
A
1007-4287(2010)07-1056-03
吉林省科技厅科研资助,编号:20050407-6
*通讯作者
林卫红(1964-),女,博士,教授,主要从事癫痫及神经系统肿瘤研究。
2008-12-20)

