稳定同位素13C标记乙醇
罗 勇,杜晓宁,谭树波,王 刚,张 亮,孙桂香
(上海化工研究院 上海稳定同位素工程技术研究中心,上海 200062)
乙醇是一种重要的有机化工原料。广泛应用于有机合成、农药、医药及精细化学品生产中。稳定同位素13C标记乙醇是合成13C标记产品的基础有机试剂之一,以13C2-乙醇作为前体,可以在化合物中引入13C标记的乙基和乙酰基,进而得到一系列同位素13C标记的有机化合物。
实验室规模上同位素标记乙醇一般采用乙酸或乙酸酯还原方法[1-2]制备,或从BaCO3出发,经乙炔制乙烯,乙烯水合制环氧乙烷,最后经LiA lH 4还原[3-4]得到13C2-乙醇。以上方法或是实验路线太长,或是稳定同位素收率偏低。因此寻找一种简便且收率高的合成13C2-乙醇的方法十分必要。
本工作拟采用Ba13CO3为原料,对生成的13CO2通过活性金属碳化物水解方法制备乙炔,乙炔经催化水合生成乙醛,乙醛再经NaBH4还原得到13C2-乙醇。
1 实验部分
1.1 主要仪器与装置
Agilent 7890A气质联用仪、Agilent 1790F气相色谱仪:美国安捷伦公司;Nocolet 6700傅里叶红外仪:美国尼高力公司;KF-1卡尔费休水分测定仪:上海化工研究院;MAT-271气体同位素质谱计:美国Finnigan公司;DLSB循环冷却泵:河南巩义英峪予华仪器厂;BT100-2J蠕动泵:河北保定兰格恒流泵有限公司;真空手套操作箱:上海华岩仪器设备有限公司;锂反应器:采用耐高温不锈钢材质,直径9 cm,高度35 cm,阀盖为卡套式快开设计,配备真空表。
1.2 主要材料与试剂
Ba13CO3(13C同位素丰度 98.0%):美国CIL公司;金属锂、硫酸汞、硼氢化钠、乙二醇二甲醚等皆为市售化学纯或分析纯试剂。
1.3 实验方法
13C标记乙醇的合成路线示于图1。
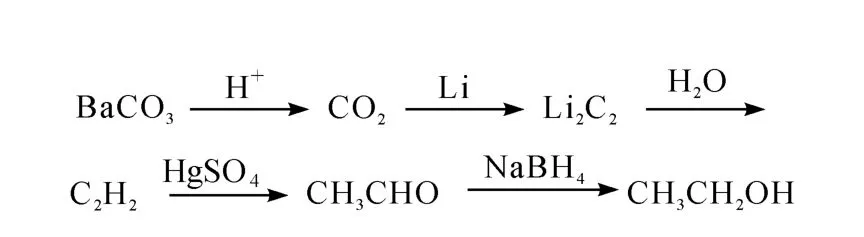
图1 13C标记乙醇的合成路线
1.3.1 乙炔的制备
在真空手套箱中称取22 g金属锂,经转移后快速放入锂反应器中,密闭后抽真空,再置于加热炉中开始升温。升温过程中保持真空条件以除去加热过程中可能产生的气体。待反应器温度升至680~720℃时,关闭反应器与真空泵的阀门,开始缓慢通入由99 g BaCO3(0.50m ol)定量反应得到的CO2(0.50 mol),通过控制CO2的通入速度,使整个过程中反应器的绝对压力始终低于0.01 MPa。通完气体后,反应器再升温至900℃,保持1 h,然后降温。至室温后即可进行水解制取乙炔。
水解所用的蒸馏水使用前需经煮沸以除去CO2,将蒸馏水缓慢滴加至锂反应器中,生成的乙炔气体经液氮冷阱收集后,转移至气袋中待用。
1.3.2 催化水合法制备乙醛
催化剂母液组成为2 g HgSO4溶于100 m L 10%硫酸中。乙醛合成装置示于图2。图2中反应器依次连接回流冷凝管、冷阱、三通阀、恒流泵。反应时,确认装置的气密性后,先将反应体系抽真空,氩气置换三次,再通入约5 L乙炔,反应温度为65~95℃,反应5~10 h。乙炔气在恒流泵的作用下以一定速率鼓泡进入反应器,产生的乙醛在-40℃的酒精-液氮冷阱中收集,未反应的乙炔回到反应器继续反应至结束。
1.3.3 乙醛还原制备乙醇
在冰浴下,将7.5 g(0.159 mol)无水乙醛、2.1 g(0.056 mo l)NaBH4和30 m L聚乙二醇二甲醚加入到配有磁力搅拌和回流冷凝管的50m L圆底烧瓶中,缓慢升温至20℃,保持6 h;然后缓慢滴加20m L 3 mol/L的HCl溶液,水解完毕后,在减压蒸馏条件下,将乙醇蒸馏收集。
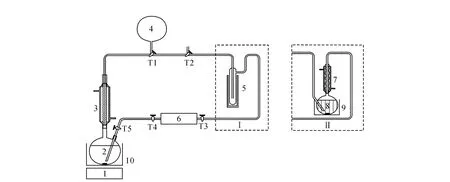
图2 乙醇制备流程
2 结果与讨论
2.1 合成工艺对乙炔合成的影响
以CO2为原料,与金属锂在高温下生成碳化锂,碳化锂经水解,可得到具有良好纯度和收率的乙炔[5]。CO2在高温下与金属锂生成碳化锂的反应过程如下:
10Li+2CO2——→Li2C2+4Li2O (1)
4Li+2CO2——→Li2O+Li2CO3+C (2)
Li2O+CO2——→Li2CO3(3)
Li2CO3——→Li2O+CO2(4)
Li2C2——→2Li+2C (5)
由此可见,除主反应(1)外,还同时存在副反应(2)~(5),这些副反应会降低原料CO2的利用率,因此需要通过控制反应工艺加以抑制。
副产物Li2 CO3主要在900℃以下形成,随着温度的升高,其含量减少,Li2C2的含量增加;但是反应温度过高,Li2 C2也会发生分解形成金属锂和碳黑。因此,本工作对Li2C2的制备、水解过程中的多种工艺参数进行了考察和优化,得到较优的工艺条件:金属锂过量30%~50%,CO2进气温度700℃,控制CO2进气速度,使体系绝对压力始终低于0.01 MPa,CO2通入完毕后,再快速升温至900℃保持1 h。
此外,在碳化锂水解中,采用6 mol/L的盐酸溶液代替蒸馏水,以促进生成的LiOH转化为易溶于水的LiCl,使水解时间和水用量都大幅减少。
在优化的条件下,以消耗的BaCO3计,乙炔的收率高于95%,化学纯度高于99%,可直接用于乙醛的合成。
2.2 反应温度对乙醛合成的影响
采用库切洛夫反应,通过乙炔催化水合方法是制备13C标记乙醛的较好方法[6],其机理如下:在高汞离子及硫酸存在下,乙炔与水进行加成反应生成乙醛,其化学过程示于图3。
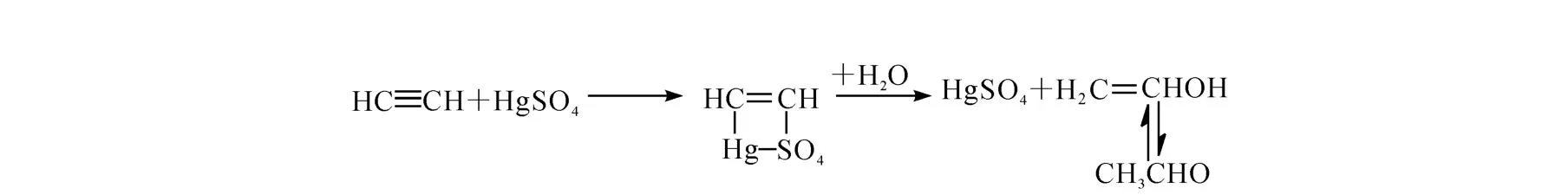
图3 乙醛的合成路线
在乙醛合成中,由于乙炔的单程转化率很低,以及生成的乙醛长期滞留在催化剂母液中可能会导致进一步反应生成巴豆醛等副产物。因此在反应装置设计中加强了反应气的循环和传质,生成的乙醛在冷阱中收集,未转化的乙炔继续回到反应器进行反应;并且通过设置合适的回流冷凝温度,可以使冷阱中乙醛的含水量低于0.3%。
在工业上,为提高乙炔的转化率,其水合反应一般控制温度为 90~95℃,压力为 0.1~0.2 MPa。本实验中采用常压操作,反应温度对乙醛收率影响列于表1。由表1可知,升高反应温度对乙炔的水合反应有利,反应温度为85℃时,可获得最高的乙醛收率;进一步升高反应温度,乙醛收率有所下降。
2.3 助催化剂对乙醛合成反应的影响
在乙炔催化水合制备乙醛过程中还存在如下反应:生成的乙醛在催化剂体系中被氧化成乙酸,同时具有活性的高汞离子被还原成非活性的亚汞离子,最终被还原成为金属汞而从反应液中析出,从而降低了体系的催化活性。
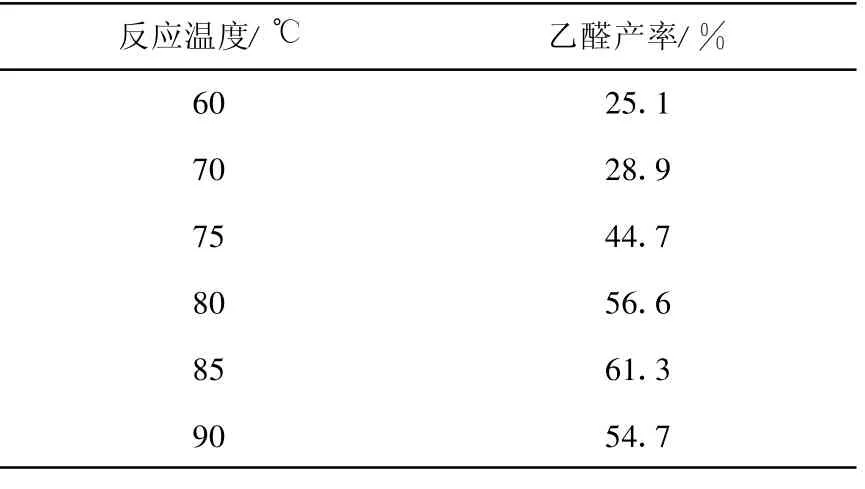
表1 反应温度对乙醛收率的影响
CH3CHO+2H g2++H2O——→CH3COOH+2Hg++2H+
CH3CHO+Hg2++H2O ——→CH3COOH+Hg·+2H+
在实验中也观察到反应器底部有明显的金属汞生成,一方面降低了催化剂的活性,另一方面也增加了后处理难度。多种具有可变价态的金属盐均对汞催化剂的还原有一定的抑制作用,本研究中选用Fe2(SO4)3作为助催化剂,并考察了其用量对乙醛合成的影响,其他实验条件同1.3.2,结果列于表2。
由表2可以看出,随着助催化剂用量的增加,乙醛收率先随之升高,到1.0 g时达到最高,此后,助催化剂用量进一步增加,乙醛收率显著下降。在实验中同时注意到,使用助催化剂后,反应器内基本未观察到金属汞的生成,表明助催化剂的使用对抑制催化剂的还原有较好作用。
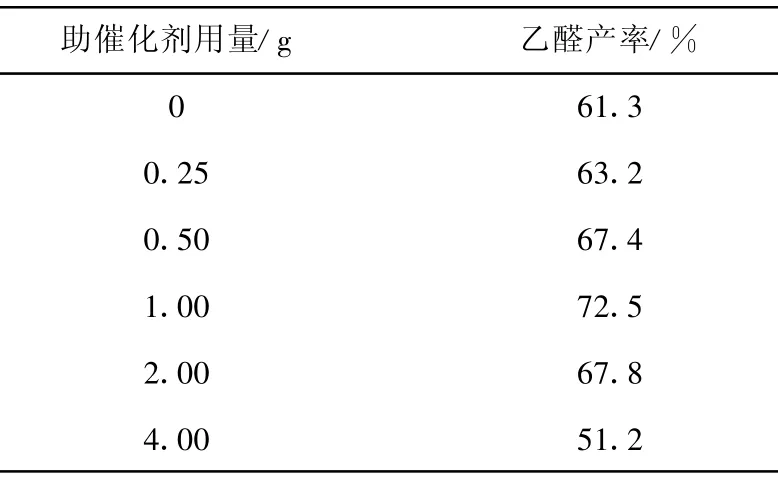
表2 助催化剂对乙醛收率的影响
2.4 溶剂对乙醇合成的影响
NaBH 4是一种优良的还原剂,性质稳定,能选择性地将醛基还原为醇。采用 THF、乙醚等多种溶剂体系均可高收率地将乙醛还原为乙醇。但由于产物乙醇和溶剂沸点接近,在产物精制上有较大难度,不适合同位素标记乙醇的合成。通过对多种溶剂的筛选,最终确定了采用平均相对分子质量约为250的聚乙二醇二甲醚[7]作为溶剂,在优化的条件下,当以试剂无水乙醛为原料时,获得了超过90%的乙醇收率(以消耗的无水乙醛计算)。
2.5 连续法合成乙醇
采用自制的无水乙醛作为原料用于乙醇的合成时,出现了乙醇收率普遍较低(40%~70%)且波动较大的现象。通过对自制的无水乙醛做进一步分析,发现自制的乙醛在冷阱中可自聚生成少量三聚乙醛(1%~3%),随着放置时间的延长,三聚乙醛含量可增加至10%以上。而在乙醇合成反应中,即使低至1%的三聚乙醛含量也会对反应收率有一定影响。对此采取了包括三聚乙醛解聚和添加阻聚剂[8-10]等在内的方法纯化自制的无水乙醛,虽然可以显著提高乙醛的纯度,但操作中乙醛的损失较大,同时可能引入其它有机物造成产物丰度稀释现象。
经对原有反应装置进行改造,将原本分别进行的乙炔催化水合制乙醛和乙醛NaBH4还原制乙醇两个反应串联起来,反应气先后经过乙醛反应器和乙醇反应器,生成的乙醛直接在乙醇反应器中被还原,以避免在低温和无水条件下乙醛发生自聚,从而消除了三聚乙醛对后续NaBH 4还原反应的影响;同时也避免了原先分步操作中乙醛因转移造成的损失。这一改进在实践中取得了良好的效果,实验结果列于表3。以消耗的BaCO3计算,乙醇的收率达到了60%。
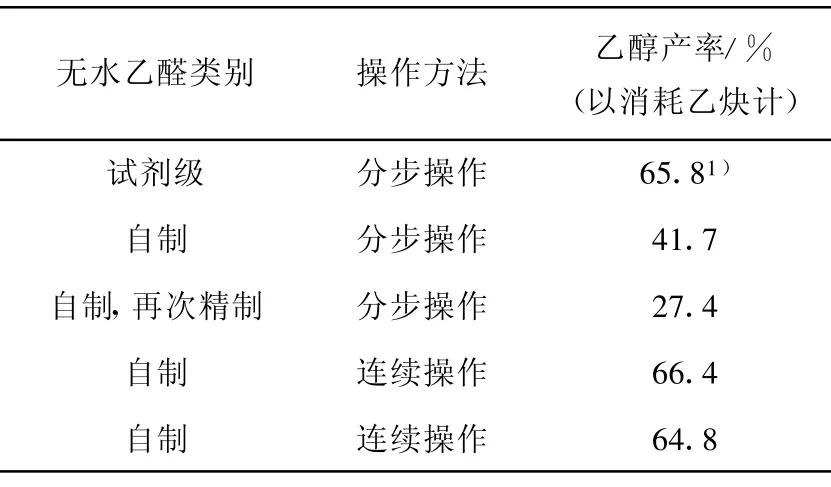
表3 操作方式对乙醇收率的影响
2.6 13C2-乙醇的合成与表征
在优化各步收率,并多次模拟实验的基础上,以 Ba13CO3(13C丰度为98.0%)为原料,进行13C2-乙醇合成的丰度实验,以消耗的Ba13CO3计,13C2-乙醇的收率为 51%。以分析纯(99.7%)的无水乙醇试剂为外标,用气相色谱检测,结果示于图4。由图4可计算得,13C2-乙醇的纯度为99.3%。
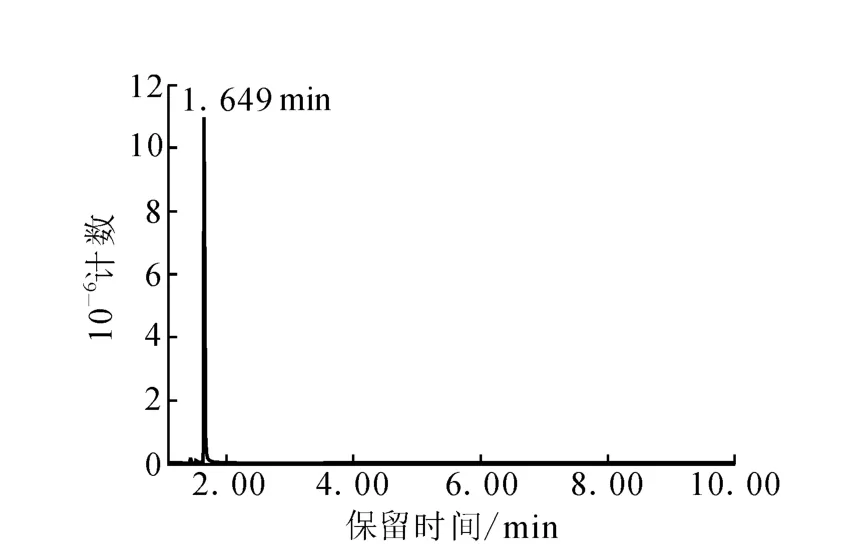
图4 13C2-乙醇的气相色谱图
用NMR检测13C2-乙醇中13C同位素丰度,结果示于图5和图6,图5为C1位的13C谱图,图6为 C2位的13C谱图。由13C谱积分计算得,13C2-乙醇的C1位的13C同位素丰度为95.45%,C2位的13C同位素丰度为95.84%。
13C2-乙醇的红外谱图示于图7。由图7可见,13C2-乙醇的红外谱图与乙醇的标准红外图基本一致。其中,在 3 300 cm-1处有一宽峰,推测为O-H的吸收峰,这是由于13C的取代使得该吸收峰移向低波数;在1 000 cm-1左右出现一强峰,推测为C-H的吸收峰,同样是由于13C的取代使得吸收峰向低波数发生位移。
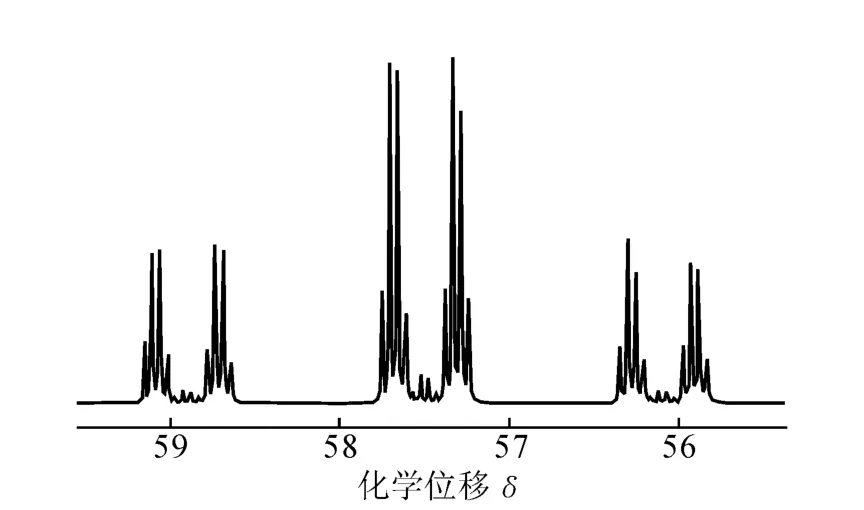
图5 13C2-乙醇C1位的13CNMR谱
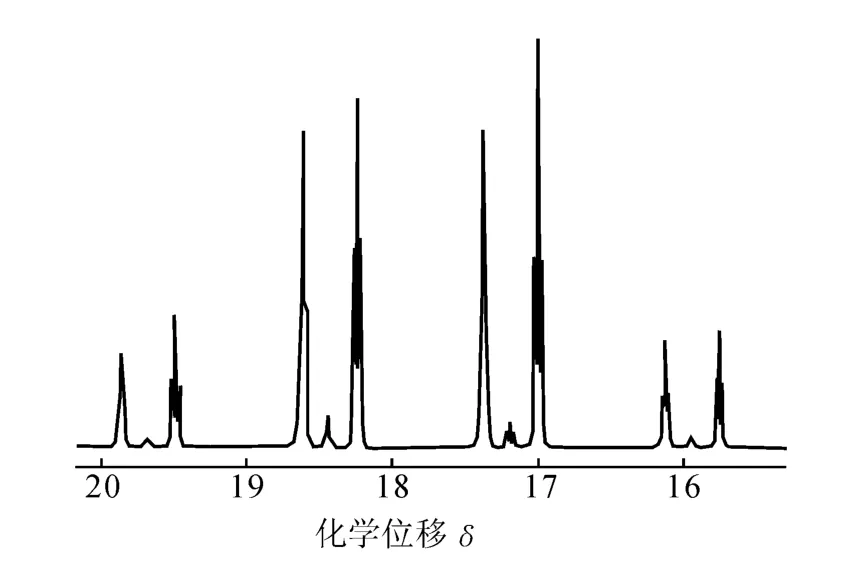
图6 13C2-乙醇C2位的13CNMR谱

图7 13C2-乙醇的红外谱图
3 结 论
本工作设计并完成了适合13C2-乙醇合成的工艺。以Ba13CO3为原料,采用金属锂法制备乙炔,乙炔催化水合制得乙醛,乙醛在高沸点溶剂中经NaBH4还原,制得13C2-乙醇;并对影响乙醇收率的多种因素进行了考察,获得了较佳的合成工艺。产物经色谱和质谱等证实,化学纯度>99%,13C同位素丰度>95%,同位素稀释效应的影响小于3%。
[1] Tolbert B,Christenson F,Chang F,et al.Synthesis of ethano l-1-14C,ethanol-2-14C,ethy l-bromide-1-14C,ethyl-brom ide-2-14C and14C-labeled methadone[J].JO rg Chem,1949,14:525-529.
[2] Adam s P,Selff R,Tolbert B.H ydrogenation of fatty acids to alcoho ls[J].JAm Chem Soc,1952,74:2 416-2 417.
[3] Cox J,Warne R.Syntheses with isotopic tracers elements:partⅢ.the preparation of ethylene oxide and ethanol labeled with carbon isotopes[J].J Chem Soc,1951:1 893-1 896.
[4] Authur M,L loyd W.O rganic syntheses w ith isotopes:part I[M].New York:Interscience Publishers,1958:904-916.
[5] 周明富,沈承德.14C年代测定的碳化锂制样法的研究[J].地球化学,1983,4:411-416.
[6] 肖淑兴,高文德,刘维铭,等.高氘代率乙醛的制备[J].四川大学学报:自然科学版,1998,35(4):645-647.
[7] Kiyoshi T,Tsuneo S,Yoko Nishida,etal.Chemical reduction of aldehy des in the presence of ketones with NaBH4in polyethy lene glycol dimethy l ethers[J].Synthetic Communication,2005,35:867-872.
[8] 刘瑞江,张业旺,闻崇炜,等.乙醛阻聚对策和罐装安全预测研究[J].化工生成与技术,2008,15(5):49-52.
[9] 刘瑞江,崇余.乙醛合成三聚乙醛反应规律的研究[J].南京工业大学学报,2004,26(6):29-32.
[10]杨文玲,康文通,李景生.三聚乙醛解聚制备乙醛研究[C]//第九届全国化学工艺年会论文集.北京:中国石化出版社,2005:926-930.

