PET肿瘤显像剂18F-氟乙基胆碱的自动化合成
党永红,李 方,吕京桥,邢海群
(中国医学科学院北京协和医学院,北京协和医院核医学科,北京 100730)
2-18F-2-脱氧-D-葡萄糖(FDG)是目前 PET最常用的反映细胞糖代谢的肿瘤显像剂,但18FFDG存在特异性较差、有时出现假阳性、不能区分肿瘤和炎症等缺点,在某些脑肿瘤、肺癌、前列腺癌等的诊断和鉴别中存在很多困难。为弥补18F-FDG不足,研究人员致力于新肿瘤显像剂的研究。
胆碱是所有细胞用于生物合成磷脂的前体,而磷脂是细胞膜的重要组成成分。肿瘤的特点是细胞增殖快,迅速增生的肿瘤组织增加了对胆碱的需求。因此胆碱也成为一类重要的代谢显像剂。11C-胆碱作为第一个胆碱类显像剂,已成功应用于脑肿瘤、肺癌、食管癌、结肠癌以及前列腺癌等恶性肿瘤诊断[1-2]。但11C的半衰期短,只有20 min,只能在配备加速器的单位使用,这就推动了具有较长半衰期的18F(t1/2=109 min)标记的胆碱类显像剂的发展[3-7]。研究[8-9]表明,18F标记的胆碱类似物在脑肿瘤的诊断中显示出良好的应用前景。其中18F-氟乙基胆碱(18F-FECH)与11C-胆碱的体内分布相似,且在前列腺癌患者体内获得了良好的显像结果[7]。在德国,18F-FECH用于诊断前列腺癌已进入了三期临床阶段[10];而国内,18F-FECH在北京协和医院已通过伦理委员会的审批,进入备案前的临床试验阶段。
吴战宏等[11]曾成功合成18F-FECH,但其合成时间较长且收率较低。PET-MF-2V-IT-I型18F多功能合成模块是商品化的用于研制、生产18F标记化合物的合成装置,它通过计算机控制,可依据需要按手动、自动和半自动方式合成多种常规和复杂的18F标记物。模块的使用不仅可简化操作,而且也有利于辐射防护。为了保证临床试验工作的顺利进行并推广18F-FECH的临床应用,本工作拟利用现有的模块,进行18F-FECH的自动化合成研究,建立一种通用的自动化合成方法。
1 主要实验材料和仪器
1.1 试剂与材料
1,2-乙二醇二对甲苯磺酸酯(纯度>97%)和无水K2CO3(纯度99.995%):美国A ld rich公司产品;N,N-二甲基乙醇胺(纯度≥98%):美国Fluka公司产品;无水乙腈(纯度99.9%)和K2.2.2(纯度 98%):比利时 Acros公司产品;HPLC乙腈(色谱纯):瑞士 Fisher公司产品。其余试剂均为国产分析纯。QMA(Sep-pak Light)、C18(Sep-Pak Plus)、CM 柱(Sep-Pak Plus):美国 Waters公司产品;Adsorbosphere SCX色谱柱(5μm,4.6 mm ×250 mm):美国A lltech公司产品,60F254薄层层析硅胶板:德国Merck公司产品;Millex-GS 0.22μm除菌过滤器:美国Millipore公司产品。
1.2 仪器
RDS111型回旋加速器:美国 CTI公司产品;PET-MF-2V-IT-I型18F正电子药物合成模块:北京派特生物技术有限公司产品;高效液相色谱仪:配515型泵,美国Waters公司产品;486型高效液相色谱紫外检测器:美国Waters公司产品;高效液相色谱放射性检测器:美国Bio-Scan公司产品;Mini-Scan和F low Counter:美国Bio-Scan公司产品;CRC-15R型放射性活度计:美国CAPINTEC公司产品。
2 实验方法
2.1 合成模块
PET-MF-2V-IT-I型18F多功能合成模块结构示意图示于图1。根据18F-FECH的合成路线与处理方式编写了合成控制程序。
2.2 18F-FECH的自动化合成
18F-FECH的自动化合成路线示于图2。由图2可知,18F与1,2-乙二醇二对甲苯磺酸酯反应生成中间体18F-氟乙基对甲苯磺酸酯,中间体再与N,N-二甲基乙醇胺发生烷基化反应得到18F-FECH,经过C18和CM 柱分离纯化得到最终产品。
具体反应过程如下。
(1)1号瓶中的1.5 m L STOCK溶液(K2.2.2 13 g/L,K2 CO3 3 g/L)将富集在 QMA柱上的18F-淋洗至1号反应管(RV 1)中,加热至116℃下蒸干溶液。
(2)将2号瓶中的2 m L无水乙腈加入到RV 1中,加热至116℃,蒸干溶液,冷却。
(3)将3号瓶中的液体(12 mg 1,2-乙二醇二对甲苯磺酸酯溶于0.8 m L无水乙腈)加入RV 1中,于90℃下反应5m in。升温至115℃,蒸除溶剂。
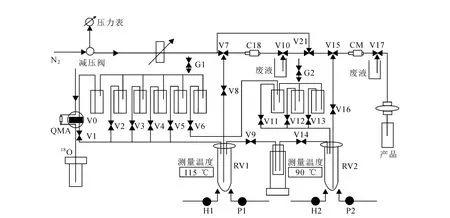
图1 18F多功能合成模块结构示意图
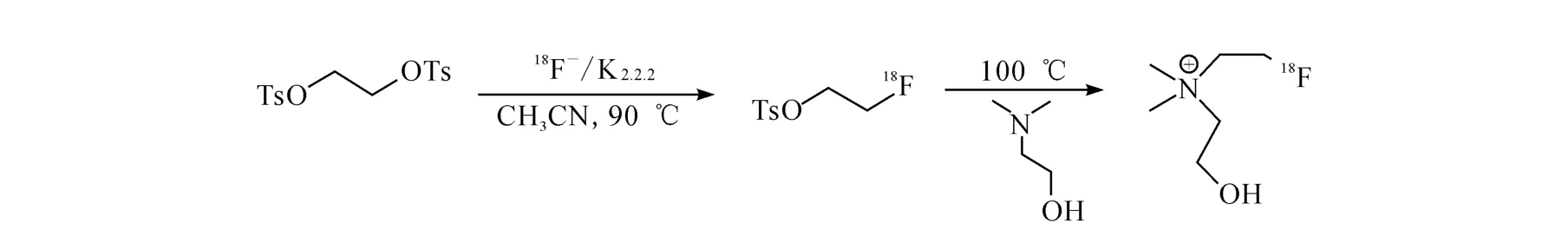
图2 18F-FECH的自动化合成路线
(4)冷却RV 1后加入4号瓶中的0.3 m L N,N-二甲基乙醇胺,100℃下反应8m in,冷却。
(5)向RV 1中加入5号瓶中的2 m L去离子水,经过 C18柱转移至第二个反应管(RV 2)中。
(6)将RV 2中的液体转移至CM柱上,洗出液引入废液瓶。
(7)加入12号瓶中的10 m L乙醇至RV 2中,清洗CM柱。
(8)将6号瓶中的20m L灭菌注射用水转移至11号瓶中,然后加入到RV 2中,再次清洗CM柱。
(9)将13号瓶中的5m L生理盐水加入到RV 2中,将CM 柱上的产品洗脱下来,洗脱液经过0.22μm除菌过滤器收集在30m L无菌产品瓶中,得到无色澄明的18F-FECH注射液。
2.3 产品的质量控制
(1)目测产品的颜色及澄明度,用精密pH试纸测定pH。
(2)采用高效液相色谱(HPLC)法和薄层层析(TLC)法检测产品的放化纯度。HPLC法的色谱条件为:V(0.25 mol/L磷酸二氢钠溶液)∶V(乙腈)=90∶10为流动相,流速为1.0m L/min,紫外检测波长为206 nm。TLC法所用展开剂为5%乙酸溶液。
(3)检测产品中K2.2.2的含量。采用薄层层析法,V(甲醇)∶V(氨水)=9∶1为展开剂,碘铂酸钾显色。
(4)参照中国药典2005年版二部附录ⅪE进行无菌和细菌内毒素检查。
(5)室温下测定3个半衰期内(6 h)的放化纯度,观察其稳定性。
3 结果与讨论
3.1 18F-FECH的自动化合成
整个自动化合成过程需时约40 m in,产品的放化收率为30%(未经时间校正)。与文献[6-7,11-16]中其他应用模块合成的结果相比,反应时间和放化收率差于Pascali等[16]的方法,而要好于其它几种方法。提示反应的条件和参数还可以进一步优化,从而在更短的时间里得到更高放化收率的产品。
本方法采用了两步反应在同一个反应管中进行的方法。文献中单管反应产品纯化采用的方法有两种:一种是相对比较烦琐的HPLC法,另一种是比较简便的固相萃取法。唐刚华[12]和王明伟等[15]使用硅胶柱进行纯化,但合成时间较长(80min和65m in),且收率相对较低。本工作也对此纯化方法进行过比较,结果显示,用水清洗硅胶柱不能完全除去N,N-二甲基乙醇胺;分别用乙醇和水清洗(至产品中闻不到N,N-二甲基乙醇胺的气味),则放化收率约为20%(未经时间校正)。故本工作采用了C18柱和CM柱对产品进行固相萃取分离。
3.2 C18柱对合成效率的影响
CM柱是弱的阳离子交换柱,可以吸附18FFECH,从而达到纯化目的。单管反应时,氟代反应中碳酸钾中钾离子的存在对CM吸附最终产品的影响很大,常常会造成产品在CM柱上的漏穿。本工作在CM柱前加了C18柱。在相同的反应条件下,C18柱对合成效率的影响列于表1。从表1可以看出,在相同的反应条件下,不用C18柱的合成效率只有5%~8%,仅为采用C18柱的1/4,说明有大部分产品从CM柱上漏穿。因此C18柱不仅可以去除未反应的1,2-乙二醇二对甲苯磺酸酯及反应中间体18F-氟乙基对甲苯磺酸酯,而且可以吸附与K2.2.2络合的钾离子,是保证合成效率的重要环节。经过C18柱的纯化后,CM柱只能吸附最终产品,用乙醇和水可以将未反应的N,N-二甲基乙醇胺及18F-等其他杂质冲洗掉,生理盐水淋洗后即得最终产品。

表1 C18柱对合成效率的影响
3.3 18F-FECH注射液的质量控制
(1)所得产品为无色澄明液体,pH为7.0~8.0。
(2)产品18F-FECH的HPLC和TLC谱图分别示于图3和图4。由图3可以看出,产品的保留时间为4.21 min,FECH标准品[11]的保留时间为4.03 min,即产品的放射性吸收峰与标准品的紫外吸收峰的保留时间一致,表明18F标记FECH后没有改变FECH的化学结构。由图4可见,产品只有唯一的放射性吸收峰,根据此峰可计算得18F-FECH放化纯度>99%。
(3)显色后,样品斑点的颜色不比浓度为25m g/L的K2.2.2标准溶液的斑点颜色深。说明产品中的K 2.2.2含量小于25mg/L。
(4)产品的细菌及细菌内毒素检查均符合规定。
(5)图 5为18F-FECH室温放置6 h后的HPLC色谱图。由图5可以看出,产品的放化纯度没有明显变化,仍大于98%。表明产品的稳定性较好。
以上结果说明本方法所合成的18F-FECH注射液符合放射性药物的质量要求,可安全用于临床。
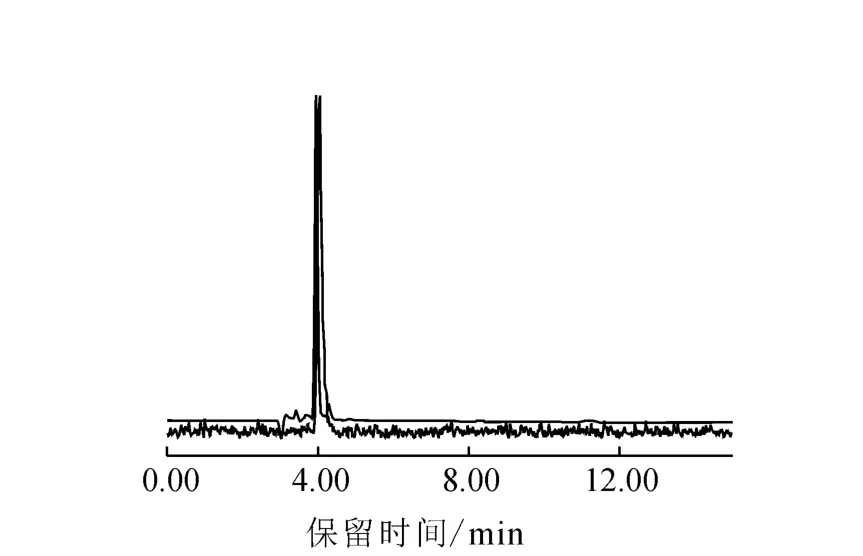
图3 18F-FECH注射液的 UV和HPLC重迭谱图
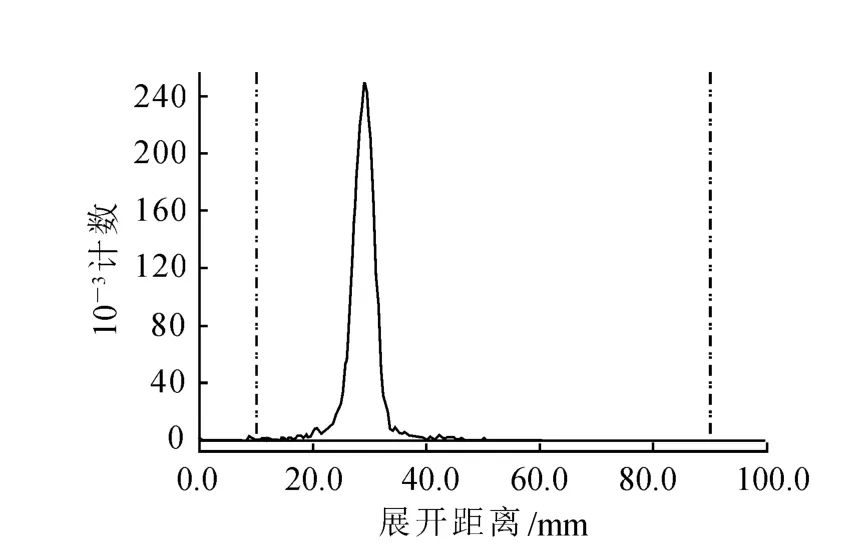
图4 18F-FECH注射液的TLC谱图(R f=0.22)
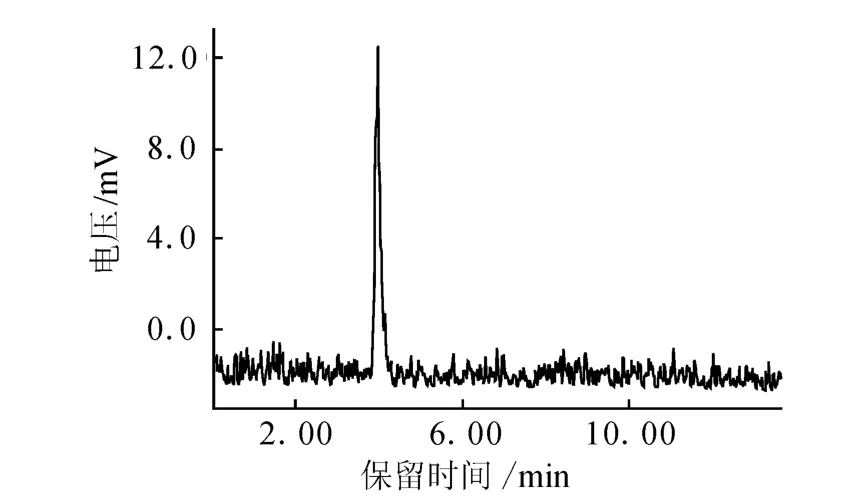
图5 18F-FECH注射液室温放置6 h后的HPLC色谱图
4 结 论
本工作利用PET-MF-2V-IT-I型18F多功能合成模块自动化合成了18F-FECH,合成时间为40min,产品的放化收率为30%(未经时间校正),放化纯度大于99%,稳定性好,其余各项指标均符合要求。该自动化合成方法简便快速,为临床诊断工作提供了有力的保证。在今后的工作中需进一步优化反应条件和参数,使该方法更加完善。
致谢:感谢北京派特生物技术有限公司杨建华工程师在模块使用中给予的指导与帮助。
[1] Hara T,Kosaka N,Kondo T,et al.Imaging of brain tumor,lung cancer,esophagus cancer,colon cancer,and bladder cancer w ith[C-11]choline[J].JNuclMed,1997,38(Supp l):250.
[2] H ara T,Kosaka N,Shinoura N,et al.PET imaging of brain tumor with[methy l-11C]choline[J].JNuclMed,1997,38:842-847.
[3] H ara T,Yuasa M.Automated synthesis o f fluorine-18 labeled choline analogue:2-fluoroehty ldimethy l-2-oxyethy lammonium[J].J Nucl Med,1997,38(Supp l):44.
[4] DeGrado TR,Coleman RE,Wang S,et al.Synthesis and evaluation of18F-labeled choline as an oncologic tracer for positronem ission tomography:initial findings in prostate cancer[J].Cancer Res,2001,61:110-117.
[5] H ara T.18F-Fluorocholine:a new onco logic PET T racer[J].JNuclMed,2001,42:1 815-1 817.
[6] DeG rado TR,Baldwin SW,Wang S,et al.Synthesis and evaluation of18F-labeled choline analogs as onclogic PET tracers[J].J Nucl Med,2001,42:1 805-1 814.
[7] H ara T,Kosaka N,K ishi H.Developmento f18F-fluoroethy lcholine for cancer imaging with PET:synthesis,biochemistry,and prostate cancer imaging[J].JNuclMed,2002,43:187-199.
[8] Kw ee SA,Ko JP,Jiang CS,et al.So litary brain lesions enhancing at MR imaging:evaluation w ith fluorine 18-f luorocholine PET[J].Radiology,2007,244:557-565.
[9] Kw ee SA,Degrado TR,Talbot JN,et al.Cancer imaging w ith f luorine-18 labeled choline derivatives[J].Semin NuclMed,2007,37(6):420-428.
[10] Clinical Value of18F-ethylcho line-positron emission tomography(PET)combind with endorectal MRI for pre-therapeutic staging of prostate can cen(FEC-PET/MRI)[EB/OL].(2009-09-17).http:clinicaltrials.gov/show/NCT0052046.
[11]吴战宏,王世真,周前,等.18F标记氟乙基胆碱的合成与动物显像[J].中华核医学杂志,2005,25:138-140.
[12] 唐刚华,唐小兰,王明芳,等.18F-胆碱类似物的制备及动物体内分布研究[J].中华核医学杂志,2002,22:172-174.
[13]Pie l M,Bauman A,Baum RP,et al.Im proved automated synthesis of[18F]fluoroethy lcholine as a radiotracer for cancer imaging[J].Bioorganic Med Chem,2007,15:3 171-3 175.
[14]郭莘,戴红峰.18F-胆碱类似物的自动化合成[J].化学工程与装备,2008,6:29-31.
[15] 王明伟,章英剑,张勇平,等.肿瘤分子显像剂18F-氟乙基胆碱的自动化合成[J].核技术,2008,31:859-863.
[16]PascaliG,Antonio LD,Bovone P,et al.Optim ization of automated large-scale production of[18F]fluoroethylcho line for PET p rostate cancer imaging[J].Nucl Med Biol,2009,36:569-574.

