177Lu-EDTMP的药盒法制备、大鼠体内生物分布及显像
李洪玉,梁积新,向学琴,邓新荣,郑德强,罗洪义,陈 阳,刘海春,鲁 佳,罗志福
(1.中国原子能科学研究院 同位素研究所,北京 102413;2.中国核工业北京401医院,北京 102413)
骨转移是恶性肿瘤十分常见的并发症,顽固性的骨痛是骨转移癌在临床上的共同症状,严重影响肿瘤患者的生活质量和预后。利用具有骨靶向性的放射性药物缓解骨转移癌疼痛,是近年来治疗核医学发展最快的领域之一[1]。
EDTMP(乙二胺四甲撑膦酸)可与多种放射性核素形成稳定的亲骨性配合物[2]。目前,临床上用于缓解骨痛应用成熟并行之有效的放射性药物主要是153Sm-EDTMP[3]和89SrCl2。尽管它们在临床上已取得很好的效果,但其应用仍存在一些不利因素。153Sm的主要缺点是其半衰期较短(47 h),在生产和供应时,为弥补衰变带来的损失,要操作大量的放射性,而且往往需对患者进行重复给药;而89Sr的反应截面很低,生产量很小,价格较为昂贵。
177Lu是近年来非常受关注的一个治疗用放射性核素[4],其物理半衰期为6.7 d,较长的半衰期为其生产、产品的质控和远程供货提供了方便;发射能量为176(12.2%)、384(9.1%)和497(78.6%)keV的β粒子,其粒子能量、组织射程、交叉杀伤效应比90Y和188Re低,与目前应用最广泛的治疗用核素131I相当;177Lu还可发射能量为 113(6.4%)、208(11.0%)keV 的 γ射线,可以利用这一特点进行显像;177Lu的另一个重要优点是它可通过176Lu(n,γ)177Lu核反应在反应堆运行过程中生产,并且176Lu具有较高的热中子截面(σth=2 090 b),因此,反应堆制备177Lu具有产率高、比活度高的优点。已有研究[5-6]表明,177Lu-EDTMP是放射性核素治疗的有效形式,可用于缓解骨转移癌引起的骨痛,本研究小组对此也已进行了一些前期研究工作[7],研究了177Lu对EDTMP和DOTMP的标记及标记物在小鼠体内的生物分布,结果表明两者都具有良好的骨靶向性。
实现放射性药物的药盒法制备可以很大程度上简化标记过程,有利于药物的批量稳定化生产。国外早已开展EDTMP的药盒化研究[8];近年来,国际原子能机构(IAEA)的CRP项目开展了177Lu-EDTMP的研究,也主要采用药盒化的制备方法[9]。陶氏化学公司在其研制的153Sm-EDTMP产品中加入了钙[10]用于防止过量的EDTMP进入血液后络合血液中的钙和其他二价、三价金属离子。
为进一步研究177Lu-EDTMP的性能并使其尽快药盒法,本工作拟对加入一定量钙的EDTMP药盒的配方进行优化,采用药盒法制备177Lu-EDTMP,并观察标记物在大鼠体内的生物分布及显像,探讨177Lu-EDTMP作为骨痛治疗药物的体内分布特性。
1 实验部分
1.1 主要仪器与材料
Genesis2000冻干机:美国V irTis公司产品;Mini-Scan放射性薄层扫描仪:美国BioScan公司产品;BS124S电子天平:德国Sartorius公司产品;N2-522 E.CAM 双探头 SPECT:德国西门子公司产品;FH 463A自动定标器,FT-603型闪烁探头:北京核仪器厂产品;CRC15R放射性活度计,美国Capintec公司产品。
天然丰度的Lu2O3:光谱纯(纯度99.99%),美国A lfa Aesar公司产品;EDTMP:美国A lfa Aesar公司产品;Whatman 3MM层析纸:英国Whatman公司产品;其他试剂均为国产分析纯试剂,实验用水均为二次去离子水。
1.2 实验动物
SD大鼠:雄性,30只,体重 200±20 g,清洁级,中国医学科学院实验动物研究所提供。
2 实验方法
2.1 177Lu的制备
以天然丰度的光谱纯Lu2O3(纯度99.99%)为靶材料,在反应堆内辐照。其发生的核反应为176Lu(n,γ)177Lu。
称取适量 Lu2O3置于干净的石英瓶(φ 5mm×20 mm)中,外包铝箔,置于铝制外照射筒内,用氩弧焊密封焊接,沸水浴检漏,合格后入堆照射。堆照条件:反应堆中子注量率为(2~4)×1013/(cm2·s-1),均在同一位置进行辐照,辐照时间约10 d。
辐照后得到177Lu2 O3样品,测量其放射性活度。将177Lu2O3样品倒入25m L圆底烧瓶,加入2.0 m L 6.0 mol/L HCl和1.0 m L 30%H 2O2混合液溶解,然后缓慢加热蒸干,冷却后得到的固体残留物用1.0 m L 0.2 mol/L HC l溶液溶解,得到177LuCl3溶液,将溶液转移至10m L真空瓶中,再次测量样品的放射性活度,并计算回收率。
2.2 EDTMP药盒的冻干实验
根据前期工作[7]和相关报道[9-10],构成EDTMP冻干药盒的关键元素为pH和Ca2+与EDTMP的摩尔比(n(Ca2+)∶n(EDTMP))。pH为影响标记的主要因素,反应溶液pH在7.5~8.5时标记率较高;此外,IAEA的研究工作主要围绕Ca2+与EDTMP摩尔比为1.32的药盒进行[9],而陶氏化学公司153Sm-EDTMP产品中Ca2+与EDTMP的摩尔比则为 0.93[10]。因此,选择了3种不同的Ca2+与EDTMP摩尔比 ,分别为 0.93 、1.00 、1.32;而对每种 Ca2+与EDTMP摩尔比又设计了3种pH,分别为7.5、8.0、8.5。共进行了9种配方EDTMP药盒的冻干,以期从中寻找到更有利于制备及标记的药盒配方。这9种配方列于表1。
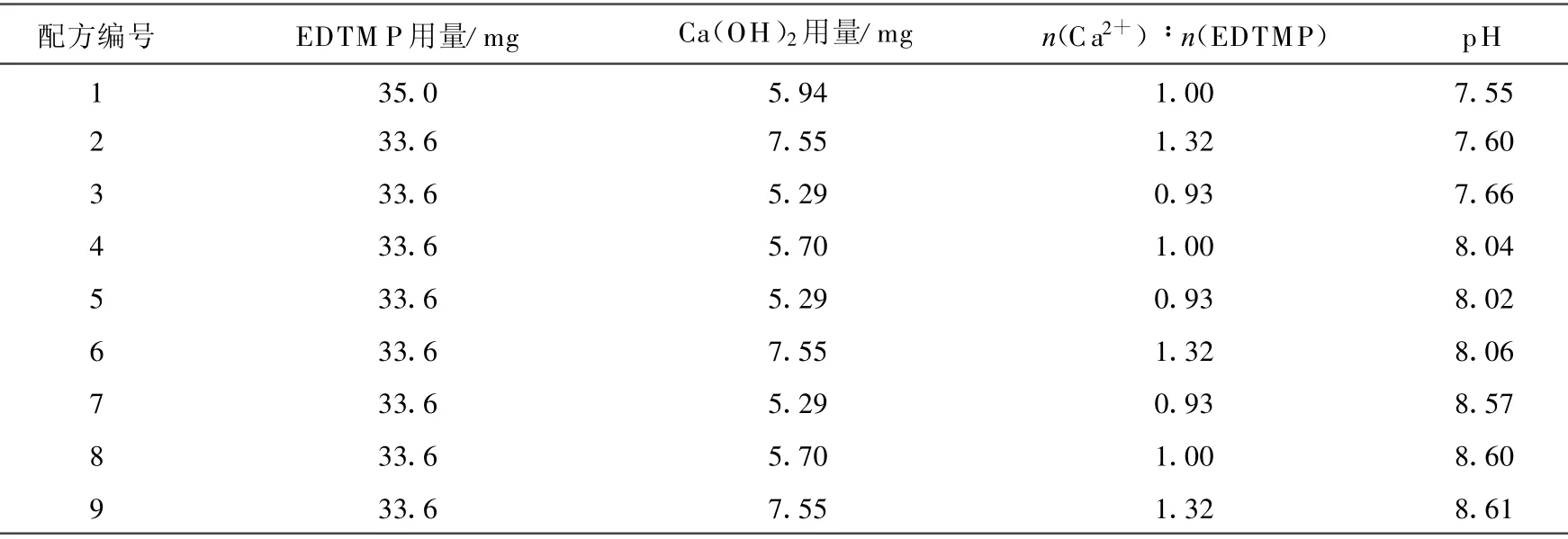
表1 EDTMP冻干药盒的9种配方
药盒的具体制备过程以配方8为例描述如下:向 Ca(OH)2(57.0mg,0.77mmol)和 EDTMP(336mg,0.77 mmol)中加入6 m L注射用水,振荡使其溶解,用 1 mol/L NaOH 溶液调pH至8.6,补加注射用水至总体积为10m L,经0.2μm滤膜过滤,以 1 m L/瓶的量分装入10m L抗生素瓶中;将样品瓶送入冻干机中,低温冷冻干燥约25 h,再经二级干燥15 h,待真空度小于0.665 Pa时,压盖并出机。
2.3 177Lu对药盒的标记
2.1节制备的177LuC l3溶液为酸性,为避免对反应溶液的pH造成较大影响,标记前用1m ol/L NaOH调节177LuCl3溶液的pH为3~4。将177LuCl3溶液以一定比例加入到EDTMP冻干药盒中,反应体积不超过2m L,室温反应1 h。
用纸层析法测定标记率。以新华1号或Whatman 3MM 纸为支持体,以 V(甲醇)∶V(水)∶V(氨水)=50∶50∶2为展开体系。平行测量2次。
2.4 177Lu-EDTMP在正常大鼠体内的生物分布
取EDTMP冻干药盒一支(配方 8:内含EDTMP 33.6 mg,Ca(OH)2 5.7 mg,pH 8.6),用0.4 m L水溶解,加入0.6 m L177LuCl3溶液(82.14 MBq),室温下反应1 h。制备的177Lu-EDTMP用水稀释成放射性浓度为9.25GBq/L的溶液,用于大鼠生物分布实验。
每只SD大鼠尾静脉注射 0.2 m L(约1.85 MBq)177Lu-EDTMP,并于注射后1、3 h,1、2、4、6、11 d处死,取不同脏器称重并测量放射性计数,计算各脏器的放射性摄取率(%ID·g-1)。
2.5 正常大鼠显像实验
SD大鼠每只尾静脉注射 0.2 m L(约11.1 MBq)177Lu-EDTMP,分别在注射后1 h、13 d进行显像,显像前10 min,腹腔注射0.8m L 10%水合氯醛溶液对大鼠进行麻醉。
显像时,177Lu能窗采用113 keV,显像数据在计算机系统128×128矩阵中进行记录与分析。放大1倍,每只采集计数50 000。
3 结果与讨论
3.1 177Lu及EDTMP冻干药盒的制备
反应堆辐照产率:每毫克Lu可得到3.36~5.89 GBq177Lu。177Lu2O3样品化学处理的回收率约为60%。回收率较低的原因主要是辐照的靶件质量较小,一般为2~5 mg,且会附着在石英瓶上而不易被溶解在溶液中。
在药盒制备过程中发现,随着Ca(OH)2投入量的增加,其完全溶解的难度相应增加,溶液配制期间需要不间断搅拌。
经约40 h冻干后,所得冻干品外观良好,为白色片状,所有配方制成的冻干品用0.5 m L水复溶,都能得到澄清的溶液。
3.2 177Lu对药盒的标记
177Lu对药盒的标记结果列于表2。用纸色谱法分析标记液,177Lu-EDTMP的R f为0.7~1.0;游离177Lu3+的 Rf为0.0~0.1。所有配方的药盒在反应体积为0.7~1.5 m L、反应时间为1 h的条件下,标记后放化纯度均>95%。所有标记样品在室温下放置一周(相当于177Lu的一个半衰期)后,放化纯度未见明显下降,均>95%。
由表2可以看出,反应溶液的pH>8(药盒pH为 8.5)时可得到更高的放化纯度;n(177Lu)∶n(EDTMP)增加,放化纯度略有下降;而n(177Lu)∶n(EDTMP)减小,反应达到平衡的时间相应延长,n(177Lu)∶n(EDTMP)=1∶200时,反应时间为1 h时,放化纯度才可>95%。
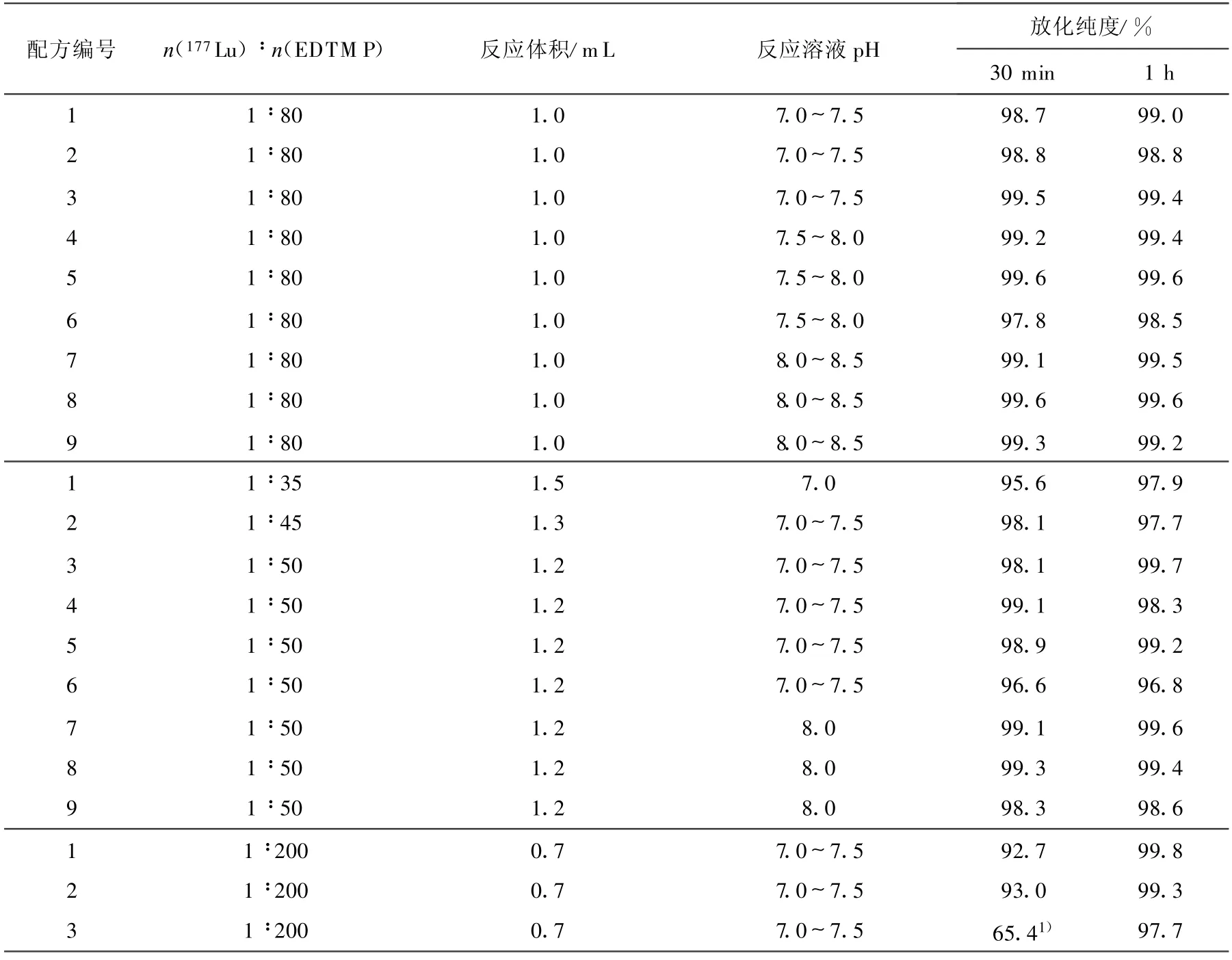
表2 EDTMP药盒的标记实验结果
等条件下,n(177Lu)∶n(EDTMP)=1.32配方的放化纯度略低于其为0.93和1.00时的放化纯度;而且在药盒制备过程中,n(177Lu)∶n(EDTMP)=1.32的配方,其完全溶解较为困难;因此,选择 n(177Lu)∶n(EDTMP)=1的配方,在发挥Ca对过量EDTMP的补偿作用的同时,还可得到较高的放化纯度。pH为8.5的配方(相应反应溶液的pH为8.0~8.5)可得到更高的放化纯度。综合考虑几种因素,选择配方8的药盒(n(177Lu)∶n(EDTMP)=1.00,pH为8.5)作为最优配方。
3.3 生物分布及显像
177Lu-EDTMP在正常大鼠体内的生物分布列于表3。由表3数据可以看出,177Lu-EDTMP表现出良好的生物分布特性,在注药1 h后骨的放射性摄取率>3%ID/g,而且在注药11 d后仍保持在2%以上,说明其骨摄取显著并且在骨中的滞留时间长;注药1 h至2 d后,肾的放射性摄取率一直维持在0.2%ID/g左右,相对其他器官的摄取处于较高水平,说明药物主要经肾清除;注药3 h后,血液及肌肉中的摄取率已接近本底水平,骨与血和骨与肌肉的放射性摄取比(T/NT)均大于200,而且在其它主要器官中无显著摄取,说明其在血液及其它器官和软组织中的清除较快。
注射177Lu-EDTMP 1 h和 13 d(相当于177Lu的两个半衰期)后,正常大鼠的显像结果示于图1。由图1可以看出,注药后1 h膀胱有明显的放射性浓集,说明其主要经泌尿系统排泄;在其他主要器官及软组织中均未见明显浓集,说明其在体内的清除速度较快;在骨骼尤其是关节处的摄取非常显著,注药后13 d,全身骨骼仍清晰可见,而身体其它组织及器官中都已看不到放射性摄取,体现出177Lu-EDTMP作为骨痛治疗药物良好的体内分布及药代动力学性质。
表3 177Lu-EDTMP在正常大鼠体内的生物分布(±s)

表3 177Lu-EDTMP在正常大鼠体内的生物分布(±s)
注:1)n=3;2)n=4
器官注射后不同时间的放射性摄取率/(%ID·g-1)1 h1)3 h1)1 d2)心0.041±0.005 0.013±0.001 0.007±0.001肝0.302±0.051 0.029±0.002 0.037±0.002脾0.610±0.121 0.048±0.006 0.028±0.001肺0.061±0.007 0.024±0.007 0.026±0.005肾0.278±0.051 0.169±0.009 0.186±0.037胃0.047±0.008 0.035±0.007 0.066±0.024小肠 0.033±0.002 0.017±0.007 0.012±0.002肌肉 0.054±0.002 0.014±0.002 0.004±0.001股骨 3.119±0.120 3.178±0.587 3.531±0.263头盖骨 3.801±0.483 3.789±0.275 2.231±0.340血0.026±0.007 0.009±0.008 0.001±0.000器官注射后不同时间的放射性摄取率/(%ID·g-1)2 d1) 4 d1) 6 d2) 11 d1)心0.005±0.002 0.007±0.001 0.005±0.001 0.004±0.001肝0.038±0.001 0.030±0.005 0.019±0.001 0.019±0.005脾0.034±0.002 0.045±0.013 0.033±0.012 0.040±0.022肺0.026±0.005 0.009±0.002 0.006±0.002 0.006±0.003肾0.207±0.050 0.080±0.019 0.056±0.011 0.023±0.002胃0.269±0.119 0.013±0.002 0.014±0.004 0.009±0.003小肠 0.016±0.009 0.014±0.002 0.010±0.002 0.011±0.003肌肉 0.003±0.001 0.006±0.001 0.002±0.001 0.003±0.001股骨 3.505±0.106 3.719±0.247 3.860±0.159 2.975±0.031头盖骨 2.167±0.143 2.377±0.306 2.007±0.360 2.027±0.165血0.001±0.001 0.002±0.001 0.001±0.000 0.003±0.001
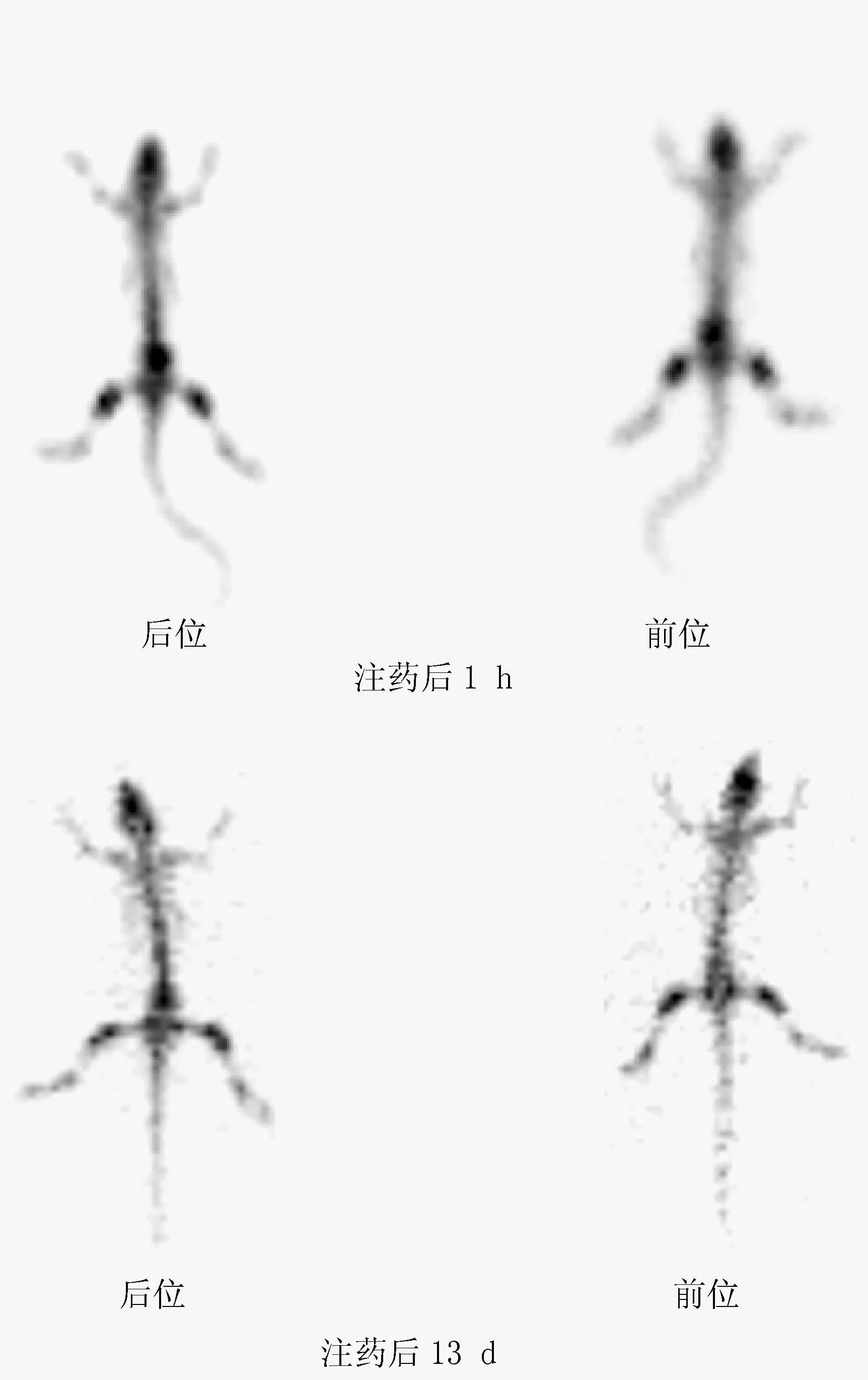
图1 177Lu-EDTMP的显像结果
目前,对177Lu-EDTMP和临床药物153Sm-EDTMP的对比研究进行的还较少,因采用动物种类、实验条件等的不同,导致有些研究结果不具有可比性。在下一步工作中,将对177Lu-EDTMP和153Sm-EDTMP在正常动物体内和骨转移癌模型动物体内的行为进行相应的对比研究。
4 结 论
反应堆堆照天然丰度靶材 Lu2O3制备的177Lu可用于制备177Lu-EDTMP,并得到了满意的结果。自制的 EDTMP药盒成形良好,用于177Lu标记,过程简单,标记率高,并且标记样品的稳定性好。大鼠体内分布及显像结果表明,通过药盒法制备的177Lu-EDTMP主要通过泌尿系统排泄,体内清除速度较快,在动物的主要器官及软组织中未见明显浓集,在骨中的摄取高并且滞留性强。因此,177Lu-EDTMP的药盒法制备是一种切实可行的方法,有利于实现该药物的批量化稳定生产,制得的177Lu-EDTMP具有作为骨痛治疗药物的良好体内分布性质。
致谢:感谢李贵群、张姝荣、胡连生和李春杰等同志给予本工作的支持与帮助。
[1] Wu JS,Monk G,Clark T,et al.Palliative radiotherapy improves pain and reduces functional interference in patientsw ith painful bonemetastases:A quality assurance study[J].Clin Oncol,2006,18(7):539-544.
[2] So la GAR,A rguelles MG,Bottazzini DL,et al.Lutetium-177-EDTMP for bone pain palliation.Preparation,biodistribution and p re-clinical studies[J].Radiochim Ac ta,2000,88(3-4):157-161.
[3] Maini CL,Bergom i S,Romano L,et al.153Sm-EDTMP for bone pain palliation in skeletalmetastases[J].Eur JNuclMed Mol Imaging,2004,31(1):171-178.
[4] Dvorakova Z,Henkelmann R,Lin X,et al.Production of177Lu at the new research reac tor FRMII:Irradiation yield of176Lu(n,gamma)177Lu[J].Appl Radiat Isot,2008,66(2):147-151.
[5] Chak raborty S,Das T,Banerjee S,et al.177Lu-EDTMP:a viable bone pain palliative in skeletal metastasis[J].Cancer Biother Radiopharm,2008,23(2):202-213.
[6] Ando A,Ando I,Tonam i N,et al.177Lu-EDTMP:a potential therapeutic bone agent[J].Nucl Med Commun,1998,19(6):587-591.
[7] 邓新荣,李洪玉,叶肇云,等.177Lu-EDTMP和177Lu-DOTMP的制备及其生物分布[J].同位素,2009,22(2):71-75.
[8] Garnuszek P,Paw lak D,Licinska I,etal.Evaluation of a freeze-d ried kit for EDTMP-based boneseeking radiopharmaceuticals[J].App l Radiat Isot,2003,58(4):481-488.
[9] International A tomic Energy Agency.Developmento f Therapeutic Radiopharmaceuticals Based on177Lu for Radionuclide Therapy:CRP-14054[C]//2nd Research Coordination Meeting.V ienna:International A tom ic Energy Agency,2008.
[10]CYTOGEN Corporation.QUADRAMET4(Samarium Sm 153 Lexid ronam)in jection,suspension[EB/OL](2006-06-20).h ttp://dailymed.nlm.nih.gov/dailymed/fda/fdaDrugXsl.cfm?id=622&type=disp lay.

