3H11的123I标记及其生物分布
秦红斌,尹 卫,高惠波,陈大明,杨 志,祁本忠,金小海,白红升,张文辉
(1.原子高科股份有限公司,北京 102413;2.北京大学临床肿瘤学院,北京肿瘤医院暨北京市肿瘤防治研究所 核医学科,北京 100036)
123I由于其优良的核素性质:发射159 keV的单能γ射线,适于SPECT显像;半衰期只有13.2 h,可以降低对患者与工作人员的辐射损害[1],而成为放射性药物研制中理想的核素之一。123I系高能加速器生产核素,以前在国内应用受到一定限制,但随着高能加速器的市场化,123I的获取更方便,使123I系列药物逐渐成为当今前瞻性诊断药物研究的重要发展方向之一。单克隆抗体能识别特异抗原并与之结合,尤其能识别肿瘤抗原,单抗3H11与胃癌组织具有高阳性反应率、高选择性及高亲和力的特点,受到很多学者的广泛关注。
目前用于 3H11标记的核素主要有125I、131I、211At 、188Re、90Y 等,标记物主要用于胃癌显像或治疗评价[2-9]。国内用123I标记单克隆抗体显像的报道很少,也没有用123I标记胃癌抗克隆抗体3H 11的报道。本研究拟以123I作为显像核素标记单克隆抗体3H 11(McAb 3H 11),并对123I-3H11在正常鼠体内的生物分布进行观察,探讨该标记物作为诊断胃癌及胃癌转移灶显像剂的可能性。
1 主要实验材料
1.1 主要仪器
FT-603井型γ闪烁探头-FH463A智能定标仪:北京核仪器厂产品;AR2130型电子天平:美国OHAUS公司产品;单道可调移液器:美国Eppendorf公司产品;PD-10柱:瑞典 GE Healthcare公司产品;Whatman No.1试纸:英国Whatman公司产品。
1.2 主要试剂
小鼠单克隆抗体3H 11:北京肿瘤研究所惠赠;牛血清白蛋白(Bovine Serum Albumin,BSA):北京博奥森生物技术有限公司产品;Na123I溶液:放射性浓度为 665 GBq/L,原子高科股份有限公司产品。其余试剂均为分析纯,购自北京化学试剂公司。
1.3 实验动物
正常昆明小鼠:15只,雌性,6~8周龄,体重18~22 g,SPF级,购自北京维科利华公司。
2 实验方法
2.1 123I-3H11标记
采用 Iodogen法对 3H 11抗体进行123I标记。在底部涂敷10μg Iodogen的塑料小管中加入100μL 0.2 mol/L磷酸盐缓冲溶液(PBS)、30μL 3H11(1 g/L溶于p H7.4 PBS中)、20μL约13.3 MBq的Na123I,以pH 7.4 PBS控制反应总体积为150μL,室温下不间断匀速震荡反应8 min。将液体取出终止反应,加入100μL 0.01 mol/L PBS荡洗反应管,并将洗涤液合并入反应液中。
2.2 标记率的测定
采用薄层层析法分析标记率。以Whatman No.1试纸为支持体,用 V(甲醇)∶V(水)=85∶15为展开剂。根据所得R f计算标记率。
2.3 123I-3H11的纯化
标记产物采用PD-10柱纯化,用0.01 mol/L PBS(pH 7.4)淋洗。PD-10柱流速要求1 mL(20滴)/min,每分钟接一管,测量各管放射性活度。采用2.2节测标记率的方法测123I-3H11放化纯度。
2.4 123I-3H11的体外稳定性
取50μL纯化后的标记物分别加入到100μL以下 3种体系中:生理盐水、PBS(pH 7.4,0.01 mol/L)、人血清。以下三种环境:4 ℃、室温 、水浴37 ℃下贮存,分别于2、24、48 h取样,纸色层测定放化纯度,观察标记物的稳定性。
2.5 123I-3H11在小鼠体内的生物学分布
选用雌性昆明小白鼠15只,随机分为3组,每组5只。经尾静脉注射0.1 mL123I-3H11(约1.11 MBq,比活度 40 GBq/g),于注射后 2、24、48 h眼球取血,颈椎脱臼处死小鼠。取心、肝、脾 、肺 、肾 、胃 、肠 、肌肉 、骨 、甲状腺等组织称重并测量其放射性计数。经衰变校正后,计算每克脏器的放射性摄取占总注射剂量的百分数(%ID/g)。
3 结果与讨论
3.1 123I-3H11标记条件的优化
3.1.1 Na123I活度对标记率的影响 2.1节中,仅改变反应体系中Na123I活度,观察其对123I-3H11标记率的影响,结果示于图1。由图1可以看出,随Na123I放射性浓度的增大,标记率呈下降趋势,2.3 MBq时最大,为92%;9.5和13.3 MBq时,标记率约 80%。为保证所合成的123I-3H 11能达到一定的比活度,参与反应的Na123I放射性活度不应太小。本实验选用13.3 MBq。

图1 反应体系中Na123 I放射性浓度对标记率的影响
3.1.2 氧化剂Iodogen用量对标记率的影响仅改变2.1节中氧化剂用量,观察其对标记率的影响,结果示于图2。图2表明,氧化剂Iodogen量小于10μg时,标记率随Iodogen量的增加而增大,但Iodogen用量太少,其氧化能力不够,不能使I-被充分氧化成I+;而在Iodogen用量大于40μg后,标记率随Iodogen用量的增加而降低,这主要是由于Iodogen量太多,氧化能力过强,产生高价态的碘,导致标记率减小。因此,选择 Iodogen用量为 10μg。
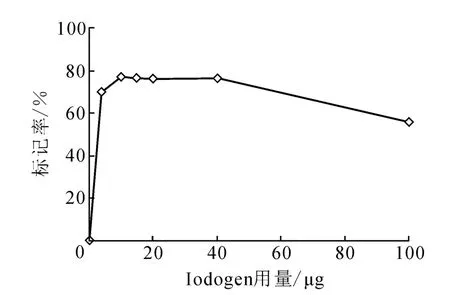
图2 Iodogen用量对标记率的影响
3.1.3 缓冲溶液pH对标记率的影响 2.1节中,改变缓冲溶液p H,其它条件保持不变,观察p H对标记率的影响,结果示于图3。由图3可知,p H对标记率有一定的影响,缓冲溶液pH为7.4~7.6时标记率最高,约为80%。因此,选择缓冲液的p H为7.4。
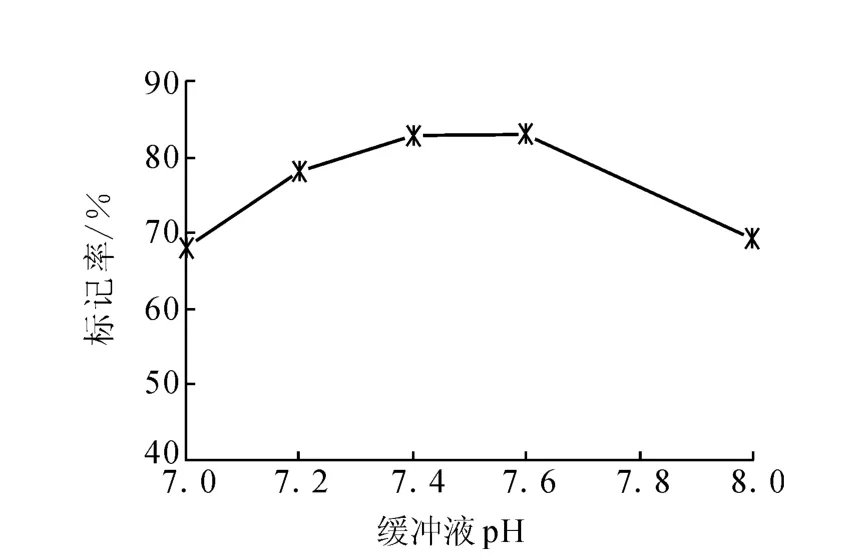
图3 缓冲溶液p H对标记率的影响
3.1.4 标记反应时间的选择 按2.1节方法制备123I-3H11,在不同时间点测标记率,结果示于图4。由图4可知,反应 5 min,标记率达到72%;继续反应到8 min时,标记率达到76%;此后随时间延长,标记率不再有明显变化。反应时间延长对标记率有一定的贡献,但会使单抗的活性降低。因此,选择标记时间8 min。
3.1.5 反应体积对标记率的影响 改变2.1节中反应液的体积,观察其对标记率的影响,结果示于图5。由图 5可知,反应体积为50、150、1 000μL时,标记率分别为 95.1%、89.3%、42.1%。该结果表明,碘化反应标记率与反应体积有关,增大反应体积,标记率呈下降趋势。这是由于反应体积小时,被氧化的123I-与单克隆抗体结合的概率大,标记率高。但反应体积小时有一个缺点,即重现性差。原因可能是,每支反应管中涂层Iodogen位置有差异,反应液体积过小,不能全部盖过涂层,使得每次反应中实际参加的氧化剂量不同,氧化的123I-的量也不同,导致标记率重现性差。但反应体积过大,使单克隆抗体的浓度被稀释,氧化后123I与抗体的取代反应机率变小,标记率低。综合考虑后,选择反应体积为150μL。

图4 反应时间对标记率的影响
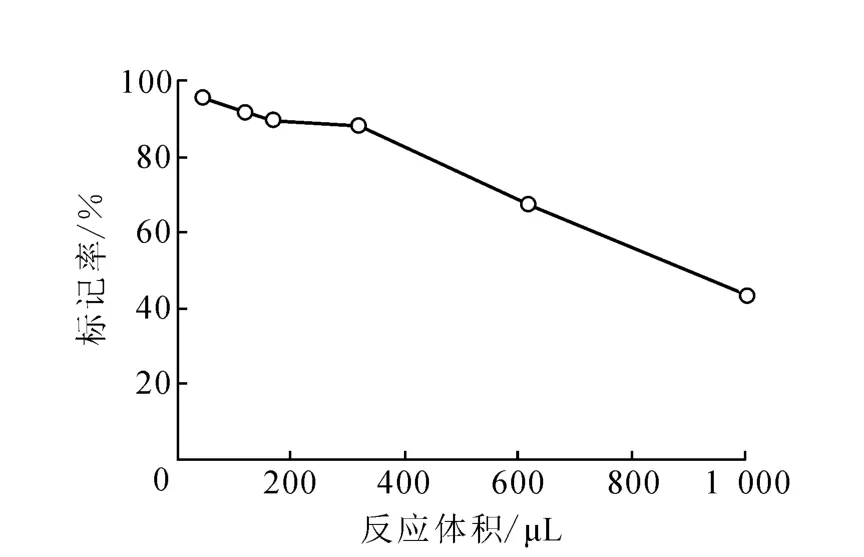
图5 反应体积对标记率的影响
3.1.6 反应温度对标记率的影响 在2.1节方法中,改变反应温度,其它条件不变,观察反应温度对标记率的影响,结果示于图6。从图6中可以看出,反应温度为0℃时,标记率为70%;反应温度为10~20℃时,标记率为73%±2%;反应温度升高到30℃,标记率增加到78%。温度较高易使单克隆抗体的活性下降,因此,选择标记反应在室温下进行。
3.2 最佳条件下的标记
根据上述条件实验,选择最佳标记条件为:Iodogen 10 μg、PBS 的 p H 7.4、单抗 3H 11 30 μg、123I活度 13.3 MBq、反应时间 8 min、室温、总反应体积150μL。在最佳条件下制备标记物,采用薄层层析法分析标记物,123I-3H 11的R f为 0.0~ 0.1;游离碘的R f为 0.7~ 0.9;标记率78.9%;PD-10柱纯化后放化纯度为96.4%。
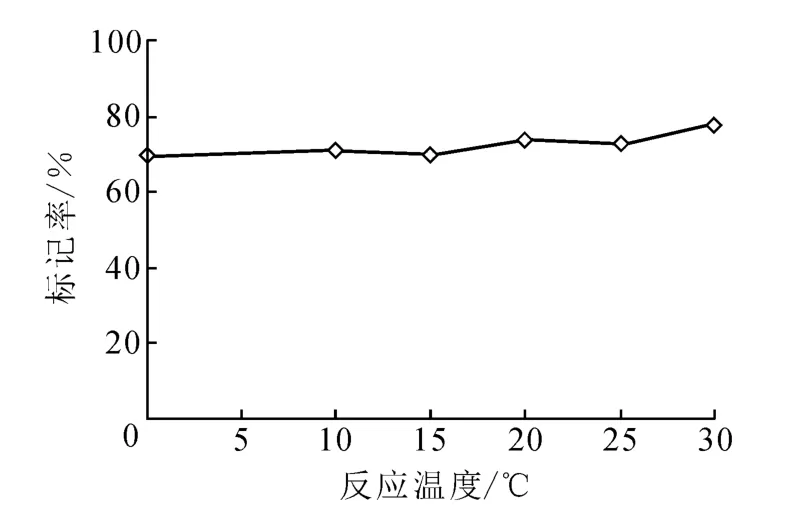
图6 温度对标记率的影响
3.3 123I-3H11的体外稳定性
123I-3H 11在不同体系中、不同温度下的稳定性分别示于图7和图8。由图7可以看出,标记物在人血清、生理盐水和pH 7.4的PBS三种体系中,4℃下放置48 h,标记物的放化纯度仍大于92%,降低小于5%,表明标记物在4℃环境下体外稳定性较好。从图8可以看出,同样在上述三种体系中,37℃下放置48 h,标记物的放化纯度小于90%,降低大于5%。这说明低温适宜此标记物的保存。
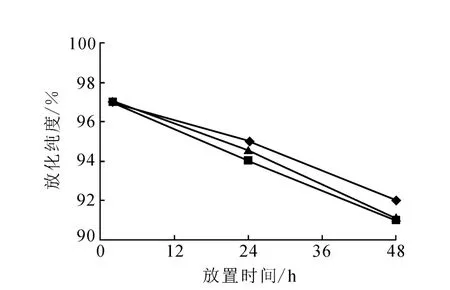
图7 123 I-3H11在 3种介质中4℃贮存时的体外稳定性◆——人血清;□——生理盐水;▲——pH 7.4的 PBS
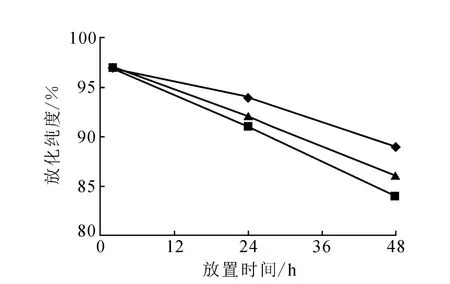
图8 123 I-3H11在 3种介质中37℃贮存时的体外稳定性◆——人血清;□——生理盐水;▲——pH 7.4的 PBS
3.4 正常鼠体内的生物学分布
123I-3H 11在昆明小鼠体内的血液清除时间曲线示于图9,主要脏器的放射性摄取率列于表1。由图9可以看出,123I-3H 11血液清除较快,半清除时间为12.25±0.25 h。由表1数据可以看出,123I-3H11注入初期,血液的初始摄取较高,但清除较快;标记物主要通过肝、肾排泄;123I有亲甲状腺的性质。123I-从123I标记物脱落的结果必然导致123I-在甲状腺富聚。实验数据表明,甲状腺中放射性摄取较其它组织偏高,说明123I-3H 11在体内有脱碘现象,脱落的123I-在动物体内广泛分布。文献[10]报道24 h后123I-大部分经尿排泄,剩下的主要定位于甲状腺,所以游离123I-不会影响模型动物显像。胃组织中有明显的浓聚,这一结果与文献[11]报道的131I-3H 11动物实验数据一致。由于胃组织中有一定的靶细胞BGC823,全抗3H 11进入动物体内,与靶细胞结合,一旦与肿瘤细胞结合,抗体即可停留在肿瘤组织内,而其他组织内的抗体或肿瘤组织内的无关蛋白则很快排泄,这样可降低本底,有利于模型动物显像研究。全抗3H 11相对分子质量较大,在体内的动力学速度较慢,药物在组织浓集的时间较长,一般大于24 h,而123I半衰期与全抗3H 11的代谢时间不相匹配。考虑可采用123I标记 3H11 Fab片段做进一步研究。
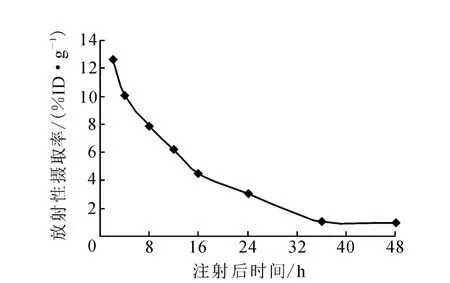
图9 123 I-3H11在正常昆明小鼠中的血液清除曲线
表1 123 I-3H11在正常昆明小鼠体内的生物分布(,n=5)
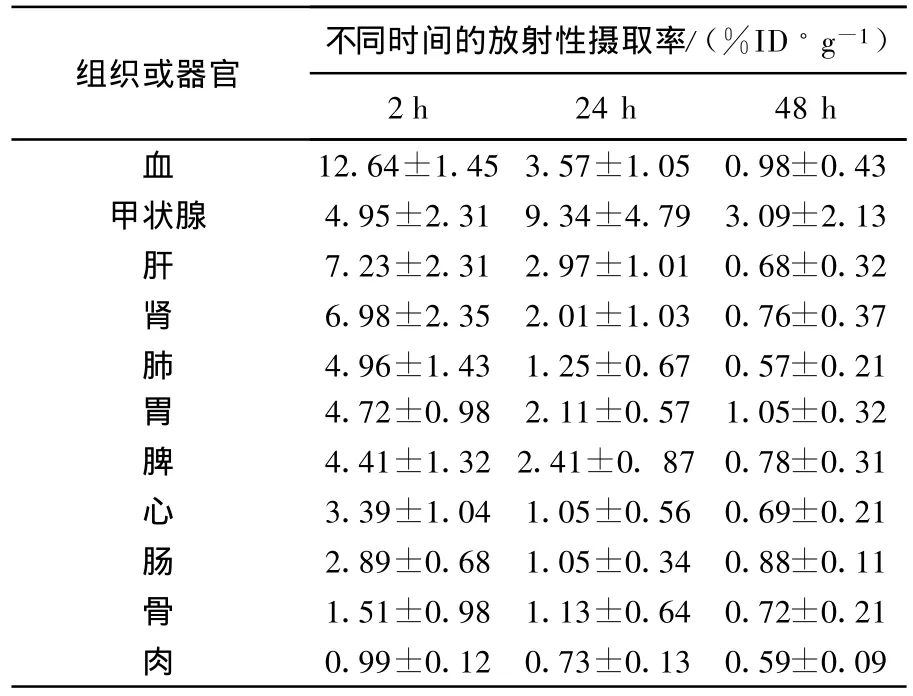
表1 123 I-3H11在正常昆明小鼠体内的生物分布(,n=5)
血12.64±1.45 3.57±1.05 0.98±0.43甲状腺 4.95±2.31 9.34±4.79 3.09±2.13肝7.23±2.31 2.97±1.01 0.68±0.32肾6.98±2.35 2.01±1.03 0.76±0.37肺4.96±1.43 1.25±0.67 0.57±0.21胃4.72±0.98 2.11±0.57 1.05±0.32脾4.41±1.32 2.41±0.87 0.78±0.31心3.39±1.04 1.05±0.56 0.69±0.21肠2.89±0.68 1.05±0.34 0.88±0.11骨1.51±0.98 1.13±0.64 0.72±0.21肉0.99±0.12 0.73±0.13 0.59±0.09
4 结 论
123I-3H 11的放化纯度高,低温下体外稳定性较好;正常昆明小鼠体内分布实验表明,标记物血液清除较快,主要通过肝、肾代谢,胃组织对标记物有表达。因此,123I-3H 11是值得进一步研究的标记物,有望成为胃癌SPECT临床显像剂。
[1] 邓新荣,刘飞,罗志福.123I放射性药物简介[J].中华核医学杂志,2007,27:189-190.
[2] 王川,王怡,苏向前,等.125I标记抗胃癌单克隆抗体3H11在胃癌放射免疫导向手术中的应用[J].中华外科杂志,2000,38:507-509.
[3] 王川,王怡,苏向前,等.125I标记单克隆抗体3H 11在胃癌放射免疫导向手术中的应用的初步研究[J].外科理论与实践,2000,5:163-166.
[4] 吕大鹏,徐光炜,张梅颖,等.131I-3H11腹腔给药对Wistar大鼠肠道吻合口愈合影响的实验研究[J].实用肿瘤杂志,2003,18:299-301.
[5] 刘宁,张叔渊,金建南,等.211At标记单克隆抗体3H11的高效液相色谱分析[J].色谱,1995,13:424-426.
[6] 张叔渊,金建南,刘宁,等.211At标记单克隆抗体3H11及其Fab片段对人胃癌细胞免疫结合和杀伤效应的研究[J].四川大学学报:自然科学版,1997,34:807-812.
[7] 杨志,林保和,韩燕,等.188Re标记胃癌单克隆抗体3H11的研究[C]//第七届全国放射药物与标记化合物学术会议论文摘要汇编.北京:中国核学会同位素分会,1998:76.
[8] 刘文彬,李玉,张汉文.188Re标记单克隆抗体3H11的条件研究及其在荷瘤鼠体内的生物分布[J].同位素,1999,12:208-211.
[9] 张锦明,林琼芳,金小海,等.90Y标记单克隆抗体3H11[J].中华核医学杂志,1993,3:173-175.
[10]王吉欣,卢玉楷,主编.放射性药物学[M].北京:原子能出版社,1995:218.
[11]张梅颖,朱家瑞,许小宝,等.131I标记胃癌单克隆抗体3G9及F(ab/)2片段和3H11在荷人胃癌移植瘤裸鼠体内分布的研究[J].中华核医学杂志,1989,9:154-157.
- 同位素的其它文章
- 小白菜和空心菜体内125I赋存形态探讨及含量分析

