太原地区丙型肝炎病毒基因分型及其临床意义
王 琰 朱新宇 王 霞 王 东
HCV是黄病毒科肝炎病毒属RNA正链病毒,由于HCV基因组的变异性,存在不同基因型,我国几种主要的基因型 1a、1b、2a、2b、3a均有报道[1]。HCV 感染后临床表现程度轻重与所感染基因型有一定关系,1b型较非1b型肝功能损害明显,易导致严重的疾病。研究表明,基因1b型是对干扰素治疗无应答的独立性预测因子[2,3]。1a、2a、3 型对干扰素疗效较好,1b 型几乎没有疗效[4]。由于1b型患者对干扰素治疗的敏感性较低,导致1b型病毒在体内存在时间较长,因长期感染而导致肝硬化和肝癌[5]。本试验选择HCV保守的5’非编码区(5’UTR区)作为扩增片段,采用限制性片段长度多态性分析法(RFLP法)对本组患者进行HCV基因型的检测,了解本地区患者主要基因型,分析基因型与病情的关系。
材料与方法
一、研究对象 收集山西医科大学第一医院感染病科和我院2005年7月~2006年8月住院的丙型肝炎患者62例,男性34例,女性28例,平均年龄49.9±12.2岁。诊断符合2000年9月西安第10次全国传染病与寄生虫病和肝病学术会议修订的《病毒性肝炎防治方案》的标准。其中慢性肝炎轻度14例,中度39例,重度5例,肝硬化4例。病例纳入标准:血清抗-HCV阳性、HCV RNA>80copies/ml,伴或不伴肝功能异常。
二、引物的合成和试剂来源 自Genebank中查找HCV 1a、1b、2b、3a型全序列,查找各型 5’UTR 区共同序列,并以此自行设计引物。外引物:S1(nt34~54):5’-ATCACTCCCCTGTGAGGAAC-3’;S2(nt279~299):5’-CCCTATCAGGCAGTACCACA-3’。内引物:S3(nt39~59):5’-TCCCCTGTGAGGAACTACTG-3’;S4 (nt274~294):5’-TCAGGCAGTACCACAAGGCC-3’。引物由北京奥科生物技术有限责任公司合成。主要试剂来源:Trizol购自北京博迈德科技发展有限公司;Taq DNA聚合酶及dNTP购自上海杰美基因医药科技有限公司;氯仿、异丙醇、乙醇购自北京北化精细化学品有限公司;AMV反转录酶购自Promega公司;HaeⅢ购自TBD生物工程有限责任公司;Bsh1236Ⅰ购自华美生物工程有限公司。
三、HCV RNA提取、AMV反转录 所有入选病例及对照清晨空腹肘静脉采血4ml,12000rpm离心10分钟,取上清,统一置于-70℃冰箱保存待检。采用Trizol法提取上述血清中病毒RNA:取血清30μl加入Trizol溶液、氯仿及异丙醇,经乙醇(预冷)振荡洗涤,提取的RNA保存于-70℃超低温冰箱中,或立即用于逆转录。在 EP 管中依次加入模板 RNA、oligo(dT)16、dNTP mixture、RNase Inhibitor、AMV 及 DEPC 水,离心混匀,42℃保温1小时,95℃保温5分钟后冰上冷却,进行反转录。该反转录得到的cDNA用于PCR扩增。
四、巢式PCR扩增和酶切反应 在EP管中依次加入 cDNA 模板,Taq DNA 聚合酶,10×PCR buffer,上游引物(25mM),下游引物 1μl,dNTP,灭菌去离子水,置PTC-100型PCR扩增仪扩增,经95℃预变性4min,95℃变性 30sec,55℃退火 30sec,70℃延伸 30 sec,70℃延伸5min,进行35个循环后得到第一轮扩增产物。以第一轮反应产物为模板,相同条件下进行第二轮扩增。反应产物鉴定:取第二轮PCR扩增产物,经琼脂糖凝胶电泳,紫外透射仪下观察结果。待在256bp左右出现明显的DNA条带,再进行下一步的酶切反应。取第二轮PCR产物,分别加入19.5μl HaeⅢ和Bsh 1236Ⅰ及buffer溶液,在37℃水浴中孵育2h后,2%琼脂糖凝胶电泳鉴定结果。
五、统计学方法 计数资料采用x2检验,统计数据经SPSS11.5统计软件处理,P<0.05有显著性差异。
结 果
一、HCV基因型分布 结果显示:第二轮扩增产物为 256bp条带;1a及 1b型由 HaeⅢ酶切得到243bp、18bp两条片断,1a型由Bsh 1236Ⅰ酶切得到231bp和25bp两条片断,1b型由1236Ⅰ酶切得到201bp、30bp和 25bp三条片断(图 1);2a型由 HaeⅢ酶切得到 78bp、106bp、56bp和 18bp四条片断,无1236Ⅰ酶切位点(图2);3a型由HaeⅢ酶切得到80bp、158bp和18bp三条片断,由1236Ⅰ酶切得到28bp、203bp和25bp三条片断(图 3);1b/2a混合型如图4。分析结果表明62例丙型肝炎患者中,HCV基因型以1b型为主,占69.4%(43/62),2a型14.5%(9/62),1b/2a型 8.1%(5/62),1a型、3a型各 1例,分别占1.6%,未分型者3例,占4.8%,无2b型,未见有其他型分布。
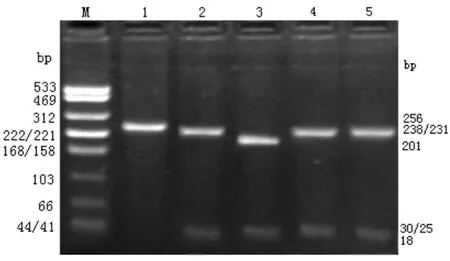
图1 扩增产物的琼脂糖凝胶电泳

图2 扩增产物的琼脂糖凝胶电泳

图3 扩增产物的琼脂糖凝胶电泳
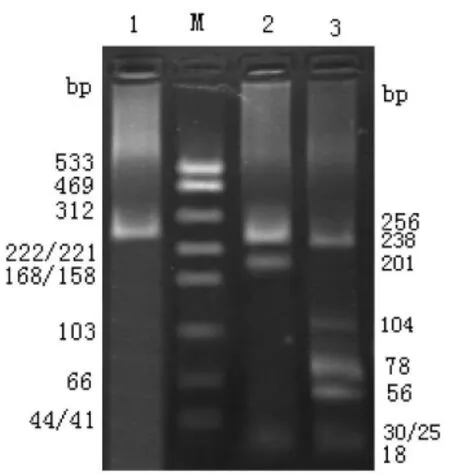
图4 扩增产物的琼脂糖凝胶电泳
二、基因型与患者病情关系 以1b型和其他型病例中不同病情病例所占比例为依据进行“x2检验”,探讨基因型与病情严重程度之间的关系。x2检验表明,1b型与其他型病情构成存在差别(x2=12.54,P<0.005)。结合本资料分析表明:1b型感染所致疾病病情较其他型更为严重。

表1 不同基因型中患者病情的比较
讨 论
HCV基因组变异明显,平均每个位点核苷酸变异频率约10-3/年[1],因此HCV存在不同基因型。自1989年Choo获得首株HCV的基因克隆,并完成了核酸序列测定以来,目前已有许多关于HCV全序列及部分序列的报道。目前,根据Simmonds分型系统全世界范围内已克隆到的分离株可分为6个基因型,68个亚型[6]。本实验采用了对较为保守的5’UTR区进行RFLP法分型,该区对1a~6a不同基因型的cDNA均能获得良好的扩增效果[7]。不同地区HCV基因分布有所差异,欧美国家以1a为主,亚洲包括我国以1b型为主,我国几种主要的基因型 1a、1b、2a、2b、3a均有报道[1]。本试验所得结果与国内报道相近[8]。本次试验检测HCV基因型结果显示1b型占优势,2a型次之,其次是1b/2a混合型,并检出1a和3a型各一例。该结果与吴立平[9]等人的研究结果相似。另有3例未检出者,可能是本实验未涉及到的其它基因型,也可能是由于RNA污染或其他技术上的问题,有待进一步完善。
1b型有较高的复制能力和血清反应性,较强的肝细胞损害作用及较低的IFN治疗反应性等[1]。本实验中,1b型患者中度及重度和肝硬化中比例较高,分别占到84.6%和55.6%,而9例2a型患者轻度7例,中度1例,重度1例,主要为轻中度患者,5例1b/2a混合型患者2例为中度,3例为重度及肝硬化,另有1a型1例为轻度,3a型1例为轻度。中重度患者多为1b型,该型患者病情较重,且较易发展为肝硬化。该结果与Delice D等研究结果相同,HCV基因型与特定的组织病理学程度、肝脏炎症程度相关[10]。
我们的研究结果与其他地区的检测结果相似,这对当地丙型肝炎患者的治疗和预后判断有一定的指导意义。本研究的不足之处在于:样本例数较小,研究对象以慢性肝病为主,缺乏无症状患者及重型肝病患者,有必要扩大样本量,选择人群资料进一步研究。HCV基因型可以预测IFN对HCV的抗病毒治疗效果[11~12]。HCV基因型也可指导患者干扰素治疗所需的疗程[13~14]。因此,治疗前检测HCV基因型有重要的临床意义。
[1]中华医学会传染病与寄生虫病学会肝病学会.病毒性肝炎防治方案 [J].中华肝脏病杂志,2000,8(6):324-329.
[2]NONEZ M.Brief report role lf hepatitis C virus genotype in the development of severe transaminase elevation after the introduction of antiretroviral therapy[J].J Acquir Immune Defic Syndr,2002,30:65-68.
[3]赵桂珍,安萍,黄芬.丙型肝炎病毒基因型及其病毒RNA定量与干扰素疗效的关系[J].中国医科大学学报,2000,12:445-446.
[4]DAVIS GL,LAU JY,URDEA MS,et al.Quantitative defection of hepatitis C virus RNA wish a solid phase signal amplification method:definition of optimal conditions for specimen collection and clinincal application in interferon-treated patients[J].Hepatology,1994,19:1337-1341.
[5]CLUCK T.Parameters predicting response to alpha-interferon treatment in chronic hepatitis C[J].Hepatogastroenterology,1997,44:484-491.
[6]SIMMONDS P,BUKH I,COMBET C,et al.Consensus proposals for a system of nomenclature of nomenclature of hepatitis C virus genotypes[J].Hepatology,2005,42:962-973.

