激光共聚焦技术证实HCV NS5在人胎盘滋养层细胞的定位表达*
聂青和 程勇前 黄晓峰 张亚飞 罗新栋 杨家骥 杨艳红
自1989年丙型肝炎病毒(HCV)基因组克隆成功后,人们对其基础、流行病学、临床诊断和治疗的研究已十分深入[1]。HCV感染在全世界估计约1.7亿人[2],HCV在我国一般人群中的感染率约为3.2%。中国约有3700万~4000万感染者。丙型肝炎常进展为肝硬化和肝细胞癌。HCV的经典传播途径为经血液或血液制品传播,但1991年后献血员HCV的筛检已使输血后丙型肝炎大为减少[3]。现研究认为HCV存在母婴传播[4,5],在HCV感染的母亲中,HCV母婴传播发生率大约为5%左右[6,7],但目前尚无有效的方法阻断这种传播。因此,HCV的母婴传播将可能成为未来HCV感染的重要途径[8,9]。丙型肝炎疫苗尚难以用于人体预防HCV感染[10],因此阻断HCV母婴传播的研究工作显得十分重要。目前,有关HCV母婴传播的研究多数为流行病学调查[11],关于HCV如何在母婴间进行传播的具体机制尚不清楚,可能为宫内传播、出生时传播和出生后通过母乳、唾液传播等,而宫内感染可能是主要机制之一[12,13]。本研究用HCV RNA阳性血清感染体外培养的人胎盘滋养层细胞,并运用激光共聚焦技术观察人滋养层细胞感染HCV后的特性,探讨HCV NS5在滋养层细胞中的定位表达,为进一步深入研究HCV的母婴传播分子机制奠定实验基础。
材料与方法
一、单细胞悬液的制备 取剖腹产术后的无菌胎盘组织,将绒毛组织剪碎至1~3mm3,以0.25%胰蛋白酶液及 20u/ml DNaseⅠ于 37℃恒温摇床内消化30min,消化产物经100目不锈钢筛网过滤后,滤液加入预先加有5ml小牛血清的50ml离心管内,1000rpm离心10min,弃上清,DMEM培养液重悬沉淀。
二、Percoll密度梯度制备 用9.0%NaCl与Percoll以1:9混合,以达到生理性渗透压,再以0.9%NaCl稀释为45%和35%两个浓度,按浓度从大到小将两个不同密度的Percoll溶液逐层缓慢加入10ml离心管内,每个浓度3ml。Percoll细胞分离液为美国Pharmacia公司产品(No:05-59-16-001A)。
三、细胞的纯化与培养 将收集的细胞悬液2ml缓慢加于Percoll分离液上层,以2500rpm离心20min,用吸管小心吸取云雾状的中层,置于50ml离心管内,DMEM稀释4倍,1000rpm离心10min,弃上清,以含20%胎牛血清DMEM培养液重悬沉淀,将细胞悬液浓度调整至5~6×109/L,置于培养瓶或预先置有盖破片的六孔培养板内37℃,5%CO2孵箱内培养。
四、免疫细胞化学染色 将细胞爬片固定后,用ABC法进行细胞角蛋白、波形蛋白染色。胎盘组织切片脱蜡至水后用ABC法进行细胞角蛋白、波形蛋白染色。免疫组织化学染色用ABC试剂盒购自华美生物工程公司,所用抗细胞角蛋白(No:C8541)及波形蛋白抗体(No:MU074-UC)购自宝泰克生物工程公司。抗HCV NS5单克隆抗体购自宝泰克生物工程公司。
五、HCV体外感染试验 选择抗HCV阳性血清,HCV RNA 为6.1×107copies/ml,经血清学检测甲、乙、丁、戊型肝炎病毒标志物均为阴性,另选正常人血清作为阴性对照。以含20%丙型肝炎患者血清的DMEM培养液感染体外培养24h后的滋养层细胞,同时以含20%正常人血清的DMEM培养液作为阴性对照,37℃,5%CO2孵箱内培养24h,倒置显微镜下观察,弃去感染血清,PBS充分洗涤5次后加入新鲜培养液,留取最后一次洗液待检,以后每2天换液一次,留取培养上清待检。
六、培养上清HCV RNA定性及定量检测 为保证试验的可靠性,分别采用RT-PCR及扩增敏感试验(Amplisensor assay)对培养上清HCV RNA进行定性及定量检测,简言之,定性检测:提取HCV RNA,加入逆转录反应体系,37℃,30min:预变性 94℃,300sec,第一次 PCR 循环,94℃ 45sec,50℃ 45sec,72℃ 45sec循环 35次,终延伸 72℃,300sec;取 2μl第一次循环后的产物加入第二次PCR反应缓冲液23μl;预变性94℃ ,300sec, 第 二 次 PCR 循 环 ,94℃ 45sec,55℃45sec,72℃ 45sec循环 35 次,终延伸 72℃,300sec;取扩增产物15μl加样于含溴化乙锭的2%琼脂糖凝胶,于1×TAE缓冲液中在60v电压下电泳15~20min。根据试剂盒说明,紫外灯下观察225bp处有荧光者为阳性;定量检测:提取HCV RNA,加入逆转录反应体系,37℃ ,45min: 预 变 性 90℃ ,2min,PCR 循 环 ,95℃25sec,60℃ 35sec,72℃ 45sec 循环 20 次,终延伸72℃,30sec,10℃保温 1h;计算机读取数值,>102者为阳性。HCV RNA荧光定量检测试剂盒购自美国Acegene公司。
七、电镜标本制作及激光共聚焦显微镜检查 细胞培养40d后以0.25%胰蛋白酶分别消化感染组及对照组贴壁生长的细胞,PBS洗涤一次,2000rpm离心20min,4%戊二醛固定过夜,送本校电镜室。所用激光共聚焦显微镜型号为 MRC-1024(BioRad,Watford,UK),固定在含Plan-Ne-ofluar 40x油浸镜(数值孔径为 3.53)的显微镜(Zeiss,Gena,Germany)上,用多线氩离子激光束(25mW)在488nm激发荧光素(FITC)。这些措施使得在高放大倍数下对微弱的标记物能产生敏锐的荧光信号。共聚焦系统由Bio-Rad公司提供的软件控制,在IBM计算机上运行。
结 果
一、滋养层细胞体外生长特性观察 在倒置显微镜下观察,中层细胞以单个核细胞为主,培养3h后开始贴壁,18h后基本全部贴壁,贴壁细胞多呈上皮细胞样生长,形态多样,个别细胞呈纤维细胞样。24h后开始出现多个核细胞,并随时间推移逐渐增大,成片生长。HCV感染后,感染组及对照组细胞光镜下观察未见明显不同。
二、免疫细胞化学染色结果 细胞爬片染色阳性信号为棕黄色颗粒,结果显示,90%以上细胞的细胞角蛋白染色阳性,阳性信号定位于细胞浆,而波形蛋白染色仅个别细胞可见阳性信号(图1,2)。

图1 滋养层细胞角蛋白表达(免疫荧光染色,×100)

图2 滋养层细胞波形蛋白表达(免疫荧光染色,×100)
三、免疫荧光染色结果 HCV感染后的滋养层细胞,经抗-HCV NS5染色阳性,阳性信号为黄绿色或黄色荧光,主要定位于细胞核周。正常对照标本的滋养层细胞抗-HCV NS5染色未见黄绿色或黄色荧光,因伊文蓝衬染而呈现红色。
四、激光共聚焦观察 HCV感染后的滋养层细胞抗HCV NS5染色阳性信号为黄绿色或黄色荧光,主要定位于细胞核周(图3)。

图3 HCV感染的滋养层细胞抗HCV NS5阳性(激光共聚焦,×1059)
五、培养上清HCV RNA表达 见图4和表1。
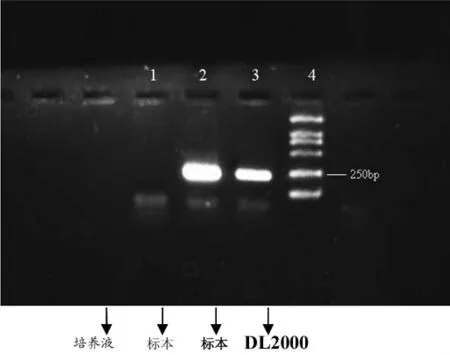
图4 培养上清HCV RNA定性检测结果

表1 培养上清HCV RNA定量和定性检测结果
讨 论
胎盘是胎儿与母体之间进行物质交换的重要器官,由滋养层细胞、毛细血管内皮细胞以及二者之间基膜所构成的胎盘屏障组成,是营养物质以及某些药物、病毒、激素等从母体进入胎儿的必经之路,而滋养层细胞是胎盘屏障的第一道防线。合体滋养层细胞还具有重要的内分泌功能,体外分离培养滋养层细胞是研究其功能及母体与胎儿之间物质交换的具体分子机制的细胞学基础[14]。本研究在Kliman等[15]建立的Percoll不连续密度梯度分离纯化方法的基础上作如下改进:将分离细胞的密度梯度简化为两层。Kliman等用14个不连续Percoll分离密度梯度进行分离,并确定滋养层细胞在Percoll中所处的密度值为1048~1062g/L,而Cordon等[16]用连续密度梯度观察其密度值为 1053~1060g/L,以此为依据并根据美国Pharmacia公司提供的Percoll使用说明书中不同稀释度的Percoll在0.15M(0.9%)盐溶液中相应的密度值曲线,将分离梯度简化为两层,即35%(密度值为1043g/L)与45%(密度值为1062g/L),以使所要分离的滋养层细胞处于两层之间,这样既节约了实验试剂,又简化了操作步骤。
许多学者研究证实,在胎盘绒毛组织中细胞角蛋白染色阳性的仅为细胞滋养层细胞及合体滋养层细胞[17,18]。本研究培养细胞爬片经免疫组化染色结果显示,细胞角蛋白染色阳性者占90%以上,证明改进后的分离方法同样可以得到满意的分离效果。
目前,HCV感染靶细胞的方式主要有血清直接感染法、脂质体介导法、电穿孔法及真核细胞表达载体携带法等[19,20]。直接感染法是HCV感染细胞的主要方法,即把丙型肝炎患者血清直接加到培养细胞中进行感染,37℃温育不同时间后,更换新鲜培养液,在不同时相检测细胞及其培养上清HCV RNA。RT-PCR用于直接检测培养上清及细胞中HCV正链及负链RNA,可直观反映HCV在感染细胞中的复制情况。该方法简便,特异性好,但培养液中残留的HCV感染物可能会出现假阳性结果。
本研究参照国外学者[21,24]用HCV感染体外培养细胞的方法,对滋养层细胞进行感染试验。经定性及定量RT-PCR双重检测,证明了实验的可靠性。结果表明,感染前及感染后洗液及对照组中HCV RNA检测均为阴性,排除了标本来源及HCV感染试验时培养液中残留的HCV感染物污染的可能[25,26]。在感染后16天的培养上清中间断检测到了HCV RNA。HCV RNA定性检测结果为阳性的标本HCV RNA定量检测大于105copies/ml,证实HCV可以感染胎盘滋养层细胞,HCV能否在滋养层细胞中复制尚有待进一步研究。HCV NS5为HCV非结构蛋白之一,目前对其功能研究的较为明确,HCV NS5主要表达RDRP,参与HCV的复制,并具有外周核定位功能,提示HCV的复制位于核周围的内质网膜上。用抗-HCV特异性McAb NS5,采用间接免疫荧光法直接检测感染细胞内特异性抗原的表达情况,并用激光共聚焦方法观察发现,HCV NS5主要在核周表达。感染HCV的人滋养层细胞中存在HCV NS5表达。这些改变为HCV感染滋养层细胞提供了形态学依据[27],也为进一步深入研究HCV的母婴传播分子机制奠定了实验基础。
[1]聂青和.加强病毒性肝炎的基础与临床研究[J].胃肠病学和肝病学杂志,2007,16:95-99.
[2]COOKE GS,MAIN J.Improving the treatment of hepatitis C infection in the UK[J].Expert Opin Pharmacother,2007,8:183-191.
[3]罗新栋,聂青和,何云,等.检测抗-HCV IgG κ/λ轻链比值及其临床意义[J].中国医师杂志,2004,6:32-36.
[4]EUROPEAN PAEDIATRIC HEPATITIS C Virus Network.A significant sex-but not elective cesarean section-effect on mother-to-child transmission of hepatitis C virus infection[J].J Infect Dis,2005,192:1872-1879.
[5]张亚飞,聂青和.HCV垂直传播的危险因素分析[J].肝脏,2006,11:146-148.
[6]聂青和,周永兴,王平忠.丙型肝炎病毒感染孕妇羊水中HCV RNA检测的临床意义 [J].中华妇产科杂志,2002,37:19-21.
[7]程勇前,聂青和,周永兴.丙型肝炎病毒母婴传播机制研究[J]. 世界华人消化杂志,2002,10:445-447.
[8]聂青和,程勇前.妊娠合并乙型肝炎、丙型肝炎的母婴传播机制及预防进展(专题笔谈)[J].中国实用妇科与产科杂志,2004,20:72-75.
[9]MARTINETTI M,PACATI I,CUCCIA M,et al.Hierarchy of baby-linked immunogenetic risk factors in the vertical transmission of hepatitis C virus[J].Int J Immunopathol Pharmacol,2006,19:369-378.
[10]聂青和,罗新栋.丙型肝炎疫苗研究及面临的挑战[J].世界华人消化杂志,2004,12:2405-2409.
[11]SHEBL FM,EL-KAMARY SS,SALEH DA,et al.Prospective cohort study of mother-to-infant infection and clearance of hepatitis C in rural Egyptian villages[J].J Med Virol,2009,81:1024-1031.
[12]张亚飞,聂青和,邵彬,等.丙型肝炎病毒持续感染对体外培养人胎盘合体滋养层细胞生物学性状的影响[J].医学研究生学报,2006,19:114-116.
[13]张亚飞,聂青和,邵彬,等.丙型肝炎病毒持续感染对体外培养人胎盘合体滋养层细胞MMP-2和MMP-9合成分泌的影响 [J].第四军医大学学报,2006,27:1949-1952.
[14]成令忠.组织学与胚胎学[M].北京:人民卫生出版社,1989:255-259.
[15]KLIMAN HJ,NESTLER JE,SERMASI E,et al.Purification,characterization,and in vitro differentiation of cytotrophoblasts from human term placentae [J].Endocrinology,1986,118:1567-1582.
[16]GORDON CD,BARRY FK.Isolation of pure villous cytotrophoblast from term human placenta using immunomagnetic microspheres[J].J Immun Med,1989,119:259-268.
[17]CLARKLARK RK,DAMJANOV I.Intermediate fila -ments of human trophoblast and choriocarcinoma cell lines[J].Virchows Arch A Pathol Anat Histopathol,1985,407:203-208.
[18]VETTENRANTA K,VON KOSKULL H,HEIKINHEIMO M,et al.Cytoskeletal markers and specific protein production in cells cultured from human first and third trimester placentae[J].In Vitro Cell Dev Biol,1986,22:100-106.
[19]聂青和.丙型肝炎病毒母婴感染研究及其预防现状(述评)[J].世界华人消化杂志,2005,13:1257-1262.
[20]程勇前,聂青和,周永兴,等.体外感染丙型肝炎病毒的滋养层细胞超微结构变化 [J].中华妇产科杂志,2003,38:28-29.
[21]IACOVACCI S,MANZIN A,BARCA S,et al.Molecular characterization and dynamics of hepatitis C virus replication in human fetal hepatocytes infected in vitro[J].Hepatology,1997,26:1328-1337.
[22]KAITO M,WATANABE S,TSUKIYAMA-KOHARA K,et al.Hepatitis C virus particle detected by immunoelectron microscopic study[J].J Gen Virol,1994,75:1755-1760.
[23]CHOO SH,SO HS,CHO JM,et al.Association of hepatitis C virus particles with immunoglobulin:a mechanism for persistent infection[J].J Gen Virol,1995,76:2337-2341.
[24]WATSON JP,BEVITT DJ,SPICKETT GP,et al.Hepatitis C virus density heterogeneity and viral titre in acute and chronic infection:a comparison of immunodeficient and immunocompetent patients[J].J Hepatol,1996,25:599-607.
[25]程勇前,聂青和,周永兴,等.人胎盘滋养层细胞的分离培养及IgGFcγRⅢ在人胎盘组织中的表达 [J].医学研究生学报,2002,15:105-107.
[26]程勇前,聂青和,周永兴,等.人滋养层细胞分离培养及HCV体外感染试验 [J].第四军医大学学报,2002,23:1544-1547.
[27]程勇前,聂青和,周永兴.丙型肝炎病毒超微结构研究进展[J]. 世界华人消化杂志,2003,11:233-237.

