以温度为自变量的平衡图像题解题策略研究



摘 要:近年来,江苏高考卷以及江苏赛区化学奥林匹克初赛卷多次出现以温度为自变量,转化率、产率或选择性为因变量的平衡图像题.本文指出此类图像题的认识误区,引导学生正确判断平衡点与非平衡点,合理解释并预测曲线变化趋势,明确竞争反应体系转化率、选择性和产率之间的关系,提出相关的解题策略.
关键词:温度自变量;平衡图像题;解题策略
中图分类号:G632"" 文献标识码:A"" 文章编号:1008-0333(2024)19-0129-04
2019-2023连续五年江苏高考卷以及近年来中国化学奥林匹克(江苏赛区)初赛卷,均涉及以温度为自变量的平衡图像题.试题考查学生获取图表信息的能力、综合运用化学用语的能力、文字表述能力以及逻辑推理能力,很好地体现了“宏观辨识与微观探析”“变化观念与平衡思想”等化学核心素养.
1 单一反应体系转化率随温度变化图像认识误区分析
1.1 例题呈现
典例1 (2019年江苏高考15题)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图1中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化).下列说法正确的是(" ).
A.反应2NO(g)+O2(g)2NO2(g)的ΔHgt;0
B.X点所示条件下,延长反应时间能提高NO转化率
C.Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数Kgt;2 000
1.2 误区分析
对本题的理解存在三大误区:一是将此类题目看作在同一个容器中进行的连续升温反应;
二是认为类似X这样先升后降的曲线,最高点即为平衡点;三是仅从热力学或动力学的单一视角解读曲线图像.
依次纠正以上三大误区:
第一,这类图像描述的并不是同一个容器中进行的连续反应,正确的理解应是控制在不同温度条件下,反应相同时间进行的对比实验,借助若干实验数据点计算模拟后得到的曲线图;
第二,最高点不一定是平衡点,由本题给出的信息可知,实线X与虚线Y重合的点才是平衡点,约250~300 ℃之间,NO转化率低于平衡时转化率的原因可能是催化剂的活性弱,反应速率慢,反应未达到平衡状态;
第三,曲线上的非平衡点主要从动力学视角解释,平衡点主要从热力学视角解释.
2 分步反应体系转化率随温度变化趋势的解释与预测
2.1 例题呈现
典例2 [第37届中国化学奥林匹克(江苏赛区)初赛18题(部分)]深入研究碳、氮元素的物质转化有着重要的实际意义.N2O、CO在Pt2O+的表面进行两步反应转化为无毒的气体,其相对能量、反应历程如图2所示.
Ⅰ.N2O(g)+Pt2O++(g)N2(g)+Pt2O2+(s)
ΔH1
Ⅱ.CO(g)+Pt2O+2(g)CO2(g) +Pt2O+(s)
ΔH2
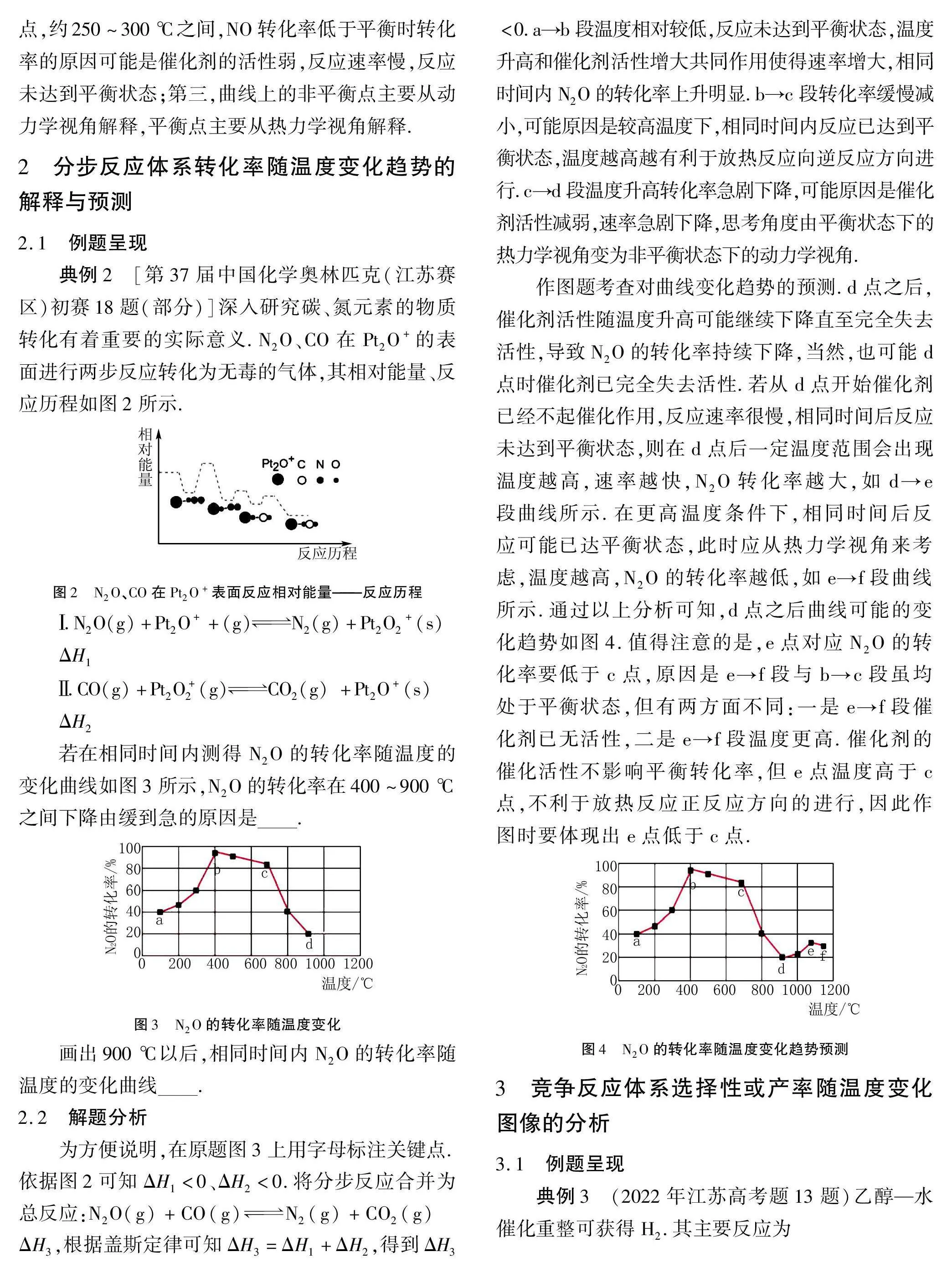
若在相同时间内测得N2O的转化率随温度的变化曲线如图3所示,N2O的转化率在400~900 ℃之间下降由缓到急的原因是.
画出900 ℃以后,相同时间内N2O的转化率随温度的变化曲线.
2.2 解题分析
为方便说明,在原题图3上用字母标注关键点.依据图2可知ΔH1lt;0、ΔH2lt;0.将分步反应合并为总反应:N2O(g)+CO(g)N2(g)+CO2(g) ΔH3,根据盖斯定律可知ΔH3=ΔH1+ΔH2,得到ΔH3lt;0.a→b段温度相对较低,反应未达到平衡状态,温度升高和催化剂活性增大共同作用使得速率增大,相同时间内N2O的转化率上升明显.b→c段转化率缓慢减小,可能原因是较高温度下,相同时间内反应已达到平衡状态,温度越高越有利于放热反应向逆反应方向进行.c→d段温度升高转化率急剧下降,可能原因是催化剂活性减弱,速率急剧下降,思考角度由平衡状态下的热力学视角变为非平衡状态下的动力学视角.
作图题考查对曲线变化趋势的预测.d点之后,催化剂活性随温度升高可能继续下降直至完全失去活性,导致N2O的转化率持续下降,当然,也可能d点时催化剂已完全失去活性.若从d点开始催化剂已经不起催化作用,反应速率很慢,相同时间后反应未达到平衡状态,则在d点后一定温度范围会出现温度越高,速率越快,N2O转化率越大,如d→e段曲线所示.在更高温度条件下,相同时间后反应可能已达平衡状态,此时应从热力学视角来考虑,温度越高,N2O的转化率越低,如e→f段曲线所示.通过以上分析可知,d点之后曲线可能的变化趋势如图4.值得注意的是,e点对应N2O的转化率要低于c点,原因是e→f段与b→c段虽均处于平衡状态,但有两方面不同:一是e→f段催化剂已无活性,二是e→f段温度更高.催化剂的催化活性不影响平衡转化率,但e点温度高于c点,不利于放热反应正反应方向的进行,因此作图时要体现出e点低于c点.
3 竞争反应体系选择性或产率随温度变化图像的分析
3.1 例题呈现
典例3 (2022年江苏高考题13题)乙醇—水催化重整可获得H2.其主要反应为
C2H5OH(g) +3H2O(g)2CO2(g)+6H2(g)
ΔH=173.3 kJ·mol-1
CO2(g)+H2(g)CO(g) +H2O(g)
ΔH=41.2 kJ·mol-1
在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)= 1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图5所示.
CO的选择性=n生成(CO)n生成(CO2)+n生成(CO)×100%,下列说法正确的是(" ).
A.图中曲线①表示平衡时H2产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大n(C2H5OH)/n(H2O)可提高乙醇平衡转化率
D.一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率
3.2 解题分析
由本题描述可知图像上的点均为平衡点,应从影响平衡移动因素的视角来分析图像.体系中主要发生的两个反应为连续反应,将反应②方程式系数乘以两倍,与反应①合并约去CO2,得到反应③,解决问题时可看作体系中发生①和③的竞争反应,方程式如下:
①C2H5OH(g)+3H2O(g)2CO2(g)+6H2(g)
ΔH1=173.3 kJ·mol-1
③C2H5OH(g)+H2O(g)2CO(g)+4H2(g)
ΔH3=255.7 kJ·mol-1
由CO的选择性表达式可知,CO与CO2的选择性之和为1,存在此增彼消的关系,推得①线和③线是选择性曲线,②线是H2的产率曲线,故A项错误.
为加深对转化率、选择性和产率相互关系的理解,可以从数量关系上列式表达三者的联系.设反应开始时通入C2H5OH(g) 1 mol,H2O(g) 3 mol,平衡时C2H5OH的转化率为a,CO的选择性为b,H2的产率为c,尝试建立a、b、c三者之间的联系:c=
n(H2)实际生成n(H2)理论生成×100%=4ab mol+6a(1-b)mol6 mol×100%=a(3-b)3×100%,若b不变,a增大,则c增大;若a不变,b增大,则c减小.通过以上数据分析,明确了平衡时H2产率受到C2H5OH转化率和CO选择性的双重影响,②线前半段曲线显示,在约300 ℃之前,温度升高,C2H5OH转化率增大可能是H2产率增大的主要原因,选择性变化导致的产率变化可能是次要原因,并不能判断CO的选择性曲线是①线还是②线.在约300 ℃之后,随温度升高,C2H5OH平衡转化率增大,会导致H2产率增加,而②线却呈现下降趋势,说明随温度升高,CO的选择性上升导致H2产率降低,且选择性对H2产率的影响大于转化率的影响,由此判断③线为平衡时CO的选择性曲线,B项正确.
4 以温度为自变量的平衡图像题解题策略
由以上典例分析可知,此类题目的图像特点是:纵坐标是转化率、产率、选择性等,横坐标是变化的外界条件——温度.对本类图像的正确理解是控制其他条件相同,在不同温度下进行的若干对比实验,不能理解成在同一个容器中不断升温进行的连续实验.若反应体系中存在分步反应或连续反应,可将某些反应合并,简化为单一反应或竞争反应后合理解题.
4.1 综合判别平衡点与非平衡点
根据图形的总体趋势作出初步判断,一般上升阶段为非平衡状态下的数据点,下降阶段为平衡状态下的数据点,但必须明确,上升阶段可能为平衡点,下降阶段也可能为非平衡点,最高点并不一定是平衡点.究其原因,可能受到以下因素的影响:有气体参与的反应,升高温度,气体的溶解度减小;加热后易分解的物质(H2O2、NH3·H2O等)分解;加热后易挥发的物质(浓硝酸、浓盐酸)挥发;有催化剂参与的反应,升高温度,催化剂活性降低;升高温度,发生其他副反应等.题目提供的信息是作进一步判断的依据,根据题干中的关键词如“平衡转化率”“平衡选择性”“平衡产率”等可判断图像上的数据点为平衡点,根据题干相关描述如“将……混合气体以一定流速通过装有催化剂的反应管”等可判断图像上的数据点为非平衡点.
4.2 建立此类图像的一般认知模型
帮助学生建立模型认知是化学学科核心素养的重要组成部分[1],以“转化率——温度”图像为例,建立此类图像的认知模型如图6:
平衡体系下的图像考查相对简单,解决此类图像题的关键是利用平衡移动原理准确判断外界条件改变对平衡的影响.平衡移动与反应物转化率密切相关,但又是两个完全不同的概念[2].若温度改变使平衡向正反应方向移动,则反应物转化率增大,反之,则转化率减小;若浓度改变使平衡向正反应方向移动,则反应物转化率不一定增大,原因是转化率还与反应物的起始量有关.因此,若温度升高体系中某些物质发生副反应生成反应物,会导致此反应物的转化率降低.
非平衡体系下,从反应速率的角度分析温度、催化剂等因素对反应体系的影响.催化剂在一定温度范围内有较高的催化活性,催化剂活性增大的过程中,温度因素和催化剂因素协同作用,使反应速率增大,反应物转化率增大;催化剂活性减小的过程,温度因素和催化剂因素对反应速率的影响结果不一致,最终反应速率的变化取决于何种因素占主导.除上述因素以外,其他因素如温度升高,物质挥发或分解;温度升高,气体反应物溶解度减小等也会影响研究对象的转化率.
4.3 竞争反应体系选择性问题
在双反应体系中,产物1的选择性=n(转化为产物1的反应物)n(转化的反应物)×100%,产物2的选择性=n(转化为产物2的反应物)n(转化的反应物)×100%,两种产物中其中一种产物的选择性降低,意味着另一产物的选择性增大,且两种产物的选择性之和为1,可见两个反应之间是相互竞争关系,“选择性——温度”图像分析的认知模型如图7:
影响非平衡选择性的因素主要有催化剂选择性、温度、压强、投料比等,平衡选择性的变化主要从影响平衡移动的因素来解释.催化剂对不同的反应可能具有不同的催化活性,能改变一定时间内目标产物在总产物中的比例,从而改变非平衡选择性.然而,若反应时间足够长,一定时间内所有反应均已达到平衡状态,选用对某一反应具有更高活性的催化剂并不能提高此反应的平衡选择性.反应物转化率与产物选择性没有必然关系,但与产物的产率有一定联系也是解决此类图像题值得关注的问题.
5 结束语
本类试题题目呈现方式为叙述、公式和图表等,提问方式有选择、填空和作图等,考查学生对曲线变化趋势作出解释和预测的能力,有利于促进学生高阶思维能力的发展.
参考文献:
[1] 王晓瑛,刘燕霞.建构分析化学反应中转化率的思维模型[J].中学化学教学参考,2023(06):44-47.
[2] 林尤宏.辨析平衡移动与转化率变化[J].化学教学,2012(11):75-77.
[责任编辑:季春阳]

