硫唑嘌呤对RSL3 诱导小鼠精母细胞铁死亡的影响


[摘 要] 目的:探讨硫唑嘌呤(AZA)对还原型谷胱甘肽(GSH)过氧化物酶4抑制剂RSL3诱导的小鼠精母细胞铁死亡的影响,并阐明其可能的作用机制。方法:小鼠精母GC-2细胞随机分为对照组(不进行处理)、RSL3 组(给予10 nmol·L-1 RSL3 处理24 h)、RSL3+铁死亡抑制剂(Fer-1) 组(给予10 nmol·L-1 RSL3 处理24 h+2 μmol·L-1 Fer-1 处理12 h)、RSL3+低剂量AZA 组(给予10 nmol·L-1RSL3 处理24 h+5 μmol·L-1 AZA 处理12 h)、RSL3+ 中剂量AZA 组(给予10 nmol·L-1 RSL3处理24 h+10 μmol·L-1 AZA 处理12 h) 和RSL3+高剂量AZA 组(给予10 nmol·L-1 RSL3 处理24 h+20 μmol·L-1 AZA 处理12 h)。MTT 法检测不同浓度AZA 和不同浓度RSL3 作用后GC-2 细胞活性,采用GSH 和氧化型谷胱甘肽(GSSG) 检测试剂盒检测GC-2 细胞中GSH 和GSSG 水平,采用丙二醛(MDA) 试剂盒检测各组GC-2 细胞中MDA 水平,采用Western blotting 法检测各组GC-2 细胞中长链脂酰CoA 合成酶4 (ACSL4)、血红素氧合酶1 (HO-1) 和谷胱甘肽过氧化物酶4 (GPX4) 蛋白表达水平,采用免疫荧光法检测各组GC-2细胞中ACSL4蛋白表达情况。结果:与对照组比较,5、10和20 μmol·L-1AZA 组GC-2 细胞活性差异无统计学意义(Pgt;0. 05),30 和40 μmol·L-1 AZA 组GC-2 细胞细胞活力明显降低(Plt;0. 01),因此AZA 作用浓度选择为20 μmol·L-1以内。与对照组比较,1、5 和10 nmol·L-1 RSL3 组GC-2 细胞活性差异无统计学意义(Pgt;0. 05),50、100、500 和1 000 nmol·L-1RSL3 组GC-2 细胞活性明显降低(Plt;0. 05 或Plt;0. 01),因此将RSL3 作用浓度定为10 nmol·L-1 以内。GSH 和MDA 试剂盒检测,与对照组比较, RSL3 组GC-2 细胞中GSSG 和MDA 水平明显升高(Plt;0. 05), GSH 水平明显降低(Plt;0. 05); 与RSL3 组比较, RSL3+Fer-1 组和RSL3+AZA 组GC-2 细胞中GSSG 和MDA 水平明显降低(Plt;0. 01), GSH 水平明显升高(Plt;0. 01)。Westernblotting 法检测, 与对照组比较, RSL3 组GC-2 细胞中ACSL4 和HO-1 蛋白表达水平明显升高(Plt;0. 05),GPX4蛋白表达水平明显降低(Plt;0. 01);与RSL3 组比较,RSL3+Fer-1 组和RSL3+AZA 组GC-2 细胞中GPX4 蛋白表达水平明显升高(Plt;0. 05),ACSL4 和HO-1 蛋白表达水平明显降低(Plt;0. 01)。免疫荧光检测,与对照组比较,RSL3 组GC-2 细胞中ACSL4 蛋白表达量明显增多;与RSL3组比较,RSL3+Fer-1组和RSL3+AZA组ACSL4蛋白表达量明显降低。结论:AZA可以减轻RSL3诱导的小鼠精母细胞铁死亡。
[关键词] 硫唑嘌呤; 铁死亡; 精母细胞; 谷胱甘肽过氧化物酶4; 酯酰辅酶A 合成酶长链家族成员4
[中图分类号] R332; R285. 5 [文献标志码] A[文章编号] 1671⁃587X(2024)05⁃1217⁃10
男性不育是现代社会一大医疗挑战,其病因繁多,包括但不限于精液质量异常、精子生成过程障碍和精子与卵子结合障碍等。质量良好的精子对于生殖成功至关重要[1-2]。研究[3-5] 显示: 精子在遭受氧化应激损伤时,其动力学特性受到负面影响,表现为活力下降和畸形率升高,上述变化往往导致男性不育。铁死亡是一种由氧化应激引起的细胞死亡模式, 其特征是还原型谷胱甘肽(glutathione,GSH) 枯竭和谷胱甘肽过氧化物酶4 (glutathioneperoxidase 4,GPX4) 活性降低,导致身体无法有效清除脂质过氧自由基,从而触发含铁生物分子氧化,终致细胞死亡[6-7]。GPX4 抑制剂RSL3 可诱导细胞铁死亡,在许多研究[8] 中用作铁死亡诱导剂。硫唑嘌呤(azathioprine,AZA) 是临床上广泛应用的免疫抑制药物,在体内代谢成巯嘌呤发挥免疫抑制效果,能缓解炎症反应和减轻氧化应激[9-10]。目前AZA 是否具有调节细胞铁死亡的潜力,尤其在改善男性不育方面的作用尚不明确。本研究旨在探讨AZA 能否减轻RSL3 诱导的精母细胞的铁死亡效应, 阐明AZA 治疗男性不育的潜在作用机制,为寻找治疗男性不育的新策略提供依据。
1 材料与方法
1. 1 细胞、主要试剂和仪器 小鼠精母 GC-2细胞购自美国典型培养物收藏中心(American TypeCulture Collection,ATCC)。辣根过氧化物酶标记山羊抗兔抗体和辣根过氧化物酶标记山羊抗小鼠抗体购自北京中杉金桥生物技术有限公司, GPX4、酯酰辅酶A 合成酶长链家族成员4 (acyl CoAsynthetase long-chain family member 4, ACSL4)、血红素氧合酶1 (heme oxygenase-1 , HO-1)和β 微管蛋白(β-tubulin) 均购自美国Proteintech公司, GSH 和氧化型谷胱甘肽(glutathioneoxidized,GSSG) 检测试剂盒购自上海碧云天生物技术有限公司,丙二醛(malondialdehyde,MDA)检测试剂盒购自兰杰柯科技有限公司, BCA 蛋白浓度测定试剂盒购自北京鼎国昌盛生物技术有限责任公司,抗荧光淬灭剂购自北京鼎国昌盛生物技术有限公司, 山羊抗兔红色荧光二抗购自美国Jackson ImmunoResearch 公司, 4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)购自上海碧云天生物技术有限公司。Centrifuge5804R 高速冷冻离心机购自德国Eppendorf 公司,Fluor Chem HD2 化学发光凝胶成像系统购自美国Protein Simple 公司, Synergy H1 多功能酶荧光标仪购自美国BioTek 公司, NIS-Elements 激光共聚焦显微镜购自日本尼康株式会社。
1. 2 小鼠精母 GC-2细胞分组和培养方法 小鼠GC-2 细胞采用含10% 胎牛血清和青-链霉素的达尔伯克改良伊格尔培养基(Dulbecco’s modified eaglemedium,DMEM),置于37 ℃、5% CO2 的恒温细胞孵箱中培养,取对数生长期的GC-2 细胞接种至6 孔细胞培养板中,24 h 后观察细胞形态表现,随机分为对照组(不进行处理)、RSL3 组(给予10 nmol·L-1 RSL3 处理24 h)、RSL3+铁死亡抑制剂(Ferrostatin-1, Fer-1) 组(给予10 nmol·L-1RSL3 处理24 h +2 μmol·L-1 Fer-1 处理12 h)、RSL3+低剂量AZA 组(给予10 nmol·L-1 RSL3 处理24 h+5 μmol·L-1 AZA 处理12 h)、RSL3+中剂量AZA 组(给予10 nmol·L-1 RSL3 处理24 h+10 μmol·L-1 AZA 处理12 h) 和RSL3+ 高剂量AZA 组( 给予10 nmol·L-1 RSL3 处理24 h+20 μmol·L-1 AZA 处理12 h)。
1. 3 MTT 法 检 测 不 同 浓 度 AZA 作 用 后 各 组GC-2 细胞活性 取对数生长期GC-2细胞,以每孔5×104 个的密度接种至24 孔细胞培养板, 每孔加入500 μL DMEM, 置于恒温孵箱培育24 h。细胞分为对照组和不同浓度AZA 组, 吸弃细胞上清,加入含不同浓度AZA 的培养基,使AZA 终浓度达到0、5、10、20、30 和40 μmol·L-1。12 h 后向24 孔细胞培养板每孔中加入5 g·L-1 MTT 溶液50 μL,置于恒温孵箱中孵育4 h,轻轻吸弃细胞培养上清, 每孔加入400 μL 二甲亚砜(dimethylsulfoxide, DMSO) 溶液, 将24 孔细胞培养板置于摇床避光振荡10 min, 采用酶标仪检测各孔在570 和630 nm 波长处的吸光度(A) 值。细胞活性=(实验组A 值-空白组A 值) / (对照组A 值-空白组A 值) ×100%。
1. 4 MTT 法检测不同浓度 RSL3 作用后 GC-2细胞活性 取对数生长期 GC-2细胞,以每孔 5×104 个的密度接种至 24 孔细胞培养板, 每孔加入500 μL DMEM, 置于恒温孵箱培育24 h。细胞对照组和不同浓度RSL3 组,吸弃培养上清后,向各组细胞中分别加入含不同浓度RSL3 (0、1、5、10、500 和1 000 nmol·L-1) 的DMEM。MTT 法检测见“1. 3”。
1. 5 各组GC-2细胞中蛋白含量检测 取对数生长期GC-2 细胞,以每孔4×105 个细胞的密度接种于6 孔细胞培养板中, 按照“1. 2” 中方法分为对照组、RSL3 组、RSL3+Fer-1 组和RSL3+AZA 组。采用1 mL 预冷的磷酸缓冲盐溶液(phosphatebuffer saline,PBS) 洗涤细胞3 次,离心5 min 后收集细胞沉淀。加入50 μL 蛋白去除剂,振荡重悬细胞, 将重悬的细胞在超低温液氮和37 ℃水浴条件下反复冻融3 次。置于冰上5 min 后,离心10 min,取样品上清用于GSH 和GSSG 含量检测。另取部分上清加入1×GSH 清除缓冲液和1×GSH 清除工作液震荡混匀,用于GSSG 含量检测。样品加入总谷胱甘肽检测工作液混匀,室温孵育5 min,加入烟酰胺腺嘌呤二核苷酸(triphosphopyridinenucleotide,NADPH) 溶液50 μL 混匀, 25 min 后采用酶标仪检测412 nm 波长处A 值。采用二喹啉甲酸(bicinchoninic cacid,BCA) 法检测各组细胞中目的蛋白含量, 根据标准曲线计算总谷胱甘肽(即GSH+GSSG) 和GSSG 含量。GSH 含量=(总谷胱甘肽含量-GSSG 含量) ×2。
1. 6 各组GC-2细胞中MDA水平检测 取对数生长期GC-2 细胞, 以每孔4×105 个的密度接种于6 孔细胞培养板,按照“1. 2”中方法分为对照组、RSL3 组、RSL3+Fer-1 组和RSL3+AZA 组。吸弃培养上清, 采用预冷的PBS 缓冲液轻轻洗涤细胞3 次, 吸弃PBS 缓冲液, 每孔加入200 μL 裂解液, 将样品置于冰上摇床振荡裂解30 min, 采用BCA 试剂盒检测样品的蛋白浓度;取100 μL 充分裂解的样品加入200 μL MDA 检测工作液后充分振荡混匀。将混合均匀的样品置于100 ℃ 沸水浴中加热 15 min, 水浴冷却至室温后, 离心10 min取上清液, 采用酶标仪在532 nm 波长处测定各孔A 值, 根据标准曲线计算各组GC-2 细胞中MDA水平。
1. 7 Western blotting 法 检 测 各 组 GC-2 细 胞 中GPX4、ACLS4 和 HO-1 蛋白表达水平 取对数生长期GC-2 细胞,以每孔4×105 个的密度接种于6 孔细胞培养板中, 按照“1. 2” 中方法分为对照组、RSL3 组、RSL3+Fer-1 组和RSL3+AZA 组, 每孔加入200 μL 裂解液, 将样品置于冰上充分裂解30 min,4 ℃、12 000 g 离心15 min,取样本上清,采用BCA 法测定蛋白表达水平。采用12. 5% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis, SDSPAGE)凝胶电泳分离蛋白,于冰水中转至聚偏氟乙烯(polyvinylidenefluoride,PVDF) 膜。将PVDF膜置于5% 脱脂奶粉中封闭1 h,室温孵育ACSL4、GPX4、HO-1 和β - 微管蛋白抗体2 h。Westernblotting 洗脱缓冲液(Tris-buffered saline andTween 20, TBST) 洗膜3 次后加入相应二抗,37 ℃孵育1 h, TBST 洗膜3 次, 采用化学发光底物(electrochemiluminescence, ECL) 显影液显影。采用Image J 软件检测蛋白条带灰度值。目的蛋白表达水平= 目标蛋白条带灰度值/β-tubulin 蛋白条带灰度值。
1. 8 免疫荧光法检测各组 GC-2细胞中 ACSL4蛋白表达量 取对数生长期 GC-2细胞,以每孔 1×105 个的密度接种于提前放置爬片的6 孔细胞培养板中培养过夜, 按照“1. 2” 中方法分为对照组、RSL3 组、RSL3+Fer-1 组和RSL3+AZA 组。吸弃上清,每孔采用1 mL 预冷的PBS 缓冲液洗涤细胞3 次。吸弃PBS 缓冲液,每孔加入4% 多聚甲醛1 mL, 固定30 min 后采用真空吸液泵吸弃多聚甲醛。采用0. 5% Triton-X 100 通透10 min, PBS 缓冲液洗涤3 次, 每次5 min。在爬片上滴加免疫封闭液, 室温封闭1 h, 吸弃封闭液, 将配置好的ACSL4 一抗工作液滴加至染色区域, 置于湿盒中4 ℃ 过夜。次日回收一抗, PBS 缓冲液洗涤3 次,每次5 min。避光加入相应荧光二抗,置于湿盒中室温孵育1 h。吸弃二抗, PBS 缓冲液洗涤3 次,每次5 min。加入DAPI 孵育10 min, PBS 缓冲液洗涤3 次。加入抗荧光淬灭剂封片,在荧光显微镜下观察荧光强度,定性检测细胞中ACSL4 蛋白表达量。
1. 9 统计学分析 采用 GraphPad Prism 8统计软件进行统计学分析。各组GC-2 细胞活性, 各组GC-2 细胞中GSH、GSSG 和MDA 水平, 各组GC-2 细胞中GPX4、ACSL4、HO-1 和ACSL4 蛋白表达水平以x±s 表示, 多组间样本均数比较采用单因素方差分析, 组间样本均数两两比较采用SNK-q 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
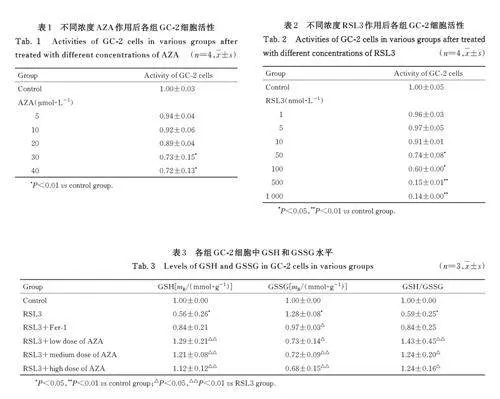
2. 1 不同浓度 AZA 处理后各组 GC-2 细胞活性 与对照组比较, 5、10 和20 μmol·L-1AZA 组GC-2 细胞活性差异无统计学意义(Pgt;0. 05),30 和40 μmol·L-1 AZA 组GC-2 细胞活性明显降低(Plt;0. 01)。见表1。因此,本研究中AZA 作用浓度选择为20 μmol·L-1以内。
2. 2 不同浓度 RSL3 处理后各组 GC-2 细胞活性 与对照组比较, 1、5 和10 nmol·L-1 RSL3 组细胞活性差异无统计学意义(Pgt;0. 05), 50、100、500 和1 000 nmol·L-1 RSL3 组细胞活性明显降低(Plt;0. 05 或Plt;0. 01)。见表2。因此, 本研究将RSL3 作用浓度定为10 nmol·L-1以内。
2. 3 各组 GC-2细胞中 GSH 和 GSSG水平 与对照组比较, RSL3 组GC-2 细胞中GSH 水平降低(Plt;0. 05), GSSG 水平升高(Plt;0. 05), GSH/GSSG 比值降低(Plt;0. 05); 与RSL3 组比较,RSL3+AZA 组GC-2 细胞中GSH 水平升高(Plt;0. 01),GSSG 水平降低(Plt;0. 01),GSH/GSSG比值升高(Plt;0. 05)。见表3。
2. 4 各组 GC-2 细胞中 MDA 水平 与对照组比较, RSL3 组GC-2 细胞中MDA 水平升高(Plt;0. 05); 与RSL3 组比较, RSL3+Fer-1 组和RSL3+不同浓度AZA 组GC-2 细胞中MDA 水平降低(Plt;0. 01)。见表4。
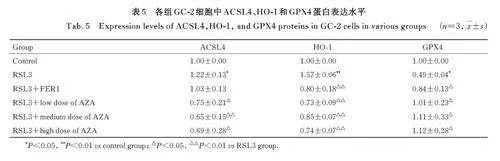
2. 5 各 组 GC-2 细 胞 中 GPX4、 ACLS4 和 HO-1蛋白表达水平 与对照组比较,RSL3组GC-2细胞中ACSL4和HO-1蛋白表达水平明显升高(Plt;0. 05或Plt;0. 01),GPX4 蛋白表达水平明显降低(Plt;0. 05); 与 RSL3 组 比 较, RSL3+Fer-1 组 和RSL3+ 不同浓度AZA 组GC-2 细胞中ACSL4 和HO-1 蛋白表达水平明显降低(Plt;0. 05 或Plt;0. 01),GPX4 蛋白表达水平明显升高(Plt;0. 05)。见图1 和表5。
2. 6 各组 GC-2细胞中 ACSL4蛋白表达量 与对照组比较,RSL3 组GC-2 细胞中ACSL4 蛋白表达量 增 多; 与 RSL3 组 比 较, RSL3+Fer-1 组 和RSL3+AZA 组GC-2 细胞中ACSL4 蛋白表达量明显降低。见图2。
3 讨 论
男性不育问题在全球范围内逐年加剧,对个人和家庭健康构成了严峻挑战。不育症的成因多样,包括遗传、环境和生活习惯等[11-13]。在临床上,精子的数量、活动力和形态是评估男性不育的关键生物学指标[11-13]。精子的生成和成熟是一个复杂的过程: 精原细胞的增殖并分化为精母细胞, 精母细胞经过2 次减数分裂形成精子细胞, 最后经过细胞变态的过程形成成熟的精子。该过程需要细胞内的稳态和精确的分子调控,任何对上述过程的干扰都可能导致精子质量下降,进而影响男性的生育能力[14-15]。研究 [16] 显示:精母细胞异常,包括染色体异常、染色体非整倍体、DNA 损伤、基因突变、细胞增殖和细胞凋亡的异常等都可能导致精子发育过程受损。因此,本研究采用GC-2 细胞作为模型, 探讨精母细胞异常对于男性不育防治的意义。
铁死亡是细胞死亡的一种新形式,与男性不育有密切关联[17-18]。铁死亡是由脂质过氧化引发的细胞死亡途径,在精子形成中起重要调控作用。异常铁死亡过程可能导致睾丸组织和精子的氧化应激,进而影响精子的形成和成熟[19]。研究 [20] 显示:PM2. 5 等导致的男性生殖系统损伤与精母细胞铁死亡有密切关联。铁死亡诱导剂包括以下几类:抑制Xc 系统活性, 如erastin 和柳氮磺砒啶; 抑制或降解GPX4, 如RSL3 和FIN56; 消耗辅酶Q10,如他汀类药物;通过铁过载或多不饱和脂肪酸过载诱导脂质过氧化,如血红素及FINO2[21]。本研究中, 铁死亡诱导剂RSL3 作用GC-2 细胞24 h 后,细胞中GSH 水平降低,MDA 水平升高,铁死亡标志分子GPX4 表达水平降低,ACSL4 和HO-1 蛋白表达水平升高, 表明RSL3 可以诱导GC-2 细胞发生铁死亡。GC-2 细胞经铁死亡抑制剂Fer-1 处理后,细胞中GSH 水平有所升高,MDA 水平得到恢复, 进一步证实铁死亡与精母细胞损伤有密切关联。因此, 铁死亡诱导剂RSL3 作用的GC-2 细胞可作为细胞模型进一步探讨防治精母细胞铁死亡的药物。
铁死亡过程中,GPX4 能有效清除脂质过氧化物,保护精子免受氧化损伤[22-23]。GPX4 是一种硒蛋白,可作为GSH 依赖的过氧化物酶清除脂质过氧化物而保护细胞免受脂质过氧化,当GSH 合成受阻或者GSH 依赖性的GPX4 在体内被抑制时,便会触发铁死亡。在生殖系统中,GPX4 在生殖器官和精子中大量表达,30% 不育男性精子中GPX4表达水平降低[24]。GPX4 活性丧失或低表达已被证实与精子畸形率增高和生育能力下降有关[25-26]。ACSL4 是一种将CoA 酯化为特定多不饱和脂肪酸(花生四烯酸和肾上腺酸) 的酶[27]。ACSL4 和GPX4 分别正向和负向调节铁死亡[28]。HO-1 可以通过释放血红素中的铁来升高细胞中铁离子浓度,铁离子过量可能会促进泛素化脂质过氧化物酶的形成,破坏细胞膜完整性,最终引发铁死亡。在雄性生殖系统,HO-1 有助于抑制精子和睾丸组织中活性氧的过量积累, 从而保护精子的功能和完整性[26, 29-31]。上述研究提示: 铁死亡标志分子GPX4、ACSL4 和HO-1 与雄性生殖损有伤密切关联。本研究结果显示: 10 nmol·L-1 铁死亡诱导剂RSL3 处理的GC-2 细胞中GPX-4 表达水平降低,HO-1 和ACSL4 表达水平升高, 而10 nmol·L-1RSL3 并未对细胞活性产生明显影响,提示铁死亡标志分子GPX4、ACSL4 和HO-1 表达水平的变化较细胞活性变化更为敏感,可作为精母细胞损伤敏感标志分子。
AZA 作用机制包括其在体内转变为巯嘌呤,从而抑制细胞增殖,主要用于治疗各种炎症性和自身免疫性疾病[32-33]。此外,AZA 也展现了抗氧化应激的潜力,可能通过影响抗氧化酶的表达和调节细胞中GSH 水平来保护细胞免受自由基的伤害[34-35]。铁死亡发生时,细胞中铁离子释放到细胞外,与细胞膜上的不饱和脂肪酸发生反应,导致细胞膜的通透性和完整性受损[36]。因此, 铁死亡与氧化应激有密切关联。本研究结果显示: AZA 能降低RSL3 诱导的精母细胞氧化相关分子MDA 水平,提升抗氧化分子GSH 水平,证实AZA 抗氧化应激的能力;同时AZA 还可以升高铁死亡标志分子GPX4 表达水平且降低ACSL4 和HO-1 表达水平, 提示AZA 可作为铁死亡相关的潜在治疗剂,在防治精母细胞铁死亡方面发挥作用,该结果为研究和治疗男性不育提供了新的思路。
综上所述, AZA 通过对铁死亡标志分子和MDA 及GSH 等氧化抗氧化相关分子的调节,能够有效减缓精母细胞铁死亡进程,从而发挥对雄性不育的防治作用。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:叶严珏参与选题、实验操作过程、数据收集整理和论文撰写,汤子怡、阳诗盈和谭钰培参与论文中数据的统计学分析,刘永和尹俐参与指导论文撰写。
[参考文献]
[1] ZIAMAJIDI N, KHAJVAND-ABEDINI M, DAEI S,
et al. Ameliorative effects of vitamins A, C, and E on
sperm parameters, testis histopathology, and oxidative
stress status in zinc oxide nanoparticle-treated rats[J].
Biomed Res Int, 2023, 2023: 4371611.
[2] XU J M, YANG Q L, CHEN W H, et al. Comparing
the clinical and singleton neonatal outcomes in male
infertility patients with Oligoasthenospermia, OA, or
NOA following fresh ICSI-ET using different sources of
sperm[J]. Front Endocrinol, 2023, 14: 1186257.
[3] ROTIMI D E, ELEBIYO T C, OJO O A. Therapeutic
potential of rutin in male infertility : a mini review[J].
J Integr Med, 2023, 21(2): 130-135.
[4] MAZINI F, ABDOLLAHIFAR M A, NIKNEJAD H,
et al. Retinoic acid loaded with chitosan nanoparticles
improves spermatogenesis in scrotal hyperthermia in
mice[J]. Clin Exp Reprod Med, 2023, 50(4): 230-243.
[5] 李嫣晓, 陈红霞, 程梦蝶, 等. 铁死亡与心肌纤维化相
关信号通路的研究进展[J]. 郑州大学学报(医学版),
2024, 59(2): 195-201.
[6] LI J, JIA B W, CHENG Y, et al. Targeting molecular
mediators of ferroptosis and oxidative stress for
neurological disorders[J]. Oxid Med Cell Longev,
2022, 2022: 3999083.
[7] CHEN G H, SONG C C, PANTOPOULOS K, et al.
Mitochondrial oxidative stress mediated Fe-induced
ferroptosis via the NRF2-ARE pathway[J]. Free Radic
Biol Med, 2022, 180: 95-107.
[8] SUN X F, ZHANG Q, LIN X H, et al. Imatinib
induces ferroptosis in gastrointestinal stromal tumors by
promoting STUB1-mediated GPX4 ubiquitination[J].
Cell Death Dis, 2023, 14(12): 839.
[9] BAHADIR S, ONAL M B, NARIN F, et al.
Azathioprine as a neuroprotective agent in experimental
traumatic spinal cord injury[J]. Turk Neurosurg, 2021,
31(2): 211-216.
[10]PAPADA E, FORBES A, AMERIKANOU C, et al.
Antioxidative efficacy of a Pistacia lentiscus supplement
and its effect on the plasma amino acid profile in
inflammatory bowel disease: a randomised, doubleblind
, placebo-controlled trial[J]. Nutrients , 2018 ,
10(11): 1779.
[11]LANCET DIABETES ENDOCRINOLOGYTHE.
Homing in on the causes of male infertility[J]. Lancet
Diabetes Endocrinol, 2022, 10(3): 149.
[12]SALEHI Z, PASHA H, HOSSEINI S R, et al. The
impact of social support, physical and psychological
performance on sleep outcomes in Iranian older adults: a
case-control study[J]. BMC Geriatr, 2023, 23(1): 791.
[13]DOMAR A D, JASULAITIS L, MATEVOSSIAN K,
et al. The impact of the FertiStrong mobile application
on anxiety and depression in men: a randomised control
pilot study[J]. J Hum Reprod Sci, 2023, 16(3):
195-203.
[14]MIYAOKA R, OROSZ J E, ACHERMANN A P, et al.
Methods of surgical sperm extraction and implications for
assisted reproductive technology success[J]. Panminerva
Med, 2019, 61(2): 164-177.
[15]刘巧斌, 程 玲, 叶圆圆, 等. 男性不育患者精液质量
及其影响因素分析[J]. 吉林大学学报(医学版), 2022,
48(2): 470-477.
[16]BHARTIYA D, KAUSHIK A. Testicular stem cell
dysfunction due to environmental insults could be
responsible for deteriorating reproductive health of
men[J]. Reprod Sci, 2021, 28(3): 649-658.
[17]LI L P, PEI Z J, WU R T, et al. FDX1 regulates
leydig cell ferroptosis mediates PM2.5-induced testicular
dysfunction of mice[J]. Ecotoxicol Environ Saf, 2023,
263: 115309.
[18]LIU Y, CAO X H, HE C, et al. Effects of ferroptosis
on male reproduction[J]. Int J Mol Sci, 2022, 23(13):
7139.
[19]JIAO D L, MA B Z, ZHAO C, et al. Mechanism of
ferroptosis in regulating testicular spermatogenic
dysfunction: Progress in research[J]. Natl J Androl,
2022, 28(11): 1044-1048.
[20]WANG J K, ZHANG Z H, SHI F Q, et al. PM2.5
caused ferroptosis in spermatocyte via overloading iron
and disrupting redox homeostasis[J]. Sci Total Environ,
2023, 872: 162089.
[21]BELAVGENI A, MAREMONTI F, TONNUS W,
et al. vPIF-1 is an insulin-like antiferroptotic viral
peptide[J]. Proc Natl Acad Sci U S A, 2023, 120(21):
e2300320120.
[22]HAN P, WANG X, ZHOU T Q, et al. Inhibition of
ferroptosis attenuates oligospermia in male Nrf2
knockout mice[J]. Free Radic Biol Med, 2022,
193(Pt 1): 421-429.
[23]KADER M AABD EL, GABR M M, KHATER S M,
et al. Impact of insulin producing cells derived from
adipose tissue mesenchymal stem cells on testicular
dysfunction of diabetic rats[J]. Heliyon, 2021, 7(11):
e08316.
[24]HAO X L, WANG H, CUI F, et al. Reduction of
SLC7A11 and GPX4 contributing to ferroptosis in sperm
from asthenozoospermia individuals[J]. Reprod Sci,
2023, 30(1): 247-257.
[25]ZHOU J C, ZHENG S J, MO J L, et al. Dietary
selenium deficiency or excess reduces sperm quality and
testicular mRNA abundance of nuclear glutathione
peroxidase 4 in rats[J]. 2017, 147(10): 1947-1953.
[26]HAN S T, LIN F Y, QI Y C, et al. HO-1 contributes
to luteolin-triggered ferroptosis in clear cell renal cell
carcinoma via increasing the labile iron pool and
promoting lipid peroxidation [J]. Oxid Med Cell
Longev, 2022, 2022: 3846217.
[27]CHENG J, FAN Y Q, LIU B H, et al. ACSL4
suppresses glioma cells proliferation via activating
ferroptosis[J]. Oncol Rep, 2020, 43(1): 147-158.
[28]DAI Y, CHEN Y T, MO D, et al. Inhibition of
ACSL4 ameliorates tubular ferroptotic cell death and
protects against fibrotic kidney disease[J]. Commun
Biol, 2023, 6(1): 907.
[29]LI G S, ZHANG P H, YOU Y D, et al. Qiangjing
tablets regulate apoptosis and oxidative stress via keap/
Nrf2 pathway to improve the reproductive function in
asthenospermia rats[J]. Front Pharmacol, 2021, 12:
714892.
[30]XU Z J, QIN Y, LV B B, et al. Effects of moderateintensity
continuous training and high-intensity interval
training on testicular oxidative stress, apoptosis and
m6A methylation in obese male mice[J]. Antioxidants,
2022, 11(10): 1874.
[31]COLLODEL G, SIGNORINI C, NERUCCI F, et al.
Semen biochemical components in varicocele,
leukocytospermia, and idiopathic infertility[J]. Reprod
Sci, 2021, 28(1): 91-101.
[32]SINGH S, KIRTSCHIG G, ANCHAN V N, et al.
Interventions for bullous pemphigoid [J]. Cochrane
Database Syst Rev, 2023, 8(8): CD002292.
[33]ZHONG Z, SU G, YANG P. Risk factors, clinical
features and treatment of Behcet’s disease uveitis [J].
Prog Retin Eye Res, 2023, 97: 101216.
[34]SCHAALAN M F, RAMADAN B K, A H A E.
Ameliorative effect of taurine-chloramine in azathioprineinduced
testicular damage; a deeper insight into the
mechanism of protection [J]. BMC Complement Altern
Med, 2018, 18(1): 255.
[35]ABDUL-HAMID M, ABDEL-REHEIM E S,
HEGAZY W, et al. Impact of gervital against
histopathological, ultrastructural, and biochemical
alterations caused by methotrexate or azathioprine in
albino rat testis [J]. Environ Sci Pollut Res Int, 2023,
30(8): 21914-21926.
[36]TAN S L W , TAN H M , ISRAELI E , et al.
Up-regulation of SLC7A11/xCT creates a vulnerability
to selenocystine-induced cytotoxicity [J]. Biochem J,
2023, 480(24): 2045-2058.

