新生大鼠原代软骨细胞分离和培养方法的改进


[摘 要] 目的:探讨新生大鼠原代软骨细胞分离和培养的改进方法,以建立高效经济的体外软骨细胞培养体系。方法:从新生大鼠关节中分离原代软骨细胞,分为过夜消化 (OD) 组和快速消化(RD) 组进行分离, OD 组软骨细胞采用Ⅱ 型胶原酶过夜消化, RD 组软骨细胞采用预消化的物理化学消化相结合的手段分离细胞。采用含0% (空白组1)、1%、2%、4% 和10% 胎牛血清(FBS),0 (空白组2)、0. 1、0. 2、0. 4、0. 8、1. 0、2 . 0 g·L-1 维生素C (VC) 和0 (空白组3)、0. 5、1. 0、2. 0、4. 0、8. 0、10. 0 μg·L-1 聚乳酸-羟基乙酸共聚体(PLGA) 纳米粒子的改良培养液培养软骨细胞。将杜氏改良Eagle 培养基F12 营养混合液(DMEM/F12) 与含不同浓度FBS、VC 和PLGA 的培养液分别混合,并按照各成分浓度进行相应分组。采用细胞计数仪计数各组细胞并检测各组细胞存活率和直径,采用甲苯胺蓝特异性染色法检测各组细胞形态表现,采用CCK-8 法检测各组细胞增殖活性,采用细胞黏附实验检测各组细胞黏附率,采用Hoechst/碘化丙碇(PI) 染色检测各组细胞凋亡情况,采用MTT 法检测改良培养液培养后各组细胞增殖活性, 将细胞分为DMEM/F12+10%FBS 组(对照组)、DMEM/F12+1%FBS 组、DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA 组,采用实时荧光定量PCR (RT-qPCR) 法检测改良培养液培养后各组细胞中性别决定区域Y 框转录因子9(SOX9)、Ⅱ 型胶原α1 链(Col2A1)、Ⅹ 型胶原α1 链(Col10A1) 和基质金属蛋白酶13 (MMP13)mRNA 表达水平,采用免疫荧光染色检测改良培养液培养后各组细胞中Ⅱ型胶原(COLⅡ) 和SOX9表达情况。结果:OD 组原代软骨细胞存活率小于RD 组,细胞平均直径大于RD 组。OD 组原代软骨细胞形态较大,呈梭形,大多数细胞出现伪足;RD 组原代软骨细胞形态较小,大多数细胞呈菱形,仅部分细胞出现伪足。2 组原代软骨细胞经甲苯胺蓝特异性染色均显色明显,但RD 组消化时间较短,软骨细胞实际培养时间较OD 组缩短9~13 h,原代软骨细胞形态更为幼稚。OD 组原代软骨细胞在培养24 h 时增殖较为缓慢, 培养48 h 时增殖速度升高, 较培养12 h 时增殖活性明显升高(Plt;0. 01)。RD 组原代软骨细胞在培养24 h 时增殖稍缓,培养48 h 时增殖速度加快,较培养12 h 时增殖活性明显升高(Plt;0. 01);培养24 和48 h 时,与OD 组比较,RD 组原代细胞增殖速度升高(Plt;0. 05)。RD 组软骨凋亡细胞数少于OD 组,2 组均无坏死软骨细胞。大鼠软骨细胞增殖活性随着培养液中FBS 浓度升高而升高,与空白组1 比较,培养液中含1%、2%、4% 和10%FBS 时,软骨大鼠细胞增殖活性明显升高(Plt;0. 05)。与空白组2比较,培养液中含0. 2~1. 0 g·L-1 VC 时大鼠软骨细胞增殖活性明显升高(Plt;0. 05),其中含0. 4 g·L-1 VC 时大鼠软骨细胞增殖活性最高(Plt;0. 01)。与空白组3 比较,培养液中含1~4 μg·L-1 PLGA 时,大鼠软骨细胞增殖活性明显升高(Plt;0. 05),其中含1 μg·L-1 PLGA 时大鼠软骨细胞增殖活性最高(Plt;0. 05)。与DMEM/F12+10%FBS 组比较, DMEM/F12+1%FBS 组大鼠软骨细胞中SOX9 mRNA 和COL2A1 mRNA 表达水平均明显升高(Plt;0. 05 或Plt;0. 01)。与DMEM/F12+10%FBS 组比较, DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA 组大鼠软骨细胞中SOX9 mRNA 和COL2A1 mRNA 表达水平明显升高(Plt;0. 01)。免疫荧光染色,荧光显微镜下DMEM/F12+10%FBS 组部分软骨细胞中出现COLⅡ绿色荧光信号和SOX9 红色荧光信号,荧光强度弱;DMEM/F12+1%FBS 组大多数软骨细胞中出现COLⅡ绿色荧光信号和SOX9 红色荧光信号,荧光强度明显强于DMEM/F12+10%FBS 组;DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA组软骨细胞中均出现COLⅡ绿色荧光信号和SOX9红色荧光信号,荧光强度较DMEM/F12+10%FBS 组和DMEM/F12+1%FBS 组明显升高。DMEM/F12+1%FBS 组软骨细胞中COLⅡ和SOX9 蛋白表达量明显高于DMEM/F12+10% FBS 组, DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA 组软骨细胞中COLⅡ和SOX9 蛋白表达量明显高于DMEM/F12+10%FBS组。结论:改良后的大鼠原代软骨细胞分离和培养方法可以弥补传统方法的缺陷,缩短原代软骨细胞的分离时间,提高原代软骨细胞的体外培养质量。
[关键词] 软骨细胞; 原代细胞培养; 体外技术; 条件培养基; 血清
[中图分类号] Q813. 1 [文献标志码] A
软骨细胞是关节软骨组织中的重要组成细胞,其主要作用是维持软骨组织内环境相对稳定[1]。由于软骨组织缺乏血管、神经和淋巴管等结构分布,一旦损伤很难自愈[2]。骨关节炎(osteoarthritis,OA) 是最常见的老年退行性疾病,由关节软骨细胞损伤和软骨细胞外基质(extracellular matrix,ECM) 合成及分解紊乱引起, 以关节软骨慢性进行性变性为特征[3]。原代软骨细胞的分离和培养是研究OA 的重要途径[4]。由于软骨组织结构致密,分离原代软骨细胞有一定难度。目前研究[5-6] 最常采用Ⅱ 型胶原酶进行过夜消化(overnightdigestion,OD),但消化耗时较长,因此可能影响原代软骨细胞的形态和功能。有研究[7] 采取顺序酶消化的方法,但仍耗时较长。软骨细胞的体外培养也存在难点。一方面,培养液的营养物质需要保障软骨ECM 的生理特性。软骨细胞扩增通常在含10% 胎牛血清(fetal bovine serum, FBS) 的培养液中进行[8-10],但该培养基不利于体外连续传代细胞特性的维持。某些改良培养基[11-12] 由于成分复杂且价格昂贵,难以普及。另一方面,软骨细胞在体外有去分化趋势,宜在三维(three-dimensional,3D) 环境中维持其分化表型[13]。一些专门的3D 培养物,如涡旋培养容器[ 14] 和材料固相支架[15-16]等,可聚集细胞,但易因营养物质受损导致细胞坏死[4]。聚乳酸- 羟基乙酸共聚物[poly (lactic-coglycolicacid), PLGA] 是目前应用最广泛的可降解生物材料,具有较好的生物相容性,其纳米粒子作为药物载体对OA 的治疗潜力已被研究[17-18] 证实。目前关于纳米颗粒和培养基添加物对软骨细胞体外培养的作用的相关研究较少。本研究对既往原代软骨细胞的分离方法和培养方法进行改良,建立预消化及物理和化学消化相结合的方法来缩短分离时间, 并通过降低FBS 浓度和添加适宜浓度维生素C (vitamin C, VC) 和PLGA 纳米颗粒共培养的方法来降低不利因素对软骨细胞培养的影响,为体外软骨细胞培养系统的分离和培养提供新思路。
1 材料与方法
1. 1 实验动物、主要试剂和仪器 无特定病原体级1~2 日龄SD 大鼠10 只,雌雄不限,购自长春亿斯实验动物技术有限公司,实验动物使用许可证号:SYXK (吉) 2023-0010。杜氏改良Eagle 培养基/F12 营养混合液(Dulbecco’s modified Eagle’smedium/nutrient mixture F-12, DMEM/F12) 和Ⅱ型胶原酶购自美国赛默飞世尔科技公司,青-链霉素混合液和胰酶购自美国Hyclone 公司,FBS 购自以色列Biological Industries 公司,细胞计数试剂盒8 (cell counting kit-8, CCK-8)、甲苯胺蓝染色液和4', 6-二脒基-2 苯基吲哚(4', 6-diamidino-2-phenylindole,DAPI) 染色液购自北京索莱宝科技有限公司,抗Ⅱ型胶原蛋白(anti-collagen typeⅡ,Anti-COL Ⅱ) 小鼠抗大鼠一抗购自美国NovusBiologicals 有限责任公司,抗性别决定区Y 框蛋白9 (anti-sex determining region Y box protein 9,Anti-SOX9) 兔抗大鼠一抗购自英国Abcam 公司,抗小鼠二抗和抗兔二抗购自上海爱必信生物科技有限公司, Hoechst 33342/ 碘化丙啶(propidiumiodide,PI) 双染试剂盒购自北京兰杰柯科技有限公司, VC 购自北京兰博利德生物技术有限公司,PLGA (LA/GA=50/50, 相对分子质量100 000)购自上海源叶生物科技有限公司,RNA 反转录试剂盒购自上海吐露港生物科技有限公司,大鼠β-肌动蛋白内参引物购自生工生物工程(上海) 股份有限公司。CO2 恒温培养箱和台式高速冷冻型微量离心机购自赛默飞世尔科技公司,倒置生物显微镜和倒置荧光显微镜购自日本奥林巴斯公司, 瑞沃德C100 细胞计数仪购自深圳瑞沃德生命科技有限公司, MX3000P 实时荧光定量PCR (real-timefluorescence quantitative PCR, RT-qPCR) 仪购自美国安捷伦科技有限公司,酶标仪购自瑞士帝肯公司, 超声波清洗机购自深圳洁盟清洗设备有限公司,超净台购自苏州安泰空气技术有限公司。
1. 2 大鼠软骨组织分离、分组和处理方式 采用CO2窒息法处死大鼠,75% 乙醇浸泡15 min 后转移至超净台中。去除大鼠后肢膝关节皮肤和肌肉,暴露 关 节 软 骨。分 离 关 节 软 骨,磷 酸 盐 缓 冲 液(phosphate buffered saline,PBS) 清洗2次,采用2只1 mL 注射器针头机械破碎软骨组织,其中一只针头固定组织,另一只针头斜面切割组织。将破碎后的软骨组织转移至新培养皿中,分为OD 组和快速消化(rapid digestion,RD) 组。OD 组软骨组织中按照1∶1 的比例加入Ⅱ型胶原酶和含10% FBS 的DMEM/F12, 然后置入培养箱中培养12~16 h。RD 组软骨组织加入胰酶预消化15 min,吸弃胰酶,培养液清洗2 次后按照1∶1 的比例加入Ⅱ型胶原酶和含10%FBS 的DMEM/F12,置于离心管中每隔1 h 超声15 s, 共消化3 h。2 组细胞随后转移至离心管中, 采用细胞过滤器(孔径70 μm) 过滤软骨组织, 1 000 r·min-1 离心5 min。加入培养液重悬细胞, 接种于培养瓶中, 置于37℃、5%CO2 培养箱中培养。
1. 3 2组软骨细胞的存活率和直径检测 取2组原代分离后的软骨细胞,移液枪反复吹吸均匀后稀释50 倍,与0. 4% 台盼蓝染色液等比例混合,制备成细胞悬液稀释液。在细胞计数板中加入10 μL 细胞悬液稀释液,采用细胞计数仪检测2 组分离的原代软骨细胞存活率和直径。细胞存活率= 存活细胞数/细胞总数×100%。
1. 4 甲苯胺蓝染色观察 2 组软骨细胞形态表现 取原代分离的软骨细胞,以1×105 mL-1 的密度接种于24 孔细胞培养板中, 每孔500 μL, 培养箱培养2 d 后。取出24 孔细胞培养板,吸干培养基,加入PBS,清洗2 次,每次1 min。再向24 孔细胞培养板加入甲苯胺蓝染液预染10 min,每孔200 μL。预染后, 每孔滴加等量蒸馏水吹打混匀, 静置30 min 复染。随后每孔加入蒸馏水清洗2 次,每次30 s。最后加入适量蒸馏水完全浸没软骨细胞,在显微镜下观察2 组软骨细胞形态表现。
1. 5 CCK-8法检测 2组软骨细胞增殖活性 取原代分离后的软骨细胞,以1×105 mL-1 的密度接种于96 孔细胞培养板中, 每孔100 μL, 待软骨细胞成功贴壁后, 培养12、24 和48 h 时, 每孔加入10 μL CCK-8 试剂, 混匀后放入培养箱孵育2 h。采用酶标仪检测于450 nm 波长处检测吸光度(A)值,并计算软骨细胞增殖活性。细胞增殖活性=(实验孔A 值- 空白孔A 值) / (对照孔A 值-空白孔A 值) ×100%。
1. 6 2组软骨细胞黏附率检测 取培养至第2天的原代细胞,在显微镜下观察其密度达到80%~90%时,在贴壁的软骨细胞中加入适量胰酶进行消化,待软骨细胞呈现悬浮状态时加入培养液终止消化,取软骨细胞悬液计数。再在24 孔细胞培养板中接种软骨细胞,密度为1×105 mL-1,每孔1 mL,置于培养箱培养1. 5 h。吸干孔板中的培养液,转至15 mL 离心管中,采用1 mL 培养液洗涤孔板1 次,与上述培养液混合, 1 000 r·min-1 离心5 min, 吸弃上清,加入1 mL 培养液重悬离心管底部的细胞沉淀, 吹打均匀后与细胞计数液以1∶ 100 比例混合,制成细胞悬液稀释液, 采用细胞计数板进行计数。重复操作3 次, 计算软骨细胞黏附率[19]。软骨细胞黏附率= (细胞总数- 脱落细胞数) /细胞总数×100%。
1. 7 Hoechst/PI 染色法检测 2 组软骨细胞凋亡情况 取原代分离的软骨细胞,接种于含不同成分培养液的24 孔细胞培养板, 密度为1×105 mL-1,置于培养箱中培养1 d。吸干培养基,PBS 缓冲液洗涤2次。在含1 mL PBS 缓冲液的离心管中加入5 μLHoechst 染色液和5 μL PI 染色液,采用移液枪反复吹打混匀后加入24 孔细胞培养板中,4 ℃避光孵育15 min,PBS 缓冲液洗涤1 次。在荧光显微镜下检测红色荧光和蓝色荧光观察并采集图像。正常细胞表现为低蓝色/低红色(Hoechst+/PI+),凋亡细胞表现为高蓝色/低红色(Hoechst++/PI+), 坏死细胞表现为低蓝色/高红色(Hoechst+/PI++)。
1. 8 MTT 法检测含不同成分培养液中软骨细胞的增殖活性 取原代分离的细胞,以 1×105 mL-1的密度接种于96 孔细胞培养板中,每孔加入100 μL细胞悬液和含0% (空白组1)、0. 5%、1. 0%、2. 0%、4. 0% 和10. 0% 的FBS, 0 (空白组2)、0. 1 、0. 2 、0. 4 、0. 8 、1. 0 、2. 0 g·L-1 VC 及0 ( 空白组3)、0. 5 、1. 0 、2. 0 、4. 0 、8. 0 、10. 0 μg·L-1 PLGA 纳米粒子的培养液, 培养箱中培养12 h。每孔加入10 μL MTT (5 g·L-1),置于培养箱中培养,2 h 后彻底吸干上清, 每孔的甲臜颗粒采用100 μL 二甲基亚砜溶解, 采用酶标仪检测570 nm 处A 值,并依据“1. 5”中计算公式计算各组软骨细胞增殖活性。
1. 9 RT-qPCR 法检测软骨细胞中目的基因表达水平 将 细 胞 分 为 DMEM/F12+10%FBS 组、DMEM/F12+1%FBS 组、DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA 组。取各组培养48 h 后的细胞, 分别加入1 mL TRIzol RNA 提取液,充分裂解,每管加入200 μL 氯仿试剂,4 ℃下、13 000 r·min-1 离心15 min。在新的离心管中加入200 μ L 上层水相, 加入等量预冷异丙醇,混匀,置于冰上5 min, 4 ℃ 、13 000 r·min-1 离心5 min。弃上清,向沉淀中加入500 μL 75% 乙醇(由RNasefree ddH2O 与无水乙醇配制), 混匀, 洗涤沉淀,4 ℃、13 000 r·min-1 离心5 min。弃上清, 尽量吸干乙醇,晾干沉淀,根据离心管底部RNA 沉淀的量加入20~100 μL RNase free ddH2O 溶解沉淀。测量提取总RNA 浓度, 按照RNA 反转录试剂盒操作说明进行逆转录合成cDNA。按照FastStartUniversal SYBR Green Master (Rox) 试剂盒说明书进行RT-qPCR 检测, 反应条件为95 ℃ 、15 s,60 ℃、60 s,共40 个循环,以大鼠β-肌动蛋白为内参重复3 次,采用2-ΔΔCT 法计算2 组软骨细胞中性别决定区域Y 框转录因子9 (sex-determining regionY-box 9, SOX9)、Ⅱ 型胶原α1 链(collagen typeⅡ alpha 1 chain, COL2A1)、Ⅹ 型 胶 原 α1 链(collagen type Ⅹ alpha 1 chain,COL10A1) 和基质金属蛋白酶13 (matrix metallopeptidase 13,MMP13) mRNA 表达水平。引物序列见表1。
1. 10 免疫荧光法观察软骨细胞中COLⅡ和SOX9表 达 情 况 取 原 代 分 离 的 软 骨 细 胞 , 接 种 于10%FBS、1%FBS、1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA 3 种不同成分培养液的24 孔细胞培养板, 加入 DMEM/F12, 分为DMEM/F12+10%FBS 组、DMEM/F12+1%FBS 组和DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA 组,密度为1×105 mL-1,置入培养箱中培养1 d。吸弃一 半 培 养 液, 加 入 200 μ L 4% 多 聚 甲 醛(paraformaldehyde, PFA) 预固定5 min。吸弃液体, 加入300 μL 4% PFA 固定30 min。吸弃固定液后,每孔加入1 mL PBS 缓冲液洗涤3 次,每次3 min。每孔加入500 μL 封闭通透液(5% 牛血清白蛋白与0. 3% Triton 1∶ 1 混合) 室温避光封闭40 min。PBS 缓冲液洗涤3 次,每次3 min。加入稀释后的SOX-9 (1∶ 250) 和Ⅱ 型胶原(type Ⅱcollagen, COLⅡ)(1∶ 500) 一抗, 将24 孔细胞培养板置于湿盒中,置于4℃冰箱孵育过夜。PBS缓冲液洗涤3 次, 每次3 min。加入稀释后的抗兔(1∶500) 和抗小鼠(1∶500) 标记二抗避光孵育1 h。PBS 缓冲液洗涤3 次,每次3 min。每孔加入200 μL DAPI 染液避光染色8 min。PBS 缓冲液洗涤3 次,每次3 min,于倒置荧光显微镜下观察各组软骨细胞中COLⅡ和SOX9 表达情况,以荧光强度代表细胞中COLⅡ和SOX9 表达量。
1. 11 统计学分析 采用 GraphPad Prism 8统计软件进行统计学分析。2 组软骨细胞增殖活性、黏附率和各组细胞中SOX9、COL2A1、COL10A1 和MMP13 mRNA 表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用Tukey 检验。以Plt;0. 05 为差异有统计学意义。
2 结 果
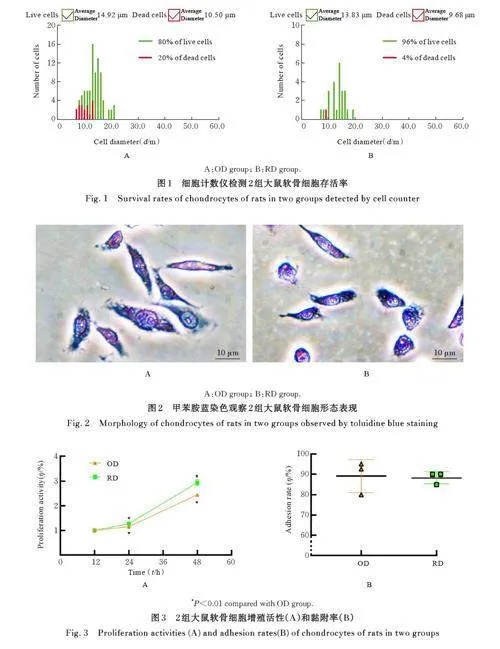
2. 1 2组软骨细胞存活率和直径 OD组原代软骨细胞存活率为80%, 细胞平均直径为10. 50 μm;RD 组原代软骨细胞存活率为96%,细胞平均直径为9. 68 μm,提示RD 组分离的原代软骨细胞存活率更高,且大小更为幼稚。见图1。
2. 2 2组软骨细胞形态表现 OD组原代软骨细胞形态较大,呈梭形,大多数细胞出现伪足;RD 组原代软骨细胞形态较小,大多数细胞呈菱形,仅部分细胞出现伪足。2 组原代软骨细胞经甲苯胺蓝特异性染色均显色明显,但RD 组消化时间较短,软骨细胞实际培养时间较OD 组缩短9~13 h,原代软骨细胞形态更为幼稚。见图2。
2. 3 2组软骨细胞增殖活性 OD组原代软骨细胞在培养24 h 时增殖较为缓慢,培养48 h 时增殖速度升高, 较培养12 h 时增殖活性明显升高(Plt;0. 01)。RD 组原代软骨细胞在培养24 h 时增殖速度稍缓,培养48 h 时增殖速度升高,较培养12 h 时增殖活性明显升高(Plt;0. 01)。在培养24 和48 h 时,与OD 组比较,RD 组原代细胞增殖速度升高(Plt;0. 05)。RD 组原代软骨细胞黏附率(89. 17%±8. 04%) 比OD 组(88. 33%±2. 89%) 略有降低,组间比较差异无统计学意义(Pgt;0. 05)。见图3。
2. 4 2组软骨细胞凋亡情况 2组软骨细胞多为正常细胞(Hoechst+/PI+)。RD 组软骨凋亡细胞(Hoechst++/PI+) 数少于OD 组, 2 组均无坏死软骨细胞(Hoechst+/PI++)。见图4。
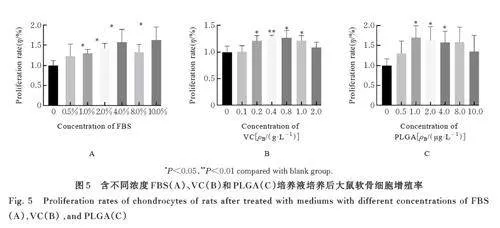
2. 5 含不同浓度 FBS、VC 和 PLGA 的培养液培养后大鼠软骨细胞增殖活性 大鼠软骨细胞增殖活性随着培养液中FBS 浓度升高而升高, 与空白组1 比较,培养液中含 1. 0%、2. 0%、4. 0% 和10. 0%FBS 组软骨大鼠细胞增殖活性明显升高(Plt;0. 05), 见图5A。与空白组2 比较, 培养液中含0. 2~1. 0 g·L-1 VC 组大鼠软骨细胞增殖活性明显升高(Plt;0. 05), 其中含0. 4 g·L-1 VC 时大鼠软骨细胞增殖活性最高(Plt;0. 01), 见图5B。与空白组3 比较, 含1. 0~4. 0 μg·L-1 PLGA 培养液组大鼠软骨细胞增殖活性明显升高(Plt;0. 05), 其中含1. 0 μg·L-1 PLGA 培养液时大鼠软骨细胞增殖活性最高(Plt;0. 05),见图5C。
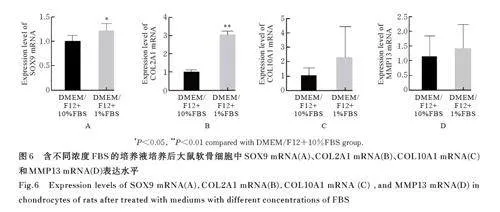
2. 6 含不同浓度FBS的培养液培养后大鼠软骨细胞中SOX9、COL2A1、COL10A1和 MMP13 mRNA表 达 水 平 与 DMEM/F12+10%FBS 组 比 较,DMEM/F12+1%FBS 组大鼠软骨细胞中SOX9mRNA 和COL2A1 mRNA 表达水平均明显升高(Plt;0. 05 或 Plt;0. 01), COL10A1 和 MMP13mRNA 表达水平略有升高, 但差异无统计学意义(Pgt;0. 05)。见图6。因此在含有1%FBS 的培养中添加0. 4 g·L-1 VC 和1. 0 μg·L-1 PLGA 对现有的培养液进行进一步改进。
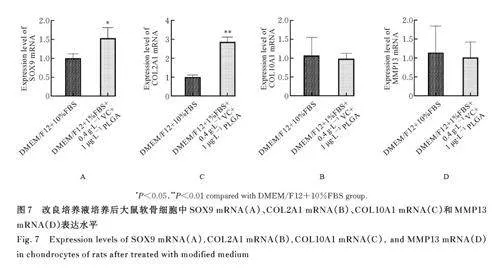
2. 7 改良培养液培养后大鼠软骨细胞中 SOX9、COL2A1、COL10A1 和 MMP13 mRNA 表达水平 与DMEM/F12+10%FBS 组比较, DMEM/F12+1%FBS+0. 4 g·L-1 VC+1. 0 μg·L-1 PLGA 组大鼠软骨细胞中SOX9 mRNA 和COL2A1 mRNA表 达 水 平 明 显 升 高(Plt;0. 01), COL10A1 和MMP13 mRNA 表达水平略有降低,但差异无统计学意义(Pgt;0. 05)。见图7。
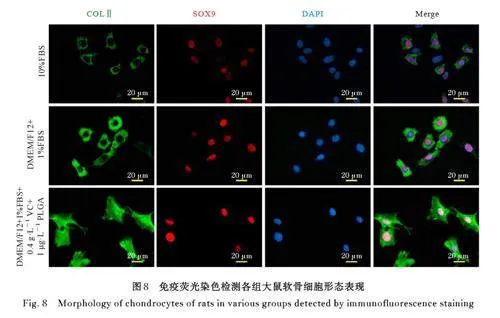
2. 8 改良培养液培养后软骨细胞中 COLⅡ和SOX9表达 经COLⅡ免疫荧光染色,软骨细胞的细胞质呈现绿色荧光, 经SOX9 免疫荧光染色细胞核呈现红色荧光; 经DAPI 染色细胞核呈现蓝色荧光, 可定位软骨细胞核。荧光显微镜下可见DMEM/F12+10%FBS 组部分软骨细胞中出现COLⅡ绿色荧光信号和SOX9 红色荧光信号,荧光强度弱。DMEM/F12+1%FBS 组大多数软骨细胞中出现COLⅡ绿色荧光信号和SOX9 红色荧光信号,荧光强度明显强于DMEM/12+10%FBS 组。DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1PLGA 组软骨细胞中均出现COLⅡ绿色荧光信号和SOX9 红色荧光信号, 可见荧光强度较DMEM/F12+10%FBS 组和DMEM/F12+1%FBS 组明显升高。荧光图像分析结果显示:DMEM/F12+1%FBS 组软骨细胞中COLⅡ和SOX9 蛋白表达量明显高于DMEM/F12+10%FBS组,DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA 组软骨细胞中COLⅡ和SOX9 蛋白表达量明显高于DMEM/F12+10%FBS 组。见图8。
3 讨 论
软骨细胞具有维持ECM 合成代谢和分解代谢动态平衡的作用。ECM 的主要成分是胶原蛋白和蛋白聚糖。透明软骨的特征是存在聚集蛋白聚糖(aggrecan, ACAN) 和COLⅡ , ACAN 单个分子上存在阴离子电荷,确保聚集体的产生。甲苯胺蓝染料中的阳离子与其结合, 使软骨细胞特异性染色。SOX9 是调控软骨分化和软骨细胞特异性基质基因表达的一种关键因子,可以直接调控COL2A1的表达[20-21]。COL2A1 是一种软骨细胞特异性基质基因,可以编码COL2A1[21-22]。在OA 中,软骨细胞转变为肥大软骨细胞和纤维软骨细胞。肥大软骨细胞的主要特征是表达Ⅹ 型胶原蛋白(collagentype Ⅹ,COLⅩ) 和MMP13 等相关转录因子[23]。COL10A1 是软骨细胞肥大和骨化的特征性基因,编码COLⅩ,促进软骨细胞分化成熟[24]。MMP13通 过 降 解 COLⅡ , 破 坏 软 骨 细 胞 基 质[24-25]。COL10A1 和MMP13 广泛用作软骨细胞炎症标志基因[26]。本研究结果显示:通过RD 分离后得到的软骨细胞具有甲苯胺蓝特异性染色,而改良培养液培养后,软骨细胞中特异性基因SOX9 和COL2A1mRNA 呈 高 表 达, 炎 症 相 关 基 因 COL Ⅹ 和MMP13 mRNA 呈低表达,SOX9 和COLⅡ蛋白高表达,表明改良分离和培养方法后得到的细胞为软骨细胞,且尚未发生炎症变化。
原代软骨细胞分离方法的主要缺陷在于消化时间过长。本研究采用RD 法将消化时间从原来的12~16 h 缩短至3 h, 有效分离了原代软骨细胞,明显提高了原代软骨细胞的存活率和增殖活性,降减少了细胞凋亡。RD 法分离出的软骨细胞形态更为幼稚,大部分细胞仍保持菱形。虽然RD 法使得原代软骨细胞的黏附率稍有下降,但是差异无统计学意义。本研究采用RD 法可以有效改善分离细胞时间长的缺陷,明显提高原代软骨细胞的质量。
原代软骨细胞培养方法的主要缺陷在于培养液所含有的FBS 可能对软骨细胞具有不良影响, 包括成分定义不清楚、不同批次之间存在差异和潜在传播动物病原体等,可能加速软骨细胞去分化,对软骨细胞的形态和功能产生影响,使软骨细胞的特异性产物表达水平下降[10]。本研究通过降低培养液FBS 浓度,从而对现有培养方法进行初步改良,结 果 显 示:与 含 10%FBS 的 培 养 液 比 较, 含1%FBS 的培养液中营养物质含量降低,软骨细胞增殖活性稍有降低,但不明显。软骨细胞中特异性产物SOX9 和COL2A1 mRNA 及蛋白表达水平明显提高。FBS 浓度降低后, 细胞中COL10A1 和MMP13 表达水平略微升高。为了降低FBS 浓度降低导致的营养不足和炎症风险,在含1%FBS 的培养液中添加VC 和PLGA 纳米颗粒进行改良。VC是一种常见的抗氧化剂,研究[27-28] 证实:VC 对软骨细胞基因表达起重要调控作用,可以促进软骨细胞增殖。PLGA 具有良好的生物相容性和降解性,研究[29] 显示:阳离子PLGA 微载体有利于软骨细胞增殖和附着,可增加与培养液的接触面积。将体外培养的软骨细胞和PLGA 纳米颗粒共培养,可能有利于对人体软骨组织缺损部位进行种子细胞及纳米材料的共移植。在含1%FBS 的培养液中添加0. 4 g·L-1 VC 和1 μg·L-1 PLGA 弥补了培养液降低FBS 浓度带来的细胞增殖活性降低的问题。本研究结果显示:改良培养基培养后,与DMEM/F12+10%FBS 组比较, DMEM/F12+1%FBS+0. 4 g·L-1 VC+1 μg·L-1 PLGA 组细胞中SOX9 和COL2A1 表达水平明显升高,COL10A1 和MMP13表达水平略有降低,说明改良培养基延缓了软骨细胞的分化成熟与炎症表达,改善了营养缺乏问题,促进了软骨细胞增殖,维持了软骨细胞活力。
综上所述,本研究改进了原代软骨细胞的分离和培养方法,缩短了原代软骨细胞分离时间,提高了分离效率,降低了培养成本,提高了软骨细胞质量,为软骨细胞原代培养实验提供了一个模拟体内环境的体外系统,为软骨细胞的特性及机制研究和软骨细胞相关疾病研究提供了科学依据。
利益冲突声明:所有作者声明不存在利益冲突。
作者贡献声明:杨丹聃和陈骄阳参与论文实验设计和实施、数据的获取和分析、论文的撰写及修改,王馨珩和赵泽彤参与论文的修改,潘莹参与实验数据的获取,高长曌和薛百功参与实验设计和论文撰写指导。
*陈骄阳,吉林大学第二临床医学院2021 级临床医学专业
△赵泽彤,吉林大学口腔医学院2022 级口腔医学专业
[参考文献]
[1] LIN W F, KLEIN J. Recent progress in cartilage
lubrication[J]. Adv Mater, 2021, 33(18): e2005513.
[2] LI M Z, YIN H, YAN Z N, et al. The immune
microenvironment in cartilage injury and repair[J]. Acta
Biomater, 2022, 140: 23-42.
[3] PENG Z, SUN H, BUNPETCH V, et al. The
regulation of cartilage extracellular matrix homeostasis in
joint cartilage degeneration and regeneration [J].
Biomaterials, 2021, 268: 120555.
[4] BEDNARCZYK E. Chondrocytes in vitro systems
allowing study of OA[J]. Int J Mol Sci, 2022, 23(18):
10308.
[5] 邓林峡, 余慕雪, 潘思年, 等. 比较单独消化法及分步
消化法培养新生大鼠原代软骨细胞的生物学特性[J].
中国组织工程研究, 2018, 22(25): 4047-4052.
[6] XU J Y, LV S, HOU Y, et al. miR-27b promotes
type Ⅱ collagen expression by targetting peroxisome
proliferator-activated receptor- γ2 during rat articular
chondrocyte differentiation[J]. Biosci Rep, 2018,
38(1): BSR20171109.
[7] YAN Y X, FU R, LIU C Q, et al. Sequential
enzymatic digestion of different cartilage tissues: a rapid
and high-efficiency protocol for chondrocyte isolation,
and its application in cartilage tissue engineering[J].
Cartilage, 2021, 13(2 suppl): 1064S-1076S.
[8] FRESHNEY R I. Culture of animal cells: a manual of
basic technique and specialized applications[M]. 8th ed.
Hoboken, NJ, USA: John Wiley amp; Sons, 2010.
[9] ECKE A, LUTTER A H, SCHOLKA J, et al. Tissue
specific differentiation of human chondrocytes depends
on cell microenvironment and serum selection[J]. Cells,
2019, 8(8): 934.
[10]GOLDRING M B. Human chondrocyte cultures as
models of cartilage-specific gene regulation[J]. Methods
Mol Med, 2005, 107: 69-95.
[11]SONTHITHAI P, HANKAMONSIRI W,
LERTWIMOL T, et al. A novel modified culture
medium for enhancing redifferentiation of chondrocytes
for cartilage tissue engineering applications [J].
Biotechnol Prog, 2022, 38(3):e3240.
[12]LAM J, LEE E J, CLARK E C, et al. Honing cell and
tissue culture conditions for bone and cartilage tissue
engineering[J]. Cold Spring Harb Perspect Med. 2017,
7(12):a025734.
[13]BAČENKOVÁ D, TREBUŇOVÁ M,
DEMETEROVÁ J, et al. Human chondrocytes,
metabolism of articular cartilage, and strategies for
application to tissue engineering[J]. Int J Mol Sci,
2023, 24(23):17096.
[14]ESMAEILI A , HOSSEINI S , KAMALI A , et al.
Co-aggregation of MSC/chondrocyte in a dynamic 3D
culture elevates the therapeutic effect of secreted
extracellular vesicles on osteoarthritis in a rat model[J].
Sci Rep, 2022, 12(1):19827.
[15]SINGH D, LINDSAY S, GURBAXANI S, et al.
Elastomeric porous poly(glycerol sebacate) methacrylate
(pgsm) microspheres as 3D scaffolds for chondrocyte
culture and cartilage tissue engineering[J]. Int J Mol
Sci, 2023, 24(13):10445.
[16]ZHENG J, CHEN H J, LU C Y, et al. 3D culture of
bovine articular chondrocytes in viscous medium
encapsulated in agarose hydrogels for investigation of
viscosity influence on cell functions [J]. J Mater
Chem B, 2023, 11(31):7424-7434.
[17]BAI L, HAN Q B, HAN Z Y, et al. Stem cells
expansion vector via bioadhesive porous microspheres for
accelerating articular cartilage regeneration [J]. Adv
Healthc Mater, 2023, 10:e2302327.
[18]SU Y,ZHANG B L, SUN R W, et al. PLGA-based
biodegradable microspheres in drug delivery: recent
advances in research and application[J]. Drug Deliv,
2021, 28(1): 1397-1418.
[19]钟烨.FOXQ1-siRNA对甲状腺癌TPC-1细胞EMT的
影响[D]. 唐山: 华北理工大学, 2019.
[20]LONG F, ORNITZ D M. Development of the
endochondral skeleton[J]. Cold Spring Harb Perspect
Biol, 2013, 5(1): a008334.
[21]YASUDA H, OH C D, CHEN D, et al. A novel
regulatory mechanism of type Ⅱ collagen expression via
a SOX9-dependent enhancer in Intron 6[J]. J Biol
Chem, 2017, 292(2): 528-538.
[22]GOLDRING M B, MARCU K B. Cartilage
homeostasis in health and rheumatic diseases [J].
Arthritis Res Ther, 2009, 11(3): 224.
[23]WANG X Q , GUAN Y M , XIANG S Y , et al.
Role of canonical wnt/β-catenin pathway in regulating
chondrocytic hypertrophy in mesenchymal stem cell-based
cartilage tissue engineering[J]. Front Cell Dev Biol,
2022, 10: 812081.
[24]KOMORI T. Runx2, an inducer of osteoblast and
chondrocyte differentiation[J]. Histochem Cell Biol,
2018, 149(4): 313-323.
[25]WANG M N, SAMPSON E R, JIN H T, et al.
MMP13 is a critical target gene during the progression of
osteoarthritis[J]. Arthritis Res Ther, 2013, 15(1): R5.
[26]YUE J J, AOBULIKASIMU A, SUN W C, et al.
Targeted regulation of FoxO1 in chondrocytes prevents
age-related osteoarthritis via autophagy mechanism[J].
J Cell Mol Med, 2022, 26(11):3075-3082.
[27]LINDSEY R C, CHENG S, MOHAN S. Vitamin C
effects on 5-hydroxymethylcytosine and gene expression
in osteoblasts and chondrocytes: Potential involvement
of PHD2[J]. PLoS One, 2019, 14(8): e0220653.
[28]SANGHI D, MISHRA A, SHARMA A C, et al.
Elucidation of dietary risk factors in osteoarthritis knee—
a case-control study[J]. J Am Coll Nutr, 2015, 34(1):
15-20.
[29]CHUN K W, YOO H S, YOON J J, et al.
Biodegradable PLGA microcarriers for injectable
delivery of chondrocytes: effect of surface modification
on cell attachment and function[J]. Biotechnol Prog,
2004, 20(6): 1797-801.

