牛生精母细胞/精原干细胞分子标记GFRα-1的验证
杨 蕊,张博洋,朱春玲,张洪毅,潘英树,唐 博,张学明*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.吉林大学 动物科学学院,吉林 长春 130062)
精子发生是一个高度有序而复杂的过程,生精母细胞(gonocytes)和精原干细胞(spermatogonial stem cells,SSCs)的正常发育分化受多种激素和细胞因子等的调控[1-2]。在幼龄至性成熟前的雄性个体,其睾丸曲细精索为实芯结构,生精上皮仅由位于曲细精索中部的生精母细胞和位于周边的未成熟支持细胞(sertoli cells,SCs)构成[3-4]。SCs主要为精原细胞提供支持和营养作用,还有调控精子发生的功能[5]。随着日龄的增长和睾丸的发育,生精母细胞逐渐迁移至生精上皮基膜发育为SSCs;SCs和SSCs在激素和细胞因子等的调控下协同发育,SSCs不断增殖、分化和迁移,形成各级生精细胞;在青春期的特定阶段,生精上皮内侧逐渐形成腔隙,腔隙不断融合扩大成管腔,形成曲细精管[6-8]。因此,生精母细胞和SSCs是精子发生的基础,分离培养这些细胞对深入探讨精子发生机理有重要的意义,而其特异分子标记验证又是分离培养的关键环节。
目前,人和小鼠生精母细胞和SSCs的特异性分子标记相关研究已取得显著进展。研究表明,SCs产生的胶质细胞源神经营养因子(glial cell line-derived neurotrophic factor,GDNF)等对生精母细胞和SSCs的自我更新和增殖有重要调节作用[9]。而GDNF家族受体α-1(GDNF family receptor alpha-1,GFRα-1) 则可用于标记小鼠等的生精母细胞和SSCs[7,10]。但在牛等大家畜,由于缺乏种属特异性较强的抗体,虽有报道但尚有争议,有必要进行进一步的验证[1,11-13]。为此,基于前期工作,本研究从转录水平、蛋白表达水平和组织、细胞层面分别探讨了这一问题,以期为后续相关研究奠定基础。
1 材料与方法
1.1 主要试剂非必需氨基酸、β-巯基乙醇、青链霉素(双抗)购自Hyclone 公司;0.25% 胰蛋白酶、DMEM高糖培养基、磷酸盐缓冲液(PBS)购自Gibco 公司;胎牛血清(FBS)购自Biological Industries公司;牛血清白蛋白(BSA)购自Biosharp 公司;RNAiso plus购自大连TaKaRa公司;反转录试剂盒购自Thermo公司;胰蛋白酶、透明质酸酶购自Sigma;兔抗GFRα-1、Nanog、IgG抗体和SABC免疫组化试剂盒购自武汉博士德公司;山羊抗兔Alexa Flour®-594购自美国Life Technologies公司;核荧光染料DAPI购自北京碧云天公司;GFRα-1、Nanog、18S RNA引物由生工生物工程(上海)股份有限公司合成。
1.2 睾丸组织的冷冻保存和复苏动物实验均由吉林大学实验动物福利伦理委员会批准(No.SY201903002)。新生1 d龄健康荷斯坦犊牛睾丸在超净台内将白膜剥除并将睾丸剪成体积约0.5 cm3的小块,参照文献[1,14]方法将其液氮保存备用。取出冻存管,迅速置于37℃水浴中解冻复苏睾丸组织,一部分用于原代生精细胞分离,另一部分用于石蜡切片苏木精-伊红(HE)染色、冰冻切片免疫荧光染色或曲细精索漂浮染色。
1.3 RT-PCR按1.2方法去除睾丸间质,收集纯化的曲细精索段。用TRIzol Reagent常规提取总RNA于-80℃保存备用。将细胞总RNA用反转录试剂盒反转为cDNA。PCR反应体系:R-Taq酶12.5 μL,cDNA 1 μL,上、下游引物(10 μmol/L)各0.5 μL,水10.5 μL。PCR反应条件:95℃预变性5 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,共45个循环,72℃延伸5 min。引物及片段大小见表1。
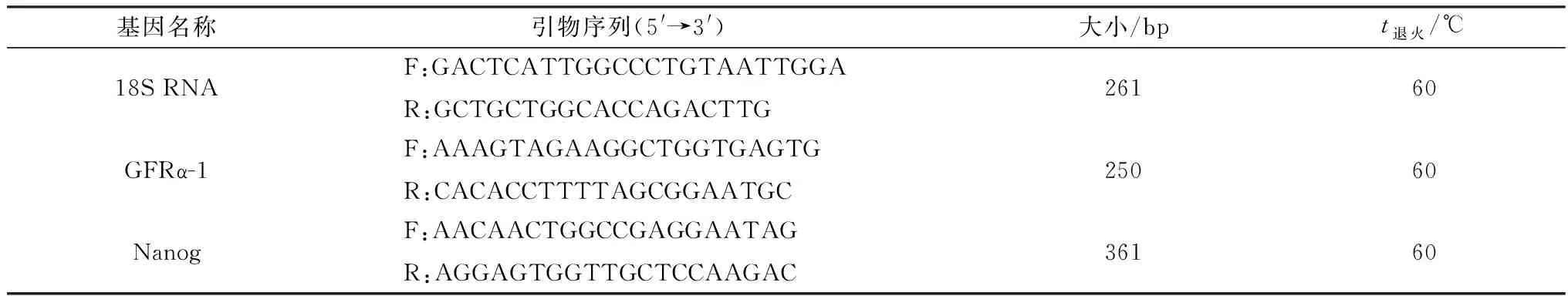
表1 PCR引物信息
1.4 石蜡切片HE染色将睾丸组织用PBS清洗后在4%多聚甲醛4℃下固定过夜,流水冲洗30 min,常规脱水、透明、包埋后切片(5 μm)烘干。经二甲苯脱蜡、透明、复水、HE染色、梯度乙醇脱水、二甲苯透明后,用中性树脂封片,晾干后观察拍照。
1.5 生精母细胞分离培养参照文献[4]方法,将睾丸组织复苏后PBS清洗,用眼科剪将其充分剪碎,用PBS吹打重悬,静置10~15 min后弃上清,重复多次直至去掉间质细胞和组织,获得较纯的曲细精索段。加入消化液Ⅰ(含50 mg/L DNaseⅠ及1 g/L 胶原酶Ⅳ的DMEM),在5% CO2、37℃条件下孵育30 min,随后用含有10% FBS的DMEM终止消化,离心洗涤(1 000 r/min,5 min)去除上清,加入消化液Ⅱ(含1 g/L胰蛋白酶、1 g/L透明质酸酶、50 mg/L DNase Ⅰ、1 g/L胶原酶Ⅳ的DMEM)同条件孵育5~10 min,孵育过程中需反复在显微镜下观察组织消化程度,有大量单细胞出现后即终止消化;PBS离心洗涤数次,将所获细胞用培养液(高糖DMEM+10% FBS+1%非必需氨基酸+0.1% β-巯基乙醇)重悬,40 μm网筛过滤去除未消化的组织块及细胞团块,将细胞接种于0.1%明胶包被的培养皿中,5% CO2、37℃下培养2 h后观察并收集未贴壁细胞进行培养。
1.6 免疫组织化学染色组织冰冻切片(30 μm)的免疫染色步骤为:将切片用PBS缓冲的4%多聚甲醛室温固定30 min,用30% H2O2-甲醇溶液(1∶50)室温孵育30 min,双馏水洗2次,再用5% BSA处理20 min;GFRα-1一抗(1∶200)室温孵育1 h,PBS洗3×5 min(下同),加入生物素化山羊抗兔二抗(1∶100)室温下处理2 h;PBS洗后滴加SABC试剂,室温孵育20 min;PBS洗后用DAB显色,镜下控制时间,蒸馏水清洗;封片晾干后显微镜下观察拍照。
1.7 免疫荧光染色曲细精管漂浮免疫荧光染色按如下步骤进下[11,15]。按1.5中所述,分离获得的曲细精索段置于1.5 mL离心管中(以下都在管中进行),4%多聚甲醛室温固定30 min,PBS洗后用50 mmol/L 甘氨酸处理15 min;PBS洗后用PBS+(加4%山羊血清+0.5% Triton X-100)处理1 h,加兔抗GFRα-1(PBS+1∶200稀释)4℃孵育过夜。次日PBS清洗后用Alexa Fluor®594-山羊抗免IgG(PBS+1∶500稀释)室温避光(下同)孵育1 h;PBS清洗后加入DAPI(PBS 1∶1 000稀释)染色10 min,磷酸缓冲液清洗3×5 min,将染色后的曲细精索段捞出铺到载玻片上晾干,用抗淬灭剂封片,用Nikon 80iFL-F-P荧光显微镜观察拍照。培养细胞(5 d)的免疫荧光染色步骤基本同上。

2 结果
2.1 Nanog和GFRα-1 mRNA在犊牛曲细精索中的表达RT-PCR分析显示,犊牛生精上皮有多能性基因Nanog和生精母细胞/精原干细胞标记基因GFRα-1 mRNA的表达,后者的表达水平显著高于前者(P<0.05)。

图1 新生犊牛曲细精索生精上皮中Nanog和GFRα-1 mRNA表达的RT-PCR检测(*示P<0.05)
2.2 GFRα-1蛋白在犊牛生精母细胞中的表达HE染色显示,曲细精索结构及睾丸间质保存良好,曲细精索中部可见许多SSCs的前体细胞,即生精母细胞,其核质较大,呈大圆形(红色箭头);紧靠基膜位于生精上皮周边的是细胞核深染的未成熟SCs;生精上皮基膜、长梭形管周肌样细胞及睾丸间质细胞等结构均清晰可见(图2A)。以IgG为阴性对照(图2B),GFRα-1免疫组织化学染色显示,曲细精索内的中部有许多大圆形阳性细胞(红色箭头),其位置和分布与图2A中生精母细胞一致(图2C);曲细精索GFRα-1免疫荧光漂浮染色全铺片结果进一步显示,GFRα-1阳性细胞位于曲细精索中部,与图2A、C显示的生精母细胞一致。

A.HE染色;B~C.GFRα-1免疫组化染色(B为阴性对照);D~F.曲细精索GFRα-1免疫荧光漂浮染色(D为DAPI染色示核,E为GFRα-1阳性信号,F为DAPI/GFRα-1融合)红色箭头示生精母细胞
2.3 GFRα-1在体外培养犊牛生精母细胞/SSCs中的表达犊牛生精上皮细胞原代培养2 h后部分细胞(主要是SCs)贴壁极化,伸出多个突起,而生精母细胞尚未贴壁。此时,收集悬浮细胞(主要为生精母细胞)进一步培养,5 d后进行免疫荧光染色鉴定(图3)。这些细胞表现为典型的生精细胞形态,呈单个、成对、团链状、簇状存在(图3A,E,红色虚线和箭头),贴附在少量未去除净的有巨大扁平核的SCs上(图3B,D,F,H,白色箭头)生长,仍有GFRα-1和Nanog蛋白的表达(图3C,D,G,H)。
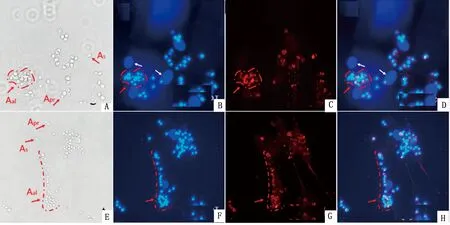
A,E.差速贴壁分离培养5 d后明场示单个、成对、团链(簇)状的生精母细胞/SSCs;B,F.DAPI染色;C.GFRα-1阳性染色;D.DAPI/GFRα-1融合;G.Nanog阳性染色;H.DAPI/Nanog融合;红色箭头示生精母细胞/SSCs;白色箭头示SCs核
3 讨论
哺乳动物精子发生是一个持续不断的细胞增殖与分化过程。在新生个体的睾丸中,曲细精索呈实芯状,此时生精上皮仅由位于中部的生精母细胞和周边的未成熟SCs两类形态截然不同的细胞组成[1,3-4,11]。这一阶段在不同物种持续的时间不同,因细胞类型少,所以此阶段有利于生殖细胞或SCs分离纯化。随着睾丸发育的进行,SCs不断接近成熟;生精母细胞则从中央渐向上皮基膜迁移并不断增殖分化,到达由基膜和SCs突起及紧密连接等结构形成的基底室,形成SSCs。SSCs通过自我更新和多次增殖分化,形成单个型(Asingle,As)、成对型(Apaired,Apr)、链状(Aaligned,Aal)、A1-4型、间型(intermediate)、B型精原细胞及精母细胞、精子细胞、精子等,镶嵌在SCs胞质侧面和顶部形成的凹陷中[3,7]。接近性成熟时,曲细精索中部逐渐形成管腔,此时称为曲细精管,此时生精上皮由成熟SCs和各级生精细胞组成,细胞类型较为复杂,不利于各类细胞的分离纯化及其分子标记检测。鉴于以上原因,本研究选用新生1 d龄犊牛睾丸为试验材料。
在啮齿类、人、猴等物种,GFRα-1可作为SSCs的相对特异的分子标记已取得共识[7,10,16]。在牛、羊、猪等大家畜,由于缺乏有种属特异性的抗体等因素,GFRα-1在生精母细胞/SSCs的表达虽有报道,但仍有争议[1,11-13]。为此,本试验从转录水平和蛋白水平、组织细胞原位和体外培养方面探究了这一问题。首先,分离了犊牛曲细精索片段,提取了生精上皮总RNA,RT-PCR方法检测了Nanog和GFRα-1 mRNA水平的表达。Nanog是细胞多能性因子之一,其表达与生精母细胞/SSCs可分化为三胚层来源组织细胞的报道一致[17]。高水平GFRα-1 mRNA的表达提示其可作为生精母细胞/SSCs的分子标记。
HE染色显示,犊牛曲细精索中生精母细胞的形态和位置与小鼠一致[8]。在此基础上,本试验分别用普通免疫组化技术和曲细精索漂浮免疫荧光染色技术研究了GFRα-1在犊牛生精母细胞中的表达。这些GFRα-1阳性细胞的形态、大小和位置与HE染色切片中所示的生精母细胞完全一致。这从蛋白表达水平说明,GFRα-1可作为犊牛生精母细胞的分子标记。
本试验进一步用二步酶消化和差速贴壁法分离了犊牛生精母细胞,探讨了体外培养中这些细胞是否持续表达GFRα-1。形态学观察结果表明,牛生精母细胞经短暂培养后,其后代细胞表现出典型的SSCs或未分化精原细胞的特征,即呈单个存在的As型和由不完全胞质分裂形成的细胞间桥(intercellular bridges)相连的Apr、Aal型等[7,10,17]。免疫荧光染色显示,这些细胞不但持续表达GFRα-1蛋白,还表达多能性标记蛋白Nanog,提示其为生精母细胞来源细胞且有一定干性(stemness)。
综上所述,本研究基于前期基础,从mRNA和蛋白水平、组织细胞原位表达和培养细胞表达等方面,验证了GFRα-1在牛生精母细胞及其后代细胞SSCs中的表达,为后续相关研究奠定了基础。

