木薯多孔淀粉基止血粉的止血性能及生物相容性研究



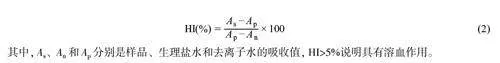



摘要 酶改性淀粉在可生物降解止血材料的应用中表现出巨大潜力。本研究利用α-淀粉酶和糖化酶的水解作用得到木薯多孔淀粉(ECS),并通过负载钙离子和单宁酸制备木薯多孔淀粉基止血粉(ECS-Ca-T)。利用扫描电子显微镜(SEM)、红外(FTIR)光谱、X 射线衍射(XRD)和比表面积分析仪(BET)对ECS 及其止血粉的微观结构、孔径分布、结晶结构和成分进行了详细分析。通过溶血实验和创伤愈合实验探究了ECSCa-T 的生物相容性,通过体外凝血测试、大鼠创伤止血实验探究ECS-Ca-T 的止血性能,并考察了ECS-Ca-T的生物降解性。结果表明, ECS-Ca-T 具有较好的止血效果、生物相容性和可降解性。与市售颗粒止血粉相比, ECS-Ca-T 在大鼠断尾持续性出血和肝脏损伤止血方面具有优势,止血时间分别缩短了4.86 min 和8.6 s,并能够在5 s 内实现大鼠背部肌肉组织的快速止血;同时,在伤口愈合过程中, ECS-Ca-T 不会对机体造成不良影响,在第7 天降解达到94.5%。
关键词 木薯多孔淀粉;钙离子;单宁酸;止血;生物相容性
控制出血在医疗保健中具有重要意义。轻微伤口引起的出血通常通过先天止血机制即可控制,但较大的创面造成的持续性出血或者难以压迫的伤口需要借助其它止血方法或材料缓解[1]。因此,复杂出血情况处置的需求推动了止血材料的发展。
具有止血特性的新型材料的研发一直备受关注,以降低与出血相关的死亡率。淀粉是一种来源于植物的多糖,因其具有优异的生物相容性、生物可降解性和低免疫原性[2],成为止血材料的理想原料。迄今为止,研究人员已开发出多种形式的淀粉基止血材料,包括淀粉基海绵[3]、水凝胶[4]和颗粒。淀粉基止血凝胶具有明显的膨胀性和粘附性,能迅速止血并保持伤口湿润。然而,水凝胶制备条件复杂,在反应中需添加较多化学试剂,因此具有潜在毒性。Yang 等[5]制备了具有大孔结构和良好机械性能的双功能凝血海绵,以控制大量和不可压缩的出血。当压缩的海绵接触血液时,通过填塞效应膨胀以控制出血,但膨胀的海绵也会对伤口产生额外的压力损伤[1]。止血颗粒和粉末可用于多种类型的创伤,包括深度不同和形状不规则的伤口[1]。多孔淀粉(Porous starch, PS)具有稳定的结构、高孔隙率和较快的吸水速率[6],已被广泛用作吸附剂、催化剂和其它分子的有效载体。利用PS 优异的分子筛效应,可通过浓缩凝血因子快速实现止血[7];此外, PS 具有高度的生物可降解性,可被人体组织酶促分解为麦芽糖和葡萄糖低聚糖。PS 固有的生物安全性、制备简单和可长保存期的特性,使其成为最有吸引力的止血材料之一。
目前,研究人员主要对玉米多孔淀粉基止血材料进行了广泛研究,以玉米多孔淀粉为载体,负载阳离子、亲水基团和多种促凝物质如氨甲环酸[8]、钙离子[9]和凝血酶[10]等。玉米多孔淀粉主要通过α-淀粉酶和糖化酶对玉米淀粉的水解作用获得。木薯淀粉与玉米淀粉同为A 型淀粉[11],对淀粉酶表现出较高的敏感性,但关于酶水解对木薯淀粉的影响方面的研究较少,也缺乏对木薯多孔淀粉在止血材料中的应用研究。因此,探究木薯淀粉在医用止血方面的应用,可充分发发挥木薯淀粉的应用价值。预实验结果显示,木薯淀粉颗粒经淀粉酶水解后能显著缩短凝血时间。基于此,本研究通过α-淀粉酶和糖化酶水解得到木薯多孔淀粉(酶解木薯淀粉, enzymatic porous cassava starch, ECS),并以ECS 为载体,负载钙离子和单宁酸制备止血材料,通过体内外实验探究ECS 基止血材料的止血性能、生物相容性和可降解性。
1 实验部分
1.1 仪器与试剂
SU8100 冷场发射扫描电镜(SEM,日本Hitachi 公司);IS10 傅里叶红外光谱仪(FTIR,美国Nicolet 公司);ASAP2460 全自动比表面积及孔隙度分析仪(BET,美国Micromeritics 公司);D2 PHASER X 射线衍射仪(XRD,德国Bruker-AXS 公司);T-6V 紫外-可见分光光度计(南京菲勒仪器有限公司)。
木薯原淀粉购于广西红枫淀粉有限公司;猪抗凝全血、大鼠富血小板血浆(PRP)购于广州鸿泉生物技术有限公司;α-淀粉酶(来源于Bacillus subtilis, 4000 U/g)和糖化酶(来源于Aspergillus niger,100000 U/mL)购于上海源叶生物科技有限公司;乳酸脱氢酶(LDH)检测试剂盒和磷酸缓冲液(PBS,pH = 7.4)购于上海碧云天生物科技有限公司;TegadermTM 膜购于明尼苏达矿业制造(上海)国际贸易有限公司;市售云南白药(YunNan)颗粒止血粉(云南白药集团股份有限公司);单宁酸、CaCl2、十二水合磷酸氢二钠和一水合柠檬酸购于国药集团化学试剂有限公司;雄性SD 大鼠(SPF 级,体重200~250 g)购于北京维通利华实验动物技术有限公司(合格证号:SYXK(苏)2021-0056)。实验用水为去离子水。
1.2 实验方法
1.2.1 木薯多孔淀粉基止血粉颗粒的制备
称取39.9 g 十二水合磷酸氢二钠和8.8 g 一水合柠檬酸,用去离子水溶解并定容至1 L, 配制成磷酸氢二钠-柠檬酸缓冲溶液(pH = 5.4)。参考文献[12]的方法,将18 g 木薯原淀粉分散在60 mL 磷酸氢二钠-柠檬酸缓冲液(pH = 5.4)中并振荡。混合物在60 ℃下预热30 min, 然后加入100 U/g (干基淀粉)α-淀粉酶和200 U/g (干基淀粉)糖化酶反应16 h, 结束后,离心收集沉淀,洗涤并在‒80 ℃下冷冻8 h, 然后冷冻干燥得到ECS。参考文献[13]的方法,将10 g ECS 分散在40 mL 10% (m/V) CaCl2 溶液中搅拌4 h, 使ECS 负载Ca2+,离心收集沉淀,洗涤,并在‒80 ℃下冷冻8 h, 干燥,得到负钙ECS(ECS-Ca)。参考文献[14]的方法,将10 g ECS-Ca 分散在40 mL 5% (m/V) 单宁酸溶液中搅拌4 h, 使ECS-Ca 负载单宁酸分子,离心收集沉淀,洗涤并在‒80 ℃下冷冻8 h, 干燥后再经60Co 灭菌,得到ECS 基止血粉(ECS-Ca-T)。
1.2.2 结构表征
利用SEM 观察颗粒的表面形态,并通过Nano Measure 1.2 软件分析颗粒的微米级孔径分布。利用FTIR 分析每个样品的官能团。利用BET 在–196 ℃下吸附氮气,测定样品的比表面积和孔径分布,根据BET (Brunauer-Emmett-Teller)方程计算比表面积,并使用BJH (Barrett-Joyner-Halenda)法分析纳米级孔体积和孔径分布。利用XRD 测试样品的晶体结构,采用MDI Jade 5.0 软件分析结果。
1.2.3 体外凝血性能
(1) 血液凝固时间(BCT)的测定参考文献[15-16]的方法,称取10 mg 止血粉样品于5 mL 离心管中,于37 ℃水浴中预热5 min。加入1 mL 猪抗凝全血, 37 ℃保温3 min, 然后加入100 μL 0.2 mol/LCaCl2 溶液,并立即计时。为了判断血浆是否凝固,每隔10 s 倾斜一次试管,以血浆完全失去流动性的时间为凝固时间。未作任何处理的抗凝全血为空白对照组。每个样品测试3 次。
(2) 血液凝固指数(BCI)的测定依据文献[16]的方法,称取5 mg 止血粉样品置于离心管中,向5 mL 抗凝血中添加500 μL 0.2 mol/L CaCl2 溶液以引发抗凝全血的活化,立即向离心管中加入100 μL 活化的血液,将离心管置于37 ℃水浴中孵育。分别在0.5、1、2、3、5、7 和9 min 共7 个时间点向管中加入8 mL 去离子水,孵育5 min, 然后分别取200 μL 稀释的血红蛋白,通过紫外-可见分光光度计记录样品在540 nm 处的吸收值。BCI 按照公式(1)计算:
1.2.4 体内止血性能
通过异氟烷维持大鼠麻醉,异氟烷浓度为2%~2.5%,流量为500~700 mL/min。麻醉成功后,将大鼠平放在实验台上,取橡皮筋固定四肢,每只大鼠均进行以下3 项实验。(1)大鼠断尾止血将大鼠尾巴用碘伏和酒精消毒,然后在大鼠尾部距末端2 cm 处,用剪刀一次性剪断大鼠尾部,切口自出血3 s 后擦去血液,立即将尾部创口插入装有止血粉的离心管中,并启动秒表计时,每隔30 s 观察创口是否止血,用滤纸轻轻接触创口,若滤纸上未留下血迹,说明止血成功,从启动计时到止血成功所用的时间为止血时间[17]。空白对照组为断尾后不做任何处理的大鼠。(2)大鼠背部皮肤切除并止血取电动剪毛器剔除大鼠背部毛发备皮(以脊柱为中线,两侧备皮面积分别为4 cm×5 cm), 然后用碘伏和酒精消毒,待皮肤稍干后利用活检打孔器切除大鼠脊柱两侧直径约为1 cm 圆形区域皮肤,并用组织镊将圆孔内皮肤提起,利用组织剪尖头刺一孔洞,深至筋膜层,并沿孔洞将圆形区域内皮肤切除制造创口,然后用止血粉止血,记录止血时间[18]。空白对照组为皮肤切除后不作任何处理的大鼠。(3)肝脏损伤实验用碘伏和酒精对大鼠腹部消毒,然后在腹部正中切一长约2 cm 的纵行切口,用无菌纱布制作一次性洞巾铺在创口上,轻轻挤压腹部暴露肝脏,肝左(右)叶先后从切口被挤出,用生理盐水无菌纱布拖住并固定肝左(右)叶,在肝叶表面用刀片制造线型创面,长1 cm、深5 mm, 切口自由出血3 s 后立即擦去血液,平铺适量止血粉,加盖2 张2 cm×2 cm 滤纸,并按压,启动秒表计时。每隔30 s 揭开一张滤纸观察止血情况,直至出血停止,以不加压3 min 内无鲜红血液渗出为完全止血标准,记录完全止血时间[17]。空白对照组为肝脏损伤后不作任何处理的大鼠。
1.2.5 溶血率(HI)测试
将8 mL 抗凝血加入到含10 mL 生理盐水的试管中获得血液稀释液。将100 mg 止血粉样品浸入45 mL 生理盐水中,于37 ℃孵育24 h, 获得样品浸提液。
参考国家标准方法[19],将浸提液混匀,取10 mL 浸提液至新的试管中,阳性对照组为10 mL 生理盐水,阴性对照组为10 mL 去离子水。将全部试管放入37 ℃水浴中预热30 min, 然后每管添加200 μL 稀释血液,混匀,继续于37 ℃保温孵育1 h, 每30 min 颠倒试管2 次。800 r/min 离心5 min, 取上清液测定545 nm 处吸收值。HI 按照公式(2)计算:
1.2.6 血小板和红细胞粘附实验
参考文献[14]并稍作修改进行以下实验。(1)血小板粘附能力将新鲜大鼠富血小板血浆(PRP)稀释至2×108 cell/mL,取100 μL 稀释的PRP 悬液加入到5 mg 止血粉样品中,于37 ℃孵育30 min, 弃去上清液,并使用PBS 将未粘附的血小板去除,将混合物转移到一个新的离心管中,按照LDH 检测试剂盒提供的测试方法测定粘附的血小板数量。(2)血小板粘附状态将PRP 用等体积的PBS 稀释,取500 μL稀释的PRP 悬液加入10 mg 止血粉样品,在37 ℃下孵育30 min 后,用PBS 轻轻地清洗未被粘附的血小板;将粘附血小板的样品放在PBS 中超声振荡清洗10 min, 用2.5%戊二醛-PBS 溶液固定样品,并通过梯度乙醇脱水后,用SEM 观察样品粘附血小板的情况。(3)红细胞粘附能力10 mg 止血粉样品与500 μL 红细胞悬液孵育30 min, 用PBS 清洗未粘附的红细胞,然后将样品放置于5 mL 去离子水中超声清洗5 min, 并使用酶标仪测量清洗液在540 nm 处的吸收值。(4)红细胞粘附状态10 mg 止血粉样品与500 μL 红细胞悬液孵育作用30 min, 用PBS 清洗未粘附的红细胞,用2.5%戊二醛-PBS 溶液固定样品,并通过梯度乙醇脱水后,用SEM 观察ECS 止血粉粘附红细胞的情况。
1.2.7 全层皮肤缺损模型的创面愈合实验
用电动剪毛器剔除大鼠背部毛发备皮,然后用碘伏和酒精消毒,待皮肤稍干后利用活检打孔器切除大鼠脊柱一侧直径约为1 cm 圆形区域皮肤,撒上ECS-Ca-T 并在创面贴上1 片市售的TegadermTM 膜,以防止掉落,空白对照组的创面仅贴TegadermTM 膜。在不同时间点(0、1、4、7、11 和14 d)观察创面愈合情况并拍照[20]。切下与止血粉接触的皮肤和筋膜组织,用4%多聚甲醛固定液进行固定处理,随后用梯度乙醇进行脱水,并包埋于石蜡中。石蜡块以5 μm 厚为单位连续切片,直到组织被发现。组织切片置于载玻片上,用二甲苯脱蜡,采用苏木精和伊红染色,通过电子显微镜观察组织形态。
1.2.8 体外降解实验
ECS 基止血粉的体外降解实验是通过测定其浸没在包含α-淀粉酶的磷酸盐缓冲液(PBS, pH=7.4)模拟体液(1 mL 300 U/mL α-淀粉酶分散在1 L PBS)中的质量变化进行评估[3]。在浸没前,称取干燥ECS 样品重量并记录为M0。随后浸没在溶液介质中,在37 ℃水浴摇床中振荡,并且每天更换浸泡溶液。在特定的时间(1、2、3、4、5、6 和7 d), 用去离子水冲洗样品并冷冻干燥。测量每个样品的最终重量,记为Mt。根据公式(3)计算样品的失重率(D):
2 结果与讨论
2.1 ECS及其止血粉的结构表征
ECS 是木薯原淀粉颗粒在低于糊化温度下由α-淀粉酶和糖化酶共同作用下制得,其颗粒微观形态如图1A 和1B 所示。ECS 具有明显的微孔和大孔结构,并且较多颗粒存在一端有大孔的情况。ECS 表面存在均匀的凹坑,能够降低流体的阻力,同时大孔的存在有利于快速地将液体引导到微孔中[21]。ECS-Ca(图1C 和1D)和ECS-Ca-T(图1E 和1F)的微观结构与ECS 基本相同,说明负载Ca2+和单宁酸未对ESC 的颗粒结构产生影响。此外,酶处理产生的孔隙使ECS 的比表面积增加,同时伴随着吸附性增强, ECS 能够快速吸附血液中的液体,并达到富集凝血因子的目的[13]。
利用氮吸附比表面积分析仪测定得到ECS 的比表面积为9.72 m2/g, 孔径主要分布在3~5 nm 以及10~55 nm(图2A)。此外,通过Nano Measure 得到ECS 微米级孔径主要分布在约2 μm 左右(图2B)。利用XRD 检测ECS 及其止血粉的结晶结构(图2C),观察到ECS、ECS-Ca 和ECS-Ca-T 在15°、17°、18°和23°处都存在衍射峰,表明负载Ca2+和单宁酸后ECS 的结晶结构保持不变,仍呈现典型的A 型结晶结构。采用红外光谱检测样品官能团变化(图2D), ECS 的红外谱图在3286 cm–1 存在吸收峰,在ECS-Ca 和ECS-Ca-T 中该吸收峰分别位移到3266 和3291 cm–1, 这是由于Ca2+与淀粉分子的—OH 基团的相互作用所导致[9]。此外,在ECS-Ca-T 中观察到位于1500~1600 cm–1 处的单宁酸苯部分的环拉伸峰[22],说明单宁酸成功负载于ECS 上。
2.2 ECS基止血粉的体外凝血性能评价
通过测试全血凝固时间和全血凝固指数,探究ECS 及以其为载体所制备的止血粉的体外凝血效果。本实验使用猪抗凝全血,在血液中添加适量Ca2+以引发猪抗凝全血的凝血作用[23]。不同样品的全血凝固时间如图3A 所示,与空白组((20.17±1.02) min)相比,测试的4 种样品的BCT 值均显著降低(plt;0.0001)。其中, ECS-Ca-T 的BCT 值最小,与空白组相比, ECS-Ca-T 的BCT 值下降了16.93 min, 因其负载了Ca2+和单宁酸, Ca2+作为重要的凝血因子,接触血液即直接参与凝血途径;单宁酸具有大量的酚羟基,对多种蛋白具有亲和力[22],可能与血小板等凝血因子具有相互作用。
BCI 是以数据的形式表示不同时间点的血液凝固情况,随着凝血途径被激活,血液凝固的部分增加,未凝固的血液在添加去离子水后由于渗透压的变化导致红细胞破裂,从而溶出血红蛋白[24]。因此, BCI值越小的样品,促凝血效果越好。由图3B 可知, ECS-Ca-T 在1、2、3 和5 min 时,相对于ECS、ECS-Ca和云南白药而言都具有较高的凝血速率。在保温3 min 后, 4 种样品的BCI 均快速下降,其中, ECS-Ca-T的下降速率最快,添加了ECS-Ca-T 的血液凝固的部分最多,说明在相同的保温时间内, ECS-Ca-T 具有较好的促凝血效果。
2.3 生物相容性分析
HI 是用于评估植入式材料的血液相容性的简单且可靠的指标。根据国际标准,只有HI 低于5%的产品才能满足临床应用中的血液安全要求[21]。ECS 及以其为载体的止血粉的HI 如图4A 所示。经ECS、ECS-Ca 和ECS-Ca-T 提取物处理后,离心后得到的上清液为无色澄清的溶液。本实验未发现样品溶血。定量分析结果表明, ECS、ECS-Ca 和的ECS-Ca-T 的溶血率分别为1.6%、2.5%和1.5%,说明ECS及以其为载体的止血粉具有较好的生物相容性。
观察ECS-Ca-T 作用于大鼠背部创面后伤口的愈合情况,以探究ECS-Ca-T 的残留是否会对大鼠机体造成不良影响。创面愈合状况如图4C 所示, 14 d 内均未出现红肿、流脓和发炎等情况,创口敷止血粉后颜色变深,可能是粉末吸液后粘附于伤口并开始降解所导致[25]。随着时间增加,对照组和ECS-Ca-T大鼠背部创口均结痂愈合,创面逐渐缩小。取愈合14 d 大鼠创口附近组织,并通过HE 染色观察创面愈合情况。如图4B 所示,空白和样品组的皮肤组织均未见炎症细胞,并且样品组的上层皮肤组织较厚,说明大鼠皮肤愈合状况良好, ECS-Ca-T 敷于创口后不会对组织造成不良影响。
2.4 ECS基止血粉作用于大鼠断尾、肝损伤和背部损伤的止血实验
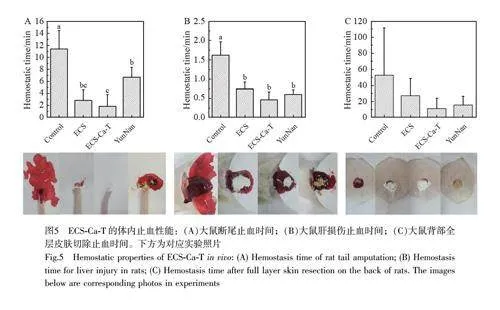
通过大鼠断尾实验中的止血时间评估ECS 和ECS-Ca-T 的止血效果。实验发现,大鼠断尾后创面会持续出血,若不及时处理,易导致大鼠失血过多。如图5A 所示,与损伤后不做任何处理的尾部伤口相比, ECS 和ECS-Ca-T 的止血时间从11.37 min 分别减至2.83 和1.87 min, 分别缩短了75.1%和83.6%;与云南白药(6.73 min)相比, ECS-Ca-T 的止血时间缩短了4.86 min。与市售止血粉相比, ECS-Ca-T 在治疗缓慢且持续性出血的创口方面具有明显优势。
为了进一步探究ECS 基止血粉对脏器损伤的止血效果,采用大鼠肝脏出血模型进行实验。肝脏是含有丰富血管的重要器官,肝脏破裂可以造成大出血,若不及时处理,可引起失血性休克[26]。如图5B 所示,与空白组相比,用ECS-Ca-T 处理肝脏伤口后,止血时间从96.75 s 减至27.20 s, 缩短了71.9%。与市售止血粉(35.80 s)相比,止血时间缩短了8.60 s, 说明ECS-Ca-T能够有效地治疗大鼠肝脏出血。
通过在大鼠背部打孔,观察ECS 和ECS-Ca-T 对背部渗血肌肉组织的止血效果。如图5C 所示,与损伤后不做任何处理的背部创口相比, ECS-Ca-T 能在5 s 内达到止血效果;但是, ECS 和ECS-Ca-T 的止血时间与云南白药相比无显著性差异。这可能是由于大鼠背部的出血来源为肌肉组织,虽然在短时间内不处理创面会持续渗血,但出血量有限,不同的止血粉都能对伤口达到密封止血的效果。
2.5 ECS基止血粉的体外降解
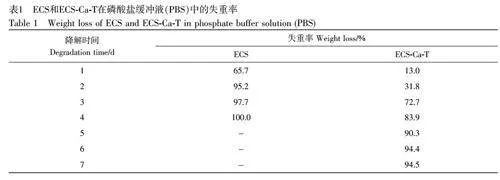
血清或血浆中α-淀粉酶催化淀粉分子中的α-1,4 葡萄糖苷键断裂,产生葡萄糖、麦芽糖及含有α-1,6糖苷键支链的糊精。胰α-淀粉酶是最重要的淀粉水解酶,分子量为40~50 kDa,与唾液淀粉酶相同,以活性状态分泌进入消化道[27]。除了胰腺和唾液腺之外,身体的很多组织比如腹腔中其他脏器、输卵管、乳腺以及卵巢等都能够产生淀粉酶,并且分泌进入全身循环系统[28]。因此ECS 基止血粉作用于机体伤口后,遗留的部分可能被体内淀粉酶降解。通过在模拟体液中添加适量的淀粉酶研究ECS 和ECS-Ca-T的降解性。ECS 和ECS-Ca-T 在模拟体液中的失重率见表1,在第4 天, ECS 已被完全降解;而ECS-Ca-T的降解速度相对较慢,在2 d 内的失重率仅为31.8%,第7 天时失重率升高至94.5%。这可能是由于ECS负载Ca2+和单宁酸后,两种物质大量附着在ECS 颗粒的孔隙、裂缝和凹坑处,导致淀粉酶与颗粒的反应位点减少。在降解初期, Ca2+和单宁酸附着量较大,随着时间延长,两者逐渐释放至模拟体液中,在降解3 d 后,失重率显著提高。
2.6 止血机理
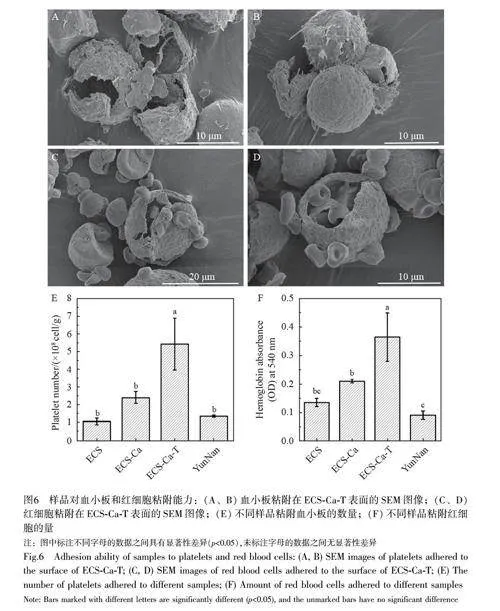
图6 展示了不同样本对红细胞和血小板的吸附能力。当负载Ca2+后, ECS 对血小板和红细胞的吸附能力显著增强(图6E 和6F),这可能是因为Ca2+有助于血浆凝固,进而包围更多的血细胞。在对Ca2+进行负载的基础上,进一步添加单宁酸, ECS 对血细胞的吸附能力明显增强(plt;0.0001)。主要是因为单宁酸中的酚羟基可与血细胞内的蛋白质相互作用,形成氢键,显著提高ECS 的吸附效率。有报道指出,红细胞聚集可有效地封闭伤口表面,阻止出血[29]。如图6F 所示, ECS-Ca-T 具有出色的与红细胞结合的能力。采用SEM 研究ECS-Ca-T 颗粒对血细胞的吸附状况。结果显示,大量红细胞被紧密地粘附在一起,并在ECS-Ca-T 区域的表面聚集(图6C 和6D)。更为关键的是,在ECS-Ca-T 表面观察到血小板发生了变形,并产生了大量伪足(图6A 和图6B),这表明血小板被激活,并在止血过程中发挥作用。大孔在帮助血液迅速进入微孔方面起到了关键作用,当血液从大孔流向微孔时,孔洞的尺寸逐步缩小,从而使血液的凝固因子能够快速聚集。因此,当ECS-Ca-T 与伤口的表面发生接触时,能够迅速地从流出的血液中吸取液体,从而聚集血小板、红细胞及其它凝血因子,加快凝血过程。
3 结论
将Ca2+和单宁酸负载于ECS 得到ECS-Ca-T 止血粉。与市售颗粒止血粉相比, ECS-Ca-T 在缓慢持续性的断尾出血的止血过程中表现出明显优势,能快速阻止大鼠肝脏大出血, ECS-Ca-T 既能通过本身的多孔结构聚集血小板和红细胞等凝血因子,又能通过Ca2+加速凝血过程,以及通过单宁酸对蛋白的相互作用吸引更多凝血因子,从而达到促进生理性止血的目的。本研究对探究ECS 在止血材料中的应用具有重要的参考意义。通过采用其它的改良方法或加入其它的凝血和抗炎因子,可以实现ECS 更广泛的应用。
References
[1] GUO B L, DONG R N, LIANG Y P, LI M. Nat. Rev. Chem. , 2021, 5(11): 773-791.
[2] ZHANG C Y, BAI Q, WU W D, HAN K, ZENG Q Y, DONG K, ZHANG Y N, LU T L. Int. J. Biol. Macromol. , 2021, 179:507-518.
[3] YANG X, LIU W, SHI Y F, XI G H, WANG M S, LIANG B, FENG Y K, REN X K, SHI C C. Acta Biomater. , 2019, 99:220-235.
[4] YAO M M, SUN H, GUO Z C, SUN X, YU Q Y, WU X J, YU C J, ZHANG H T, YAO F L, LI J J. Chem. Eng. J. , 2021, 421:129702.
[5] YANG H, YANG Y L, LI B Z, ADHIKARI B, WANG Y, HUANG H L, CHEN D. Carbohydr. Polym. , 2019, 231: 115692.
[6] ZHANG Xiao-Ming, ZHU Liang-Kui, CHENG Lei, YUAN Bi-Zhen. Chin. J. Anal. Chem. , 2019, 47(6): 862-868.
张晓明, 朱良奎, 成蕾, 袁碧贞. 分析化学, 2019, 47(6): 862-868.
[7] DEV V, HEMAMALINI T. Int. J. Biol. Macromol. , 2018, 118: 1276-1283.
[8] SU H T, WEI S D, CHEN F P, CUI R H, LIU C S. RSC Adv. , 2019, 9(11): 6245-6253.
[9] ZHU J J, SUN Y B, SUN W Z, MENG Z Y, SHI Q L, ZHU X X, GAN H, GU R L, WU Z N, DOU G F. Int. J. Biol.Macromol. , 2019, 134: 435-444.
[10] LI Q, LU F, SHANG S M, YE H L, YU K, LU B T, XIAO Y, DAI F Y, LAN G Q. ACS Sustainable Chem. Eng. , 2019, 7(10):9121-9132.
[11] WU Ru-Long, LIU Yu-Xin, LIANG Ze-Sheng, LIAO Liang-Yan, LI Yuan-Yuan. Mod. Food Sci. Technol. , 2023, 39(8): 48-54.
吴儒龙, 刘钰馨, 梁泽升, 廖梁燕, 李媛媛. 现代食品科技, 2023, 39(8): 48-54.
[12] HAN X Y, WEN H L, LUO Y, YANG J, XIAO W H, JI X Y, XIE J H. Food Hydrocolloids, 2021, 116: 106661.
[13] CHEN F P, CAO X Y, CHEN X L, WEI J, LIU C S. J. Mater. Chem. B, 2015, 3(19): 4017-4026.
[14] LIU J Y, HU Y, LI L, WANG C, WANG J, LI Y, CHEN D F, DING X K, SHEN C A, XU F J. Adv. Sci. , 2020, 7(22):2002243.
[15] LI Shen-Wan, HUANG Tong-Dai, ZHAI Bei-Bei, JIANG Yun-Jing, CAO Yu-Yu, WANG Zu-Xi, WEI Jie, SUN Hong-Mei.Chin. J. Anal. Chem. , 2022, 50(4): 554-563.
李申万, 黄童黛, 翟贝贝, 江云静, 曹玉玉, 王祖曦, 魏捷, 孙红梅. 分析化学, 2022, 50(4): 554-563.
[16] LIU Lin, BAN Yu, WEI Yue, WANG Ming-Zhe, CHE Chao-Yue, SHI Heng-Chong, ZHANG Xu, LUAN Shi-Fang. Chin. J.Anal. Chem. , 2021, 49(12): 1986-1994.
刘琳, 班雨, 魏悦, 王明哲, 车超越, 石恒冲, 张旭, 栾世方. 分析化学, 2021, 49(12): 1986-1994.
[17] QIAN J Q, CHEN Y, YANG H Y, ZHAO C Y, ZHAO X H, GUO H. Int. J. Biol. Macromol. , 2020, 160: 429-436.
[18] TENG L, SHAO Z W, BAI Q, ZHANG X L, HE Y S, LU J Y, ZOU D R, FENG C L, DONG C M. Adv. Funct. Mater. , 2021,31(43): 2105628.
[19] GB/T 16886. 4. Biological Evaluation of Medical Devices. National Standards of the People′s Republic of China.
医疗器械生物学评价. 中华人民共和国国家标准. GB/T 16886. 4.
[20] PENG X, XU X, DENG Y R, XIE X, XU L M, XU X Y, YUAN W H, YANG B G, YANG X F, XIA X F, DUAN L, BIAN LM. Adv. Funct. Mater. , 2021, 31(33): 2102583.
[21] BIRANJE S S, SUN J Z, SHI Y E, YU S J, JIAO H X, ZHANG M, WANG Q Q, WANG J, LIU J. Cellulose, 2021, 28(14):8899-8937.
[22] LI N, YANG X, LIU W, XI G H, WANG M S, LIANG B, MA Z P, FENG Y K, CHEN H, SHI C C. Macromol. Biosci. ,2018, 18(11): 1800209.
[23] MA Teng-Fei, LIU Chun-Feng, YAO Bing-Rong. Chin. Pract. Med. , 2023, 18(19): 107-109.
马腾飞, 刘春峰, 姚炳荣. 中国实用医药, 2023, 18(19): 107-109.
[24] CHEN Y, QIAN J Q, ZHAO C Y, YANG LC, DING J, GUO H. Eur. Polym. J. , 2019, 118: 17-26.
[25] XI C Y, ZHU L G, ZHUANG Y, WANG S F, SUN G X, LIU Y Q, WANG D Q. Clin. Appl. Thromb./Hemostasis, 2017, 24(2):279-286.
[26] ZHANG Z Y, KUANG G Z, ZONG S, LIU S, XIAO H H, CHEN X S, ZHOU D F, HUANG Y B. Adv. Mater. , 2018, 30(49):1803217.
[27] HONG W D, GENG W J, CHEN B C, BASHARAT Z, WU Q S, ZIMMER V, ZHOU M T. Ther. Clin. Risk Manage. , 2017,13: 1577-1584.
[28] SCHOTS J, LUYER M, NIEUWENHUIJZEN G. J. Gastrointest. Surg. , 2018, 22(7): 1163-1170.
[29] CINES D B, LEBEDEVA T, NAGASWAMI C, HAYES V, MASSEFSKI W, LITVINOV R I, RAUOVA L, LOWERY T J,WEISEL J W. Blood, 2014, 123(10): 1596-1603.

