基于碳点与金属有机框架复合材料的葡萄糖直接电化学传感平台








摘要 构建了一种基于碳点(CDs)与金属有机框架(MOF)复合材料的无酶葡萄糖电化学传感器。采用水热法分别制备了不掺杂、掺杂硼和掺杂氮的3 种碳点C-CDs、B-CDs 和N-CDs,进一步分别与ZIF-67 进行复合,制得3 种CDs@ZIF-67 复合材料,将其修饰在玻碳电极(GCE)上,构建了高灵敏无酶葡萄糖电化学传感器。CDs 与ZIF-67 的复合能够有效改善MOFs 导电性较差的问题,进而改善其催化活性。CDs 掺杂N 元素后, N 元素诱导CDs 表面产生更多的缺陷,加快了电子转移速率,因此N-CDs@ZIF-67 的电催化性能最佳。基于N-CDs@ZIF-67修饰GCE构建的传感器的响应电流与葡萄糖浓度在0.1~1000 μmol/L和1000~7000 μmol/L两段范围内分别呈良好的线性关系,检出限(S/N=3)为31.8 nmol/L。将此传感器用于实际人血清样本中葡萄糖的检测,加标回收率为101.5%~109.0%,相对标准偏差(RSD)小于3.1%,显示出良好的实用性。
关键词 金属有机框架;碳点;葡萄糖;电化学传感器
葡萄糖是生物体的主要能量物质,参与大多数细胞的新陈代谢。糖尿病是一种以高血糖为特征的代谢性疾病,严重危害人体健康,目前尚无法治愈,借助药物和调控食物摄入量可以将血糖浓度维持在一定范围内。因此,对血糖水平的快速即时检测对于居家血糖监测和临床诊断以及治疗均具有重要意义。
目前,检测葡萄糖浓度的方法有电化学法[1-3](包括临床及家庭中常用的血糖仪)、光学法[4]和比色法[5-7]等。相比于其它检测方法,电化学法具有灵敏度高、操作便捷、成本低、易于小型化和便携化等优点,广泛用于葡萄糖的检测[8-11]。目前,葡萄糖电化学传感器可分为传统的酶型葡萄糖电化学传感器[8]和基于新材料的无酶葡萄糖电化学传感器[9-11]两类。酶型葡萄糖电化学传感器主要是通过酶修饰电极的方法进行检测,成本较高,并且酶活性受温度和pH 值影响较大,容易失活,这些缺点阻碍了其进一步发展;另一类是无酶葡萄糖电化学传感器,通过新型纳米材料代替酶对电极进行修饰,既能够模拟酶活性,同时克服了生物酶易受环境影响的不足,能够快速、稳定和准确地对葡萄糖浓度进行检测,因此备受关注。
有机金属框架材料(MOFs)是由有机配体分子与金属离子通过配位键作用以不同的组合方式组装而成,能够形成具有独特内在特性的新型拓扑结构[12],具有可调孔隙、高比表面积、有序的晶体结构和分布均匀且密度高的金属活性位点等优点。从发现至今, MOFs 因具有优异的性能而得到了快速发展,在气体吸附[13]、电池电极材料[14]、分离[15]、催化[16]、靶向药物输送[17-18]和分析传感[19-21]等领域都有重要的应用。得益于各种MOFs 材料的开发,无酶葡萄糖电化学传感器也得到了快速发展。Chen 等[22]在碱性溶液中对玻碳上的镍基MOF 进行电化学活化,得到的非酶葡萄糖传感器在1~10 mmol/L 浓度范围内有良好的线性响应。Wu 等[11]制备了一种Cu-MOF 材料,以此制备的碳糊电极在葡萄糖的检测中表现出良好的电催化性能。为了获得高的检测灵敏度, Lu 等[23]将具有较大比表面积和良好导电性的UiO-67与对葡萄糖氧化具有较高电催化活性的Ni-MOF 结合,构建了一种新型核壳结构MOF@MOF 复合材料修饰的电化学传感器。Xu 等[24]通过两步原位电沉积方法得到了α-环糊精功能化的还原氧化石墨烯/镍基MOF 复合薄膜,用于葡萄糖的检测,具有线性范围宽和检出限低的的特点。沸石咪唑酯骨架结构材料(ZIFs)作为一种MOF 材料,其晶体结构比其它MOF 简单,易合成,因此被广泛应用。Shi 等[10]将铜纳米粒子(CuNPs)封装至ZIF-8 中,采用制得的Cu@ZIF-8 对电极进行改性,制备了无酶葡萄糖传感器。ZIF-8对CuNPs 的封装避免了CuNPs 的电化学溶解、迁移和团聚,使得该传感器表现出极高的稳定性。研究表明,采用MOFs 材料修饰电极用于构建无酶葡萄糖电化学传感器极具发展潜力。碳点(CDs)通常是指粒径小于10 nm 的碳基纳米材料[25],具有毒性低、可加快电子转移、生物相容性好和易功能化等优点,目前已成为新的研究热点,在生物传感[26]、荧光成像[27]和疾病诊疗[28]等领域引起了极大关注。将MOF与CDs 复合,可以克服MOF 的低导电性和金属活性位点易受到掩蔽的缺点[29],提高MOF 的分析性能。
本研究通过水热法制备了3 种掺杂不同元素的的CDs:无掺杂的CDs(C-CDs)、掺硼CDs(B-CDs)和掺氮CDs(N-CDs)。通过浸渍法将CDs 与ZIF-67 复合,得到CDs@ZIF-67 复合材料,将其修饰到玻碳电极(GCE)表面,构建了不同的无酶葡萄糖电化学传感器(图1)。ZIF-67 和CDs@ZIF-67 均对葡萄糖有很好的催化性能,表现出优异的稳定性和抗干扰能力。与单独的ZIF-67 相比, CDs@ZIF-67 复合材料具有更宽的线性范围和更低的检出限。推测可能是CDs 与ZIF-67 复合能够加快材料在电极表面的电子传输速度,进而有效增强材料的电催化性能,表明CDs@ZIF-67 复合材料是一种极具潜力的无酶葡萄糖电催化材料。比较了3 种CDs@ZIF-67 纳米复合材料对葡萄糖的电催化性能,结果表明, N-CDs 与ZIF-67 复合的材料电催化性能最佳,这可能是因为N 掺杂的CDs 能够诱导CDs 表面产生更多的缺陷,从而提高了CDs 的电子转移能力。
1 实验部分
1.1 仪器与试剂
CHI 660E 电化学工作站(上海辰华仪器有限公司);SU5000 扫描电子显微镜(SEM,日本Hitachi 公司);KRATOS AXIS His X 射线光电子能谱(XPS,英国Kratos 公司);FEI Tecnai 透射电镜显微镜(TEM,美国FEI 公司);TU-1901 紫外-可见吸收光谱仪(北京普析通用仪器有限公司);F-7000 荧光光谱仪(日本Hitachi 公司)。采用三电极体系:工作电极、参比电极和对电极分别为玻碳电极、饱和甘汞电极和铂丝电极(上海辰华仪器有限公司)。
Co(NO3)2·6H2O、2-甲基咪唑、L-谷氨酸、苯硼酸、尿素(UREA)、抗坏血酸(AA)、尿酸(UA)和乙醇(上海阿拉丁试剂有限公司);葡萄糖、多巴胺(DA)、(NH4)2SO4 和NaOH(西陇化工(广东)股份有限公司)。实验用水为二次蒸馏水。
1.2 ZIF-67的合成
参考文献[30]的方法并略作改进合成ZIF-67。称取2.2 g Co(NO3)2·6H2O 和2.6 g 2-甲基咪唑,分别溶于200 mL 甲醇中,超声振荡使其充分溶解;在搅拌条件下,将2-甲基咪唑溶液缓慢加入到Co(NO3)2溶液中,溶液由无色变为紫色后,继续搅拌1 min, 使其充分混合,置于避光处静置24 h;5000 r/min 离心5 min,用甲醇和水洗涤沉淀3 次,去除溶液中反应不完全的配体和金属离子;将紫色沉淀物在60 ℃下干燥6 h, 所得粉末即为ZIF-67。
1.3 C-CDs、N-CDs和B-CDs的合成
1.3.1 C-CDs的合成
称取0.3 g 葡萄糖,将其溶于50 mL 水中,转移至100 mL 聚四氟乙烯内衬的高压反应釜中,在180 ℃下反应24 h;冷却, 10000 r/min 离心10 min, 用0.22 μm 滤膜过滤,滤液在截留分子量为1 kD 的透析袋中透析48 h;透析纯化后的C-CDs 于4 ℃下保存,待用。
1.3.2 N-CDs的合成
称取2.0 g L-谷氨酸,溶于50 mL 水中,转移至100 mL 聚四氟乙烯内衬的高压反应釜中,在210 ℃下反应4 h。后续步骤同C-CDs。
1.3.3 B-CDs的合成
称取0.2 g 苯硼酸,溶于40 mL 0.1 mol/L NaOH 中,通入氮气鼓泡1 h 以去除O2,再移至100 mL 聚四氟乙烯内衬的高压反应釜中,在160 ℃反应8 h。后续步骤同C-CDs。
1.4 CDs@ZIF-67的制备
称取20 mg 制备的ZIF-67 溶于4 mL 乙醇中,超声使其分散均匀。移取适量C-CDs、B-CDs 和N-CDs溶液,分别与ZIF-67 分散液充分混合,超声处理20 min 后,在搅拌下继续反应10 h。得到的混合溶液用乙醇和水分别离心洗涤3 次,以去除未结合的CDs,最后于60 ℃烘干,即得到3 种不同的CDs@ZIF-67。CDs@ZIF-67 的制备过程如电子版文后支持信息图S1 所示。
1.5 修饰电极的制备
依次用0.3 和0.05 μm 的Al2O3 抛光粉对GCE 表面进行抛光处理,并进行超声清洗,得到表面洁净的GCE。分别称取4 mg 不同元素掺杂的CDs@ZIF-67 或ZIF-67,加入到1 mL 0.05% Nafion 乙醇溶液中,超声使其充分分散。分别移取5 μL 上述混合溶液滴加到GCE 表面,于室温下晾干,得到3 种不同的CDs@ZIF-67/GCE 以及ZIF-67/GCE。
1.6 葡萄糖的检测
在固定电位(0.5 V)下,以饱和甘汞电极为参比电极、铂丝电极为对电极、CDs@ZIF-67/GCE 为工作电极(d=3 mm)、0.1 mol/L NaOH 为支持电解质,采用恒电位法检测葡萄糖。向工作溶液中连续滴加已知浓度的葡萄糖标准品,随着葡萄糖的加入,电流发生阶跃,根据葡萄糖浓度与其响应电流的关系,拟合得到标准曲线方程。实际血清样品用0.1 mol/L NaOH 稀释1000 倍后采用本方法进行检测。
2 结果与讨论
2.1 CDs、ZIF-67和CDs@ZIF-67的表征
2.1.1 CDs的TEM表征
采用TEM 对3 种CDs 的形貌进行了表征,如图2 所示, 3 种CDs 均为直径2~6 nm 的球形颗粒,粒径较均一,并且具有良好的单分散性。
2.1.2 CDs的紫外-可见吸收光谱和荧光光谱
3 种CDs 在水溶液中的紫外-可见吸收光谱和荧光光谱如电子版文后支持信息图S2 所示。C-CDs 的紫外吸收峰位于283 nm, 最佳荧光激发和发射波长分别为362 和446 nm。B-CDs 的紫外吸收峰位于288 nm 处,最佳荧光激发和发射波长分别为305 和454 nm。N-CDs 在266 和323 nm 处有2 个明显的吸收峰,分别归属于sp2 芳族共轭的π-π*跃迁和n-π*跃迁的吸收带[31],其最佳荧光激发和发射波长分别为389 和462 nm。
2.1.3 N-CDs和B-CDs的XPS表征
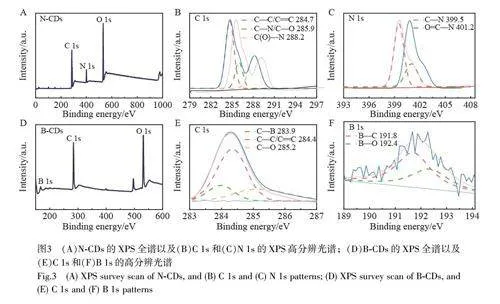
采用XPS 对所制备的N-CDs 和B-CDs 的官能团和元素进行了表征。由图3A 中N-CDs 的XPS 全谱可知, N-CDs 主要含有C、N 和O 这3 种元素。由于石墨结构和含氧官能团的存在, C 和O 是N-CDs 的主要元素, C 和O 的相对含量分别为47.8%和38.3%, N 的相对含量约为13.9%。图3B 中C 1s 谱在284.7、285.9 和288.2 eV 处的3 个峰分别归属于C—C/C=C、C—N/C—O 和N—C=O 键。图3C 中的N 1s 谱可拟合为399.5 和402.18 eV 处的2 个峰,分别对应O=C—N 和C—N 键[32]。
图3D~3F 为B-CDs 的XPS 图谱。在图3D 的XPS 全谱中可见较强的C 1s 和O 1s 峰,而B 1s 的峰较弱,其中, C 和O 的相对含量分别为60.1%和30.1%, B 的相对含量约为6.6%。图3E 的C 1s 谱中位于283.9、284.4 和285.2 eV 处的3 个峰分别对应C—B、C—C/C=C 和C—O 键。图3F 的B 1s 谱中191.8和192.4 eV 处的2 个峰分别归属于B—C 和B—O 键[27]。
2.1.4 ZIF-67和CDs@ZIF-67的SEM表征
通过SEM 对ZIF-67 和CDs@ZIF-67 的形貌进行了表征(图4)。如图4A~4C 所示,得到的ZIF-67 为菱形十二面体纳米颗粒,粒径约为400 nm(图4C),此形貌与文献[30]一致,表明成功合成了ZIF-67。由图4F、4I 和4L 可知,与CDs 复合后,相比于ZIF-67 外部形貌, CDs@ZIF-67 表面出现一定程度的破坏和缺陷,粗糙度明显增加,但MOF 的十二面体基本结构并未发生明显改变。CDs 与ZIF-67 复合后,复合材料未出现明显聚集,表明采用浸渍法将CDs 与ZIF-67 复合是一种较温和的制备方法,对ZIF-67 的框架破坏程度很小。
2.2 CDs@ZIF-67/GCE检测葡萄糖的可行性分析
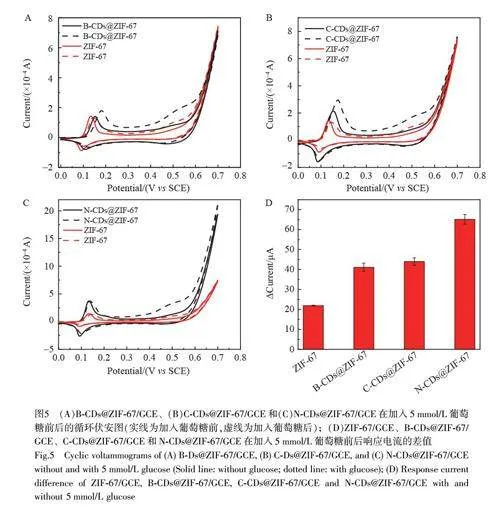
图5A~5C 为4 种修饰电极ZIF- 67/GCE、B- CDs@ZIF- 67/GCE、C- CDs@ZIF- 67/GCE 和N-CDs@ZIF-67/GCE 在0.1 mol/L NaOH 中加入5 mmol//L 葡萄糖前后的循环伏安(CV)图。加入葡萄糖后,裸电极几乎没有电极响应,而各修饰电极在0.5 V 处均出现了一个较大的氧化峰,表明4 种材料对葡萄糖都具有催化作用。同时, CDs@ZIF-67/GCE 在0.5 V 处氧化峰的峰电流明显高于ZIF-67/GCE,表明CDs@ZIF-67 复合材料对葡萄糖的催化性能更优。图5D 为4 种不同材料修饰的电极在相同条件下加入葡萄糖前后得到的响应电流差值。电流差值越大,表明电极对葡萄糖的催化性能越好。由图5D 可知,CDs@ZIF-67 复合材料对葡萄糖的催化性能均优于单独ZIF-67 材料,其中N-CDs@ZIF-67 对葡萄糖的催化性能最佳,可能是因为N 掺杂的CDs 能够诱导CDs 表面产生更多的缺陷[33],并且还能调节能带间隙,使电子跃迁的阻力减小,从而提高电子转移能力[25]。作为MOF 的金属节点,包括过渡金属Cu 和Co 等,由于其独特的d 轨道电子排布,在发生化学变化时有多种失电子情况,可表现出多种价态,为电化学催化提供了可能[34]。由此推测CDs@ZIF-67 对葡萄糖的催化机理为:ZIF-67 中的Co(Ⅱ)在电极上被氧化为Co(Ⅲ), Co(Ⅲ)氧化葡萄糖后又转化为Co(Ⅱ)[35-37],具体反应式如下:
2.3 CDs@ZIF-67的修饰量及材料比例的优化
采用不同浓度C-CDs@ZIF-67、B-CDs@ZIF-67 和N-CDs@ZIF-67 复合材料制备的修饰电极的电化学响应见电子版文后支持信息图S3A~S3C。3 种材料修饰的结果相似,在2~4 mg/mL 范围内,修饰电极的响应电流随着CDs@ZIF-67 浓度增加而逐渐增大;在4~10 mg/mL 范围内,修饰电极的响应电流随着CDs@ZIF-67 浓度增加反而逐渐减弱。这可能是因为浓度过高导致复合材料在电极表面堆积,掩盖了活性位点,使得其性能下降。因此,选择4 mg/mL CDs@ZIF-67 修饰电极。CDs@ZIF-67 复合材料中的CDs与ZIF-67 的比例对电极响应电流的影响见电子版文后支持信息图S3D~S3F。随着CDs 比例增加,复合材料修饰电极对葡萄糖的响应电流逐渐增大。此结果与图5 中CDs@ZIF-67 的催化性能优于ZIF-67 的结果相符,表明与CDs 复合能够有效提升ZIF-67 对葡萄糖的催化氧化能力。但是,当CDs 的浓度增大到一定程度时,复合材料的导电性下降,导致其催化性能减弱。最终,选择CDs 与ZIF-67 比例分别为2∶20、4∶20 和3∶20 制备C-CDs@ZIF-67、B-CDs@ZIF-67 和N-CDs@ZIF-67。
2.4 CDs@ZIF-67催化电位的优化
由于i-t 法比CV 法灵敏,采用i-t 法考察修饰电极对葡萄糖的响应电流的影响。根据图5 中葡萄糖的氧化峰电位,并结合文献[10,11,22-24]中电位的选择范围,考察了0.40、0.45、0.50、055 和0.60 V 电位下电极的响应电流。ZIF-67、B-CDs@ZIF-67、C-CDs@ZIF-67 和N-CDs@ZIF-67 修饰电极在不同电位下,加入相同浓度葡萄糖得到的i-t 曲线图见电子版文后支持信息图S4。随着葡萄糖浓度增加,各工作电位下的响应电流均显著增大。在0.5 V 时,这4 种修饰电极的响应电流最大,并且响应电流从小到大依次是ZIF-67
2.5 葡萄糖的电化学检测
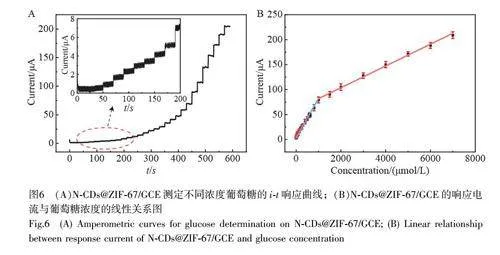
图6A 为N-CDs@ZIF-67/GCE 修饰电极对不同浓度葡萄糖的i-t 响应曲线。在0.1 mol/L NaOH 溶液中, 0.5 V 工作电位下,分别加入一系列浓度的葡萄糖后,电极响应电流发生连续阶跃。图6B 为葡萄糖浓度与响应电流的线性关系曲线。N-CDs@ZIF-67/GCE 的响应电流与葡萄糖浓度在0.1~1000 μmol/L 和1000~7000 μmol/L 两段范围内分别呈线性关系,线性方程分别为ΔI(μA) = 0.0792C+3.4052 (R2 = 0.9911)和ΔI(μA)= 0.0218C+60.1677(R2=0.9957),检出限(S/N=3)为31.8 nmol/L。与已报道的修饰电极相比,本研究所构建的无酶葡萄糖传感器具有线性范围宽和检出限低的优点。
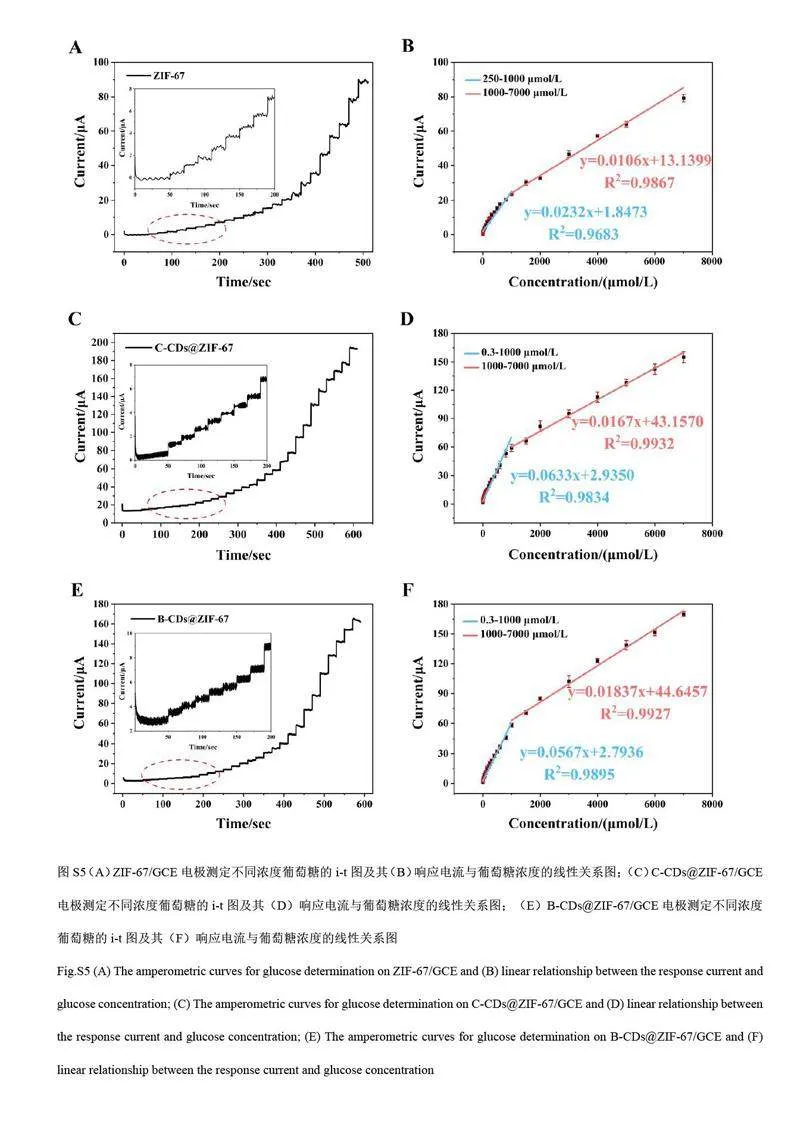
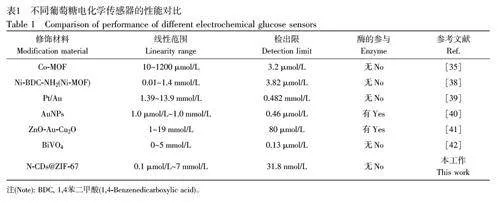
与单纯的ZIF-67 及C-CDs@ZIF-67、B-CDs@ZIF-67 相比, N-CDs@ZIF-67 复合材料修饰电极的检测范围更宽,检出限更低(ZIF-67/GCE 检出限为61.5 μmol/L, C-CDs@ZIF-67/GCE 检出限为85.6 nmol/L,B-CDs@ZIF-67/GCE 检出限为111.6 nmol/L, 见电子版文后支持信息图S5)。将本研究中基于N-CDs@ZIF-67/GCE 的传感器与文献报道的葡萄糖电化学传感器进行对比(表1), N-CDs@ZIF-67/GCE的线性范围和检出限与之相当或更优,并且方法简单,具有较好的应用价值。
2.6 N-CDs@ZIF-67/GCE的选择性
考察了AA、DA、UREA 和UA 等体液中常见的干扰物对N-CDs@ZIF-67/GCE 检测葡萄糖的影响,通常情况下,正常的生理血糖浓度是这些干扰物浓度的30 倍以上[43]。在0.5 V 电位下,加入0.2 mmol/L葡萄糖后,再依次连续加入1/10 浓度即0.02 mmol/L AA、DA、UREA、UA 和0.2 mmol/L 葡萄糖,N-CDs@ZIF-67/GCE 的电流响应如图7A 所示。加入葡萄糖后,电流产生明显阶跃;加入AA、UREA、DA 和UA 后,基本无电流响应;再次加入葡萄糖后,电流又产生明显阶跃。这表明N-CDs@ZIF-67/GCE用于检测葡萄糖时对血液中常见的小分子具有良好的抗干扰能力。
2.7 N-CDs@ZIF-67/GCE的稳定性和重现性
考察了N-CDs@ZIF-67/GCE 电极的制备重现性和稳定性。平行制备10 根N-CDs@ZIF-67/GCE,对1 mmol/L 葡萄糖进行测试。结果如图7B 所示, 10 根电极平行测量的响应电流的RSD=4.2%,表明N-CDs@ZIF-67/GCE 具有良好的制备重现性。N-CDs@ZIF-67/GCE 放置14 d 后,对1 mmol/L 葡萄糖的催化电流如图7C 所示,响应电流仍保持在初始电流的92%以上,表明N-CDs@ZIF-67/GCE 具有良好的储存稳定性。
2.8 实际样品的测定
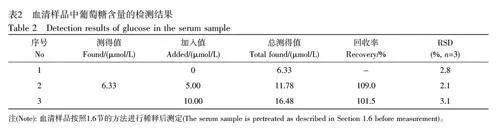
将N-CDs@ZIF-67/GCE 用于人血清样品中葡萄糖浓度的测定,考察其用于实际样品检测的可行性。人血清样本均采集于桂林理工大学附属医院,患者知情同意,并经桂林理工大学审查委员会和伦理委员会批准。按照1.6 节的方法进行血清样品的稀释,并进行加标回收实验,加标回收率在101.5%~109.0%之间, RSDlt;3.1%(表2)。上述结果表明,所制备的N-CDs@ZIF-67/GCE 用于血清中葡萄糖的检测准确度良好。
3 结论
采用浸渍法制备CDs@ZIF-67 复合材料,基于此构建了高灵敏的无酶葡萄糖电化学传感平台。结果表明,加入CDs 可加快复合材料中电子的转移速率,有效提高了ZIF-67 的电催化性能。考察了3 种不同掺杂的CDs@ZIF-67 复合材料C-CDs、B-CDs 和N-CDs 对葡萄糖的电催化性能,发现N-CDs@ZIF-67 的电催化性能最好,并初步推测了其对葡萄糖的催化机理。基于3 种复合材料构建的传感平台用于葡萄糖的检测,对体液中常见的多种小分子具有良好的抗干扰能力,检出限低至nmol/L 级别,可用于实际血清样品中葡萄糖的检测,具有较好的实际应用前景。
References
[1] SUN Y M, LI Y X, WANG N, XU Q Q, XU L, LIN M. Electroanalysis, 2018, 30(3): 474-478.
[2] DU Y T, ZHANG X Y, LIU P, YU D G, GE R L. Front. Chem. , 2022, 10: 944428.
[3] REYNOSO-SOTO E A, FéLIX-NAVARRO R M, RIVERA-LUGO Y Y, LOZANO-GARCIA A, DOMINGUEZ-VARGAS DA, SILVA-CARRILLO C. Top. Catal. , 2022, 65(13-16): 1235-1243.
[4] NASEHI M, SAEEDI M, GHANAVI J, MORAVVEJ-FARSHI M K. IEEE Sens. J. , 2022, 22(7): 7169-7176.
[5] PINHEIRO T, FERRAO J, MARQUES A C, OLIVEIRA M J, BATRA N M, COSTA P M F J, MACEDO M P, AGUAS H,MARTINS R, FORTUNATO E. Nanomaterials (Basel), 2020, 10(10): 2027.
[6] WU M X, ZHANG Y J, LIU Q, HUANG H, WANG X, SHI Z K, LI Y P, LIU S, XUE L J, LEI Y F. Biosens. Bioelectron. ,2019, 142: 111547.
[7] ZHANG J L, DAI X, SONG Z L, HAN R, MA L Z, FAN G C, LUO X L. Sens. Actuators, B, 2020, 304: 127304.
[8] OKUDA S J, YOSHIDA H, SODE K. Bioelectrochemistry, 2020, 132: 107414.
[9] YU X J, ZHANG J, TANG X Y, WEI Y C, KOU S, NIU J F, YAO B H. Nanomater. Nanotechnol. , 2018, 8:1847980418793526.
[10] SHI L B, ZHU X, LIU T T, ZHAO H L, LAN M B. Sens. Actuators, B, 2016, 227: 583-590.
[11] WU L, LU Z W, MA Y, ZHANG J J, MO G Q, DU H J, YE J S. Chin. J. Anal. Chem. , 2020, 48(3): e20038-e20046.
[12] FURUKAWA H, CORDOVA K E, O’KEEFFE M, YAGHI O M. Science, 2013, 341(6149): 1230444.
[13] LI H, WANG K C, SUN Y J, LOLLAR C T, LI J L, ZHOU H C. Mater. Today, 2018, 21(2): 108-121.
[14] ZHANG F, JIANG D G, ZHANG X G. Nano-Struct. Nano-Objects, 2016, 5(2): 1-6.
[15] LIN R B, XIANG S C, XING H B, ZHOU W, CHEN B L. Coord. Chem. Rev. , 2019, 378(SI): 87-103.
[16] ZHANG Y F, NSABIMANA A, ZHU L D, BO X J, HAN C, LI M, GUO L P. Talanta, 2014, 129: 55-62.
[17] CAI M R, CHEN G S, QIN L Y, QU C H, DONG X X, NI J, YIN X B. Pharmaceutics, 2020, 12(3): 232.
[18] LAWSON H D, WALTON S P, CHAN C. ACS Appl. Mater. Interfaces, 2021, 13(6): 7004-7020.
[19] XIAO Z R, MENG H, QIN X F, SANG X Q, ZHANG Y, YUAN Y L. Analyst, 2021, 146(2): 597-604.
[20] KOO W T, JANG J S, KIM I D. Chem, 2019, 5(8): 1938-1963.
[21] YANG N, GUO K L, ZHANG Y W, XU C L. J. Mater. Chem. B, 2020, 8(14): 2856-2861.
[22] CHEN Y T, TIAN Y L, ZHU P, DU L P, CHEN W, WU C S. Front. Chem. , 2020, 8: 602752.
[23] LU M X, DENG Y J, LI Y C, LI T B, XU J, CHEN S W, WANG J Y. Anal. Chim. Acta, 2020, 1110: 35-43.
[24] XU T, ZHANG Y X, LIU M S, WANG H T, REN J, TIAN Y J, LIU X, ZHOU Y F, WANG J L, ZHU W X, MA M J.J. Alloys Compd. , 2022, 923: 166418.
[25] LIM S Y, SHEN W, GAO Z Q. Chem. Soc. Rev. , 2015, 44(1): 362-381.
[26] QIN X F, LU Y P, BIAN M M, XIAO Z R, ZHANG Y, YUAN Y L. Anal. Chim. Acta, 2019, 1091: 119-126.
[27] FAN Zi-Yan, LIU Zheng-Jie, ZHANG Rui-Long, HAN Guang-Mei, ZHANG Zhong-Ping. Chin. J. Anal. Chem. , 2021, 49(7):1208-1217.
范子彦, 刘正杰, 张瑞龙, 韩光梅, 张忠平. 分析化学, 2021, 49(7): 1208-1217.
[28] JIANG G H, LIU H M, LIU J, LIU L E, LI Y L, XUE L S, WU Y J, YANG R Y. Sens. Actuators, B, 2022, 360: 131653.
[29] ZHU Y, ZHANG Z Y, LI W Q, LEI Z, CHENG N C, TAN Y Y, MU S C, SUN X L. ACS Sustainable Chem. Eng. , 2019,7(21): 17855-17862.
[30] JIANG Z, LI Z P, QIN Z H, SUN H Y, JIAO X L, CHEN D R. Nanoscale, 2013, 5(23): 11770-11775.
[31] YU J, XU C X, TIAN Z S, LIN Y, SHI Z L. New J. Chem. , 2016, 40(3): 2083-2088.
[32] LIU Q, GUO B D, RAO Z Y, ZHANG B H, GONG J R. Nano Lett. , 2013, 13(6): 2436-2441.
[33] NAIK V M, BHOSALE S V, KOLEKAR G B. Anal. Methods, 2022, 14(9): 877-891.
[34] KANG S J, YU J. Phys. Chem. Chem. Phys. , 2022, 24(36): 22168-22180.
[35] MA Z Z, MA Y, LIU B, XU L, JIAO H. New J. Chem. , 2021, 45(45): 21350-21358.
[36] ZHANG L J, WANG N, CAO P F, LIN M, XU L, MA H Y. Microchem. J. , 2020, 159: 105343.
[37] WEI X F, GUO J L, LIAN H T, SUN X Y, LIU B. Sens. Actuators, B, 2021, 329: 129205.
[38] DAUD A D, LIM H N, IBRAHIM I, ENDOT N A, GOWTHAMAN N S K, JIANG Z T, CORDOVA K E. J. Electroanal.Chem. , 2022, 921: 116676.
[39] LIN F Y, LEE P Y, CHU T F, PENG C I, WANG G J. Int. J. Nanomed. , 2021, 16: 5551-5563.
[40] GAO L, WANG P P, CHEN L, WU Y, DI J W. RSC Adv. , 2019, 9(27): 15307-15313.
[41] CHEN D L, WANG X H, ZHANG K X, CAO Y, TU J C, XIAO D, WU Q. Biosens. Bioelectron. , 2020, 166: 112466.
[42] WANG S, LI S P, WANG W W, ZHAO M T, LIU J F, FENG H F, CHEN Y M, GU Q, DU Y, HAO W C. Sens. Actuators, B,2019, 291: 34-41.
[43] WEI C H N, ZOU X, LIU Q M, LI S X, KANG C X, XIANG W. Electrochim. Acta, 2020, 334: 135630.

