超高效液相色谱-四级杆飞行时间质谱测定三七中九种真菌毒素
程龙 李云飞 吴思超 赵风情 张国帅 何友艳 陶蕾 王英

摘要:建立一种三七中9种真菌毒素的超高效液相色谱-四极杆飞行时间质谱筛查与确证方法,快速筛查三七中9种真菌毒素(黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2、伏马菌素B1、伏马菌素B2、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、赭曲霉毒素A)的残留量。色谱柱为Phenomenex Kinetex C18(100 mm×2.1 mm,2.6 μm),以0.1%甲酸水溶液和0.1%甲酸甲醇水溶液为流动相进行梯度洗脱,正离子扫描,基质匹配外标法定量。结果表明,9种真菌毒素分别在0.1~100.0、5.0~1 000.0、0.5~500.0 μg/L 浓度范围内具有良好的线性关系,相关系数均大于0.990 00,方法定量限为0.3~15.0 μg/kg,在高、中、低3个浓度加标水平下,回收率为71.22%~98.57%,相对标准偏差为2.31%~ 6.72%。该方法在没有对照品的情况下,可与质谱数据库中一级、二级质谱的精确质量数和碎片离子信息等进行匹配,降低了试验成本,具有简便、快速、高效、准确等优点,适用于三七中真菌毒素残留的快速筛查和测定。
关键词:超高效液相色谱-四级杆飞行时间质谱;三七;真菌毒素
中图分类号:R917 文献标识码:A
文章编号:0439-8114(2024)06-0187-06
DOI:10.14088/j.cnki.issn0439-8114.2024.06.030 开放科学(资源服务)标识码(OSID):
Determination of nine mycotoxins in Panax notoginseng by ultra high performance liquid chromatography quadrupole time-of-flight mass spectrometry
CHENG Long1,LI Yun-fei2,WU Si-chao3,ZHAO Feng-qing2,ZHANG Guo-shuai2,
HE You-yan2,TAO Lei2,WANG Ying2
(1. College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China;2. Technology Center of Kunming Customs, Kunming 650208, China;3.Technology Center of Huangpu Customs, Dongguan 523071, Guangdong, China)
Abstract: An ultra high performance liquid chromatography quadrupole time-of-flight mass spectrometry screening and confirmation method was established for 9 types of mycotoxins in Panax notoginseng. The residual levels of 9 types of mycotoxins (Aflatoxin B1、Aflatoxin B2、Aflatoxin G1、Aflatoxin G2、Fumonitoxin B1、Fumonitoxin B2、Deoxynivalenol、Zearalenone、Ochratoxin A) in Panax notoginseng were quickly screened. The chromatographic column was Phenomenex Kinetex C18 (100 mm × 2.1 mm, 2.6 μm), and gradient elution was performed using 0.1% formic acid aqueous solution and 0.1% formic acid methanol solution as mobile phases. Positive ion scanning and the matrix matching external standard method were used for quantification. The results showed that 9 types of mycotoxins had good linear relationships within the concentration ranges of 0.1~100.0, 5.0~1 000.0, and 0.5~500.0 μg/L, respectively,the correlation coefficients were all greater than 0.990 00, and the quantitative limit of the method was 0.3~15.0 μg/kg. At three spiked levels of high, medium, and low concentrations, the recovery rate was 71.22%~98.57%, and the relative standard deviation was 2.31%~6.72%. This method could match the precise mass numbers and fragment ion information of primary and secondary mass spectra in the mass spectrometry database without reference materials, reducing experimental costs. It had the advantages of simplicity, rapidness, efficiency, and accuracy, and was suitable for the rapid screening and determination of mycotoxins residues in Panax notoginseng.
Key words: ultra high performance liquid chromatography quadrupole time-of-flight mass spectrometry; Panax notoginseng; mycotoxins
三七为五加科植物三七[Panax notoginseng (Burk.) F.H.Chen]的干燥根,是中国传统的名贵中药材,同时也是保健食品,具有活血化瘀、抗炎、抗肿瘤、降血脂、增强免疫力等功效[1-4]。中药在种植、采集、炮制加工、运输储存的过程中,在一定的温湿度条件下容易发生霉变,进而产生真菌毒素[5,6]。摄入被真菌毒素污染的中药材可能会导致急、慢性中毒,甚至有致癌、致畸形、致突变的危害[7,8]。中药中研究较多的真菌毒素为黄曲霉毒素、赭曲霉毒素、脱氧雪腐镰刀菌烯醇、伏马菌素、玉米赤霉烯酮等。
近年来,真菌毒素检测方法主要包括高效液相色谱法[9]、高效液相色谱-串联质谱法[10,11]、气相色谱-串联质谱法[12]、薄层色谱法[13],另外酶联免疫法[14]、胶体金免疫层析法[15]、荧光免疫分析法[16]等也已经应用到中药真菌毒素的分析检测中。然而现存的真菌毒素分析方法由于繁琐的步骤和较低的灵敏度降低了检测的高效性和可靠性。高效液相色谱-串联质谱法虽然有较好的选择性、灵敏度和特异性,但是其分辨率较低,尤其是遇到样品基质复杂,存在基质干扰时,容易出现假阳性结果。随着质谱技术逐渐发展成熟,超高效液相色谱-四级杆飞行时间质谱可以在不降低灵敏度的前提下大幅提高分辨率,抗复杂基质干扰能力更强,对目标化合物具有更好的鉴别和确证能力[17-21]。
本研究采用超高效液相色谱-四级杆飞行时间质谱建立了三七中9种真菌毒素残留量的快速筛查方法,同时建立了精确质量数谱库,可以实现在不使用标准品的情况下对已知化合物甚至非目标化合物进行筛查与确证。该方法为解决中药真菌毒素残留检测问题、保障中药质量提供技术支撑。
1 材料与方法
1.1 材料与试剂
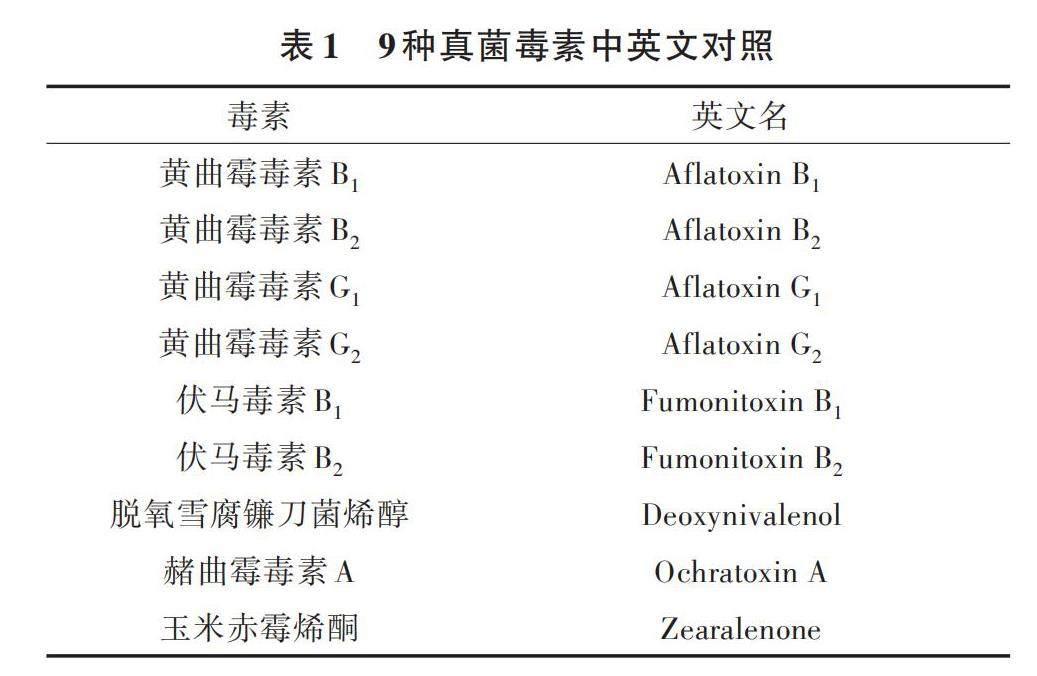
三七药材购自云南鸿翔一心堂药业(集团)股份有限公司,云南中医药大学药学院生药教研室鉴定为五加科植物三七(Panax notoginseng (Burk.) F.H.Chen);黄曲霉毒素混合对照品溶液(黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2),伏马毒素混合对照品溶液(伏马毒素B1、伏马毒素B2),脱氧雪腐镰刀菌烯醇对照品溶液,赭曲霉毒素A对照品溶液均购自PRIBO公司;玉米赤霉烯酮购自上海安谱实验科技股份有限公司(表1);甲醇(色谱纯)、乙腈(色谱纯)均购自美国Sigma公司;甲酸(分析纯)购自西陇科学股份有限公司;Oasis HLB固相萃取柱、十八烷基键合硅胶(C18)固相萃取柱、N-丙基乙二胺(PSA)固相萃取柱均购自美国Waters公司。
1.2 仪器与设备
SCIEX X500R型超高效液相色谱-飞行时间质谱联用仪[配有电喷雾离子源(ESI)及SCIEX OS数据处理系统],美国SCIEX公司;Phenomenex Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm),美国Phenomenex公司;XPE105型分析天平,瑞士Mettler公司;Milli-Q型纯水系统(电阻率为18.2 MΩ·cm),美国Millipore公司;HS501型振荡器,德国IKA公司;3-30K型高速冷冻离心机,德国Sigma公司;TurboVap LV型氮吹仪,瑞典Biotage公司。
1.3 试验方法
1.3.1 标准品的配制 精密量取上述适量真菌毒素标准品分别置于5 mL棕色容量瓶中,使用甲醇定容,配制质量浓度为10 μg/mL的标准储备液,置于4 ℃冰箱避光保存;精密量取适量真菌毒素的标准储备液于10 mL棕色容量瓶中,用甲醇定容至刻度,配成各目标化合物相应浓度为1 μg/mL混合标准工作液。
1.3.2 样品前处理 参照2020年版《中华人民共和国药典:四部》(以下简称《中国药典》)2351真菌毒素测定法[22],精密称取三七样品粉末3 g(精确至0.01 g),过三号筛,置于50 mL离心管中,加入70%甲醇水溶液20 mL,振荡10 min,9 000 r/min离心 5 min,精密量取上清液5 mL,缓慢通过处理好的Oasis HLB固相萃取柱,收集洗脱液;随后用3 mL甲醇洗脱,收集洗脱液,合并2次洗脱液,用40 ℃氮气缓慢吹至近干,加入95%甲醇溶液定容至1 mL,通过0.22 μm有机相微孔滤膜,待仪器检测。
1.3.3 色谱条件 色谱柱为Phenomenex Kinetex C18(100 mm×2.1 mm,2.6 μm),柱温为40 ℃,流速为0.4 mL/min,进样量为10 μL,A为水相流动相,由0.1%甲酸水溶液组成,B为有机相流动相,由0.1%甲酸甲醇水溶液组成。梯度洗脱程序如表2所示。
1.3.4 质谱条件 电喷雾离子源(ESI);正离子TOF MS-IDA-10MS/MS扫描模式;毛细管电压: 5 500 V;气帘气压力:207 kPa;雾化气压力:345 kPa;辅助加热气压力:379 kPa;离子源温度:550 ℃;碰撞气:氮气(Medium);一级质谱扫描范围:100~1 000 m/z;二级质谱扫描范围:50~800 m/z。
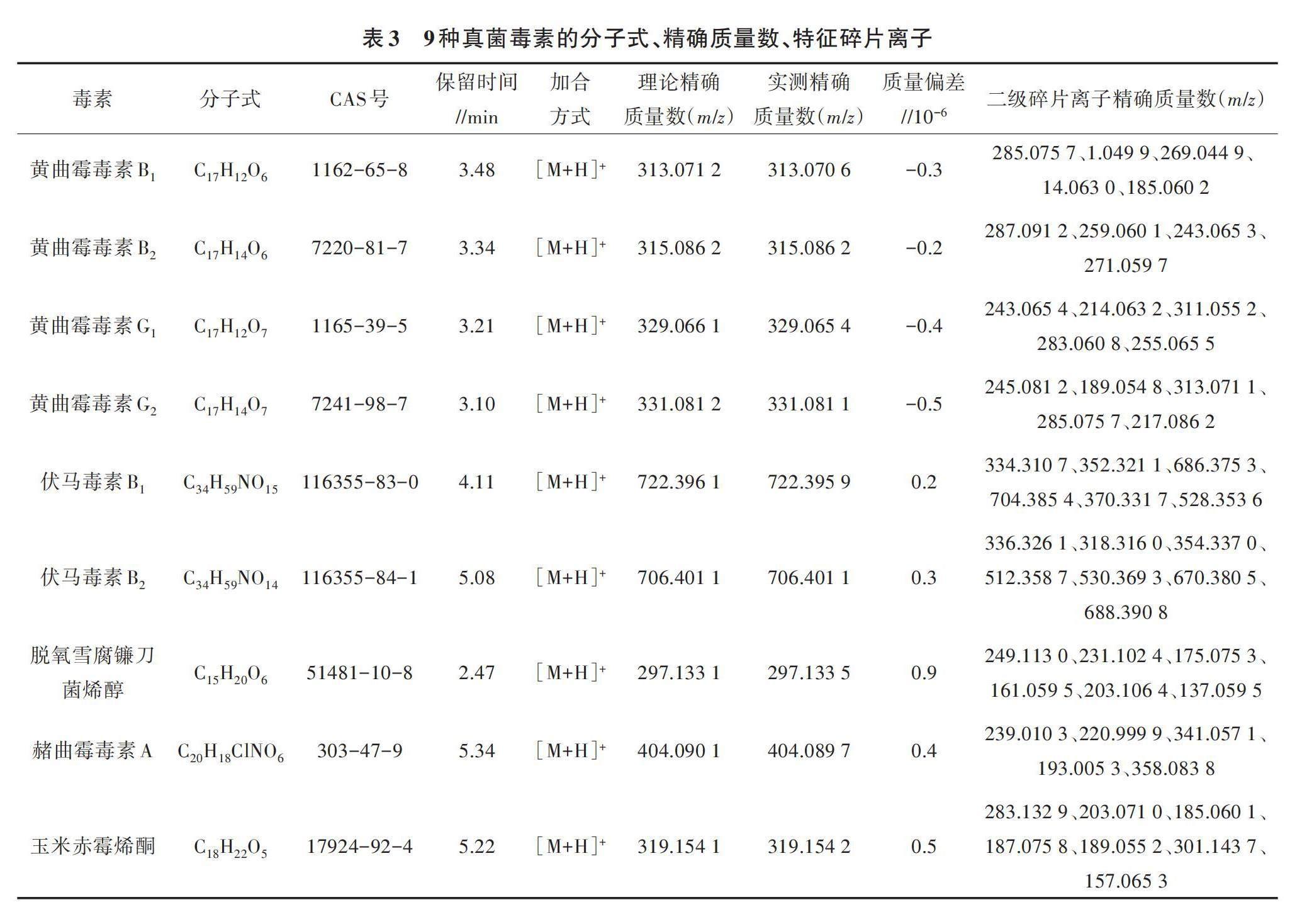
1.3.5 数据库的建立与定性方法 采用AB SCIEX公司的SCIEX OS软件建立9种真菌毒素的一级、二级质谱数据库。将质量浓度为1.0 μg/mL的9种真菌毒素标准品溶液按上述检测条件进行全扫描,获得一级高分辨率质谱信息和相对应的保留时间。将对应目标化合物的名称、CAS号、分子式、母离子精确分子质量、保留时间等基本信息输入软件,完成一级质谱数据库的建立[23];同时在不同碰撞能量下做Targeted MS/MS二级扫描,得到9种真菌毒素的碎片离子精确质量数(表3),将其导入数据库相应目标化合物目录下,完成二级谱库的建立。
在TOF MS-IDA-10MS/MS模式下对三七样品的真菌毒素进行筛查确证,依据保留时间、精确质量数偏差与标准溶液获得的质谱图进行匹配,若获得2个或2个以上特征碎片离子匹配,且二级质谱图质量偏差小于等于0.5×10-6[24],并且保留时间偏差在 ±2.5%之内,可以判定试样中含有该种真菌毒素。
2 结果与分析
2.1 色谱条件的优化
2.1.1 色谱柱的选择 分别对不同类型的色谱柱进行考察,包括Phenomenex Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm)、Thermo Accucore RP-MS C18色谱柱(100 mm×2.1 mm,2.6 μm)及Waters Atlantis T3 色谱柱(150 mm×2.1 mm,3 μm)色谱柱。结果表明Phenomenex Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm)对9种真菌毒素均有良好的分离效果,色谱峰峰形对称尖锐,有较好的响应,因此选择Phenomenex Kinetex C18色谱柱(100 mm×2.1 mm,2.6 μm)作为本试验分析用色谱柱。
2.1.2 流动相的优化 分别考察水-甲醇、水-乙腈、0.1%甲酸水溶液-0.1%甲酸甲醇水溶液、0.1%甲酸水溶液-0.1%甲酸乙腈水溶液作为流动相对待测物分离的效果。结果表明,0.1%甲酸水溶液-0.1%甲酸甲醇水溶液作为流动相时9种真菌毒素溶剂效应最小,分离效果最优,色谱峰峰形最佳;当流动相不加酸时,9种真菌毒素的响应强度偏小,甲酸的加入提高了待测物的离子响应强度;与乙睛相比,使用甲醇作为有机相时,9种真菌毒素在10 min内可以实现完全分离,最终选择0.1%甲酸水溶液
-0.1%甲酸甲醇水溶液作为流动相,如图1所示。
2.2 前处理方式的优化
由于大部分真菌毒素是极性化合物,提取时一般选用甲醇、乙腈、水等极性溶剂,本试验采用甲醇作为提取溶剂,因为甲醇的极性比乙腈强,对大部分真菌毒素提取效果好。为了增加对样品组织的渗透能力,在甲醇中加入一定比例的水作为提取溶剂,比较20%甲醇水溶液、50%甲醇水溶液和70%甲醇水溶液3种提取溶剂对三七中9种真菌毒素的提取效果。结果表明,70%甲醇水溶液对9种目标物的提取效率最好,回收率均超过70%,因此选择70%甲醇水溶液为提取溶剂。由于中药基质成分复杂,必须对其进行净化处理。以9种真菌毒素回收率为考察依据,分别采用十八烷基键合硅胶(C18)固相萃取柱、Oasis HLB固相萃取柱和N-丙基乙二胺(PSA)固相萃取柱对样品进行净化处理。试验结果显示,回收率最高的为Oasis HLB固相萃取柱,9种真菌毒素回收率均超过70%,因此采用Oasis HLB固相萃取柱对样品进行净化处理。
2.3 基质效应考察
取空白甲醇试剂和阴性三七样品经前处理后的基质溶液,分别配制浓度为10 μg/L的9种真菌毒素的混标溶液,测定9种真菌毒素的信号峰响应强度以评估基质效应,计算公式如下[25]。
[ME=A1-A2A1×100%] (1)
式中,ME为基质效应值;A1为基质中目标化合物的响应强度;A2为纯溶剂中目标化合物的响应强度。
当基质效应值小于-20%时表示基质抑制效应,基质效应值为-20%~20%时表示弱基质效应,当基质效应值大于20%时表示基质增强效应[26,27]。结果表明,三七中9种真菌毒素的基质效应值为-74%~46%,其中,伏马毒素B1、伏马毒素B2的基质效应值分别为31%、46%,表现为基质增强效应;玉米赤霉烯酮基质抑制效应最强,为-74%,其他目标化合物均表现出不同程度的基质抑制效应,因此本试验采用基质匹配外标法进行定量分析。
2.4 线性范围与定量限
采用三七阴性样品制备基质溶液,配制成一系列浓度的真菌毒素混合标准工作液,以母离子作为定量离子,以各目标化合物色谱峰面积(Y)为纵坐标,质量浓度(X)为横坐标绘制标准曲线,外标法定量,以10倍信噪比计算其定量限[28]。结果表明,9种真菌毒素分别在0.1~100.0、5.0~1 000.0、0.5~500.0 μg/L 浓度范围内具有良好的线性关系,相关系数(R2)均大于0.990 00,定量限为0.3~15.0 μg/kg,可满足痕量分析检测要求,试验结果见表4。
2.5 回收率试验
采用三七阴性样品进行加标回收试验,分别添加高、中、低3种不同水平的目标化合物,每个加标浓度重复测定6次,结果如表5所示,9种真菌毒素的回收率为71.22%~98.57%,相对标准偏差(RSD)为2.31%~6.72%。说明该方法准确度、精密度高,可满足检测要求。
2.6 实际样品的测定
应用数据库对50份三七样品进行分析,结果未发现被真菌毒素污染的样品,下一步将扩大筛查范围,针对更多的地区和不同品种的三七样品进行测定。
3 小结
本研究建立了三七中9种真菌毒素的超高效液相色谱-四极杆飞行时间质谱快速筛查与确证的方法,并考察了基质效应及方法学评价。本方法快捷简便、特异性好、灵敏度高、重复性好,可针对性地对真菌毒素进行快速筛查。在没有对照品的情况下,可与所建质谱数据库中一级、二级质谱的精确质量数和碎片离子信息等进行匹配,降低了试验成本。该方法解决了三七真菌毒素的“一站式”检测问题,可为中药真菌毒素残留的快速筛查提供技术参考。本试验所筛查真菌毒素为9种常见真菌毒素,下一步可以补充完善自建谱库以实现一次筛查更多种类的毒素,完成真菌毒素的无标准品快速筛查。
参考文献:
[1] CASTRO-ACEITUNO V, AHN S, SIMU S Y, et al. Anticancer activity of silver nanoparticles from Panax ginseng fresh leaves in human cancer cells[J]. Biomedicine & pharmacotherapy, 2016, 84:158-165.
[2] HUAN C, ZHOU Z, YAO J, et al. The antiviral effect of panax notoginseng polysaccharides by inhibiting PRV adsorption and replication in vitro[J]. Molecules, 2022, 27(4): 1254.
[3] LIU H, LU X, HU Y, et al. Chemical constituents of Panax ginseng and Panax notoginseng explain why they differ in therapeutic efficacy[J]. Pharmacological research, 2020, 161: 105263.
[4] 黄依丹, 成嘉欣, 石 颖, 等.近五年三七化学成分、色谱分析、三七提取物和药理活性的研究进展[J].中国中药杂志, 2022, 47(10): 2584-2596.
[5] 闵 曼, 潘浣钰, 李 丰. 中药中黄曲霉毒素检测技术的研究进展[J]. 广东化工, 2021, 48(5): 223-224.
[6] 周 恒, 王少敏, 季 申. 中药中真菌毒素污染的现状及防控对策[J].中国食品药品监管, 2022 (3): 110-118.
[7] EL-SAYED R A, JEBUR A B, KANG W, et al. An overview on the major mycotoxins in food products: Characteristics, toxicity, and analysis[J]. Journal of future foods, 2022, 2(2): 91-102.
[8] IQBAL S Z. Mycotoxins in food, recent development in food analysis and future challenges: A review[J]. Current opinion in food science, 2021, 42: 237-247.
[9] 陈予君, 任春明, 张小勇, 等.高效液相色谱法测定粮食中真菌毒素的效果评价[J]. 粮食与食品工业, 2022, 29(2): 62-67,72.
[10] 吴基任, 潘 望, 谭高好, 等.QuEChERS-超高效液相色谱-串联质谱法测定花生及土榨花生油中9种真菌毒素[J].食品安全质量检测学报, 2021, 12(10): 3927-3935.
[11] 李凤华, 李作华, 杨 丽, 等. 药食同源中药材中16种真菌毒素的测定与分析[J]. 食品工业科技, 2022, 43(9): 268-275.
[12] NA T W, SEO H J, JANG S N, et al. Multi-residue analytical method for detecting pesticides, veterinary drugs, and mycotoxins in feed using liquid- and gas chromatography coupled with mass spectrometry[J]. Journal of chromatography A, 2022, 1676: 463257.
[13] SOKOLOVI? M, ?IMPRAGA B. Survey of trichothecene mycotoxins in grains and animal feed in Croatia by thin layer chromatography[J]. Food control, 2006, 17(9): 733-740.
[14] OPLATOWSKA-STACHOWIAK M, REIRING C, SAJIC N, et al. Development and in-house validation of a rapid and simple to use ELISA for the detection and measurement of the mycotoxin sterigmatocystin[J]. Analytical and bioanalytical chemistry, 2018, 410(12): 3017-3023.
[15] ZHAO X, JIN X, LIN Z, et al. Simultaneous rapid detection of aflatoxin B1 and ochratoxin a in spices using lateral flow immuno-chromatographic assay[J]. Foods,2021, 10(11): 2738.
[16] LI R,WEN Y, WANG F, et al. Recent advances in immunoassays and biosensors for mycotoxins detection in feedstuffs and foods[J]. Journal of animal science and biotechnology, 2021, 12(1): 108.
[17] GAGO-FERRERO P, BLETSOU A A, DAMALAS D E, et al. Wide-scope target screening of >2 000 emerging contaminants in wastewater samples with UPLC-Q-TOF-HRMS/MS and smart evaluation of its performance through the validation of 195 selected representative analytes[J]. Journal of hazardous materials, 2020, 387: 121712.
[18] ROM?N-HIDALGO C,VILLAR-NAVARRO M,FALC?N-GARC?A G E, et al. Selective, rapid and simultaneous determination of ergosterol and ergocalciferol in mushrooms by UPLC-Q-TOF-MS[J]. Journal of pharmaceutical and biomedical analysis, 2021, 194: 113748.
[19] YANG M, LI J, ZHAO C, et al. LC-Q-TOF-MS/MS detection of food flavonoids: Principle, methodology, and applications[J]. Critical reviews in food science and nutrition, 2021.DOI:10.1080/10408398.2021.1993128.
[20] 林守二, 杨丽娟, 郑仁锦, 等. 超高效液相色谱-四极杆-飞行时间质谱快速筛查蔬菜中18种农药残留[J]. 分析科学学报, 2021, 37(3): 279-286.
[21] LIN S, ZHANG H, SIMAL-GANDARA J, et al. Investigation of new products of quercetin formed in boiling water via UPLC-Q-TOF-MS-MS analysis[J]. Food chemistry, 2022, 386: 132747.
[22] 国家药典委员会.中华人民共和国药典:四部[M].北京:中国医药科技出版社, 2020.384-385.
[23] 李 帆, 罗金文, 王 峰, 等. 超高效液相色谱-四极杆-飞行时间质谱法快速筛查畜禽类产品中50种违禁药物残留[J]. 现代食品科技, 2022, 38(6): 304-311,326.
[24] 李云飞, 张 薇, 高 燕, 等.超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法测定动源性食品中33种兽药残留及质谱库的建立[J]. 食品安全质量检测学报, 2021, 12(2): 629-635.
[25] ZHOU W, YANG S, WANG P G. Matrix effects and application of matrix effect factor[J]. 2017, 9(23): 1839-1844.
[26] 李建勋, 范 蓓, 周 杰, 等.QuEChERS-超高效液相色谱-飞行时间质谱法快速筛查蔬菜中154种农药残留[J]. 食品与发酵工业, 2019, 45(19): 239-250.
[27] 谢瑜杰, 陈 辉, 彭 涛, 等.QuEChERS-高效液相色谱-串联质谱测定牛奶中6种玉米赤霉烯酮类毒素[J]食品科学, 2019, 40(10): 304-310.
[28] 李 玮, 艾连峰, 马育松, 等.超高效液相色谱-飞行时间质谱测定牛奶中9种真菌毒素[J]. 分析科学学报, 2019, 35(5): 675-678.

