不同蔬菜种植对虾菜共生系统中微生物群落结构的影响
任思齐 应赵晗 吴昕睿 李明 贺文芳 田磊 徐勇斌 程霄玲 郑善坚
摘要 [目的]研究蕹菜、甘薯、枸杞对虾菜共生系统中微生物群落结构的影响。[方法]通过高通量测序技术分析种植不同蔬菜的虾菜共生系统中微生物群落组成,并检测该系统中的硝酸盐、磷酸盐指标。[结果]不同虾菜共生系统中水体微生物共同的OTU数目为450种,其中,枸杞组(LM)的OTU数目最多,为852种,且Shannon-Wiener指数和Simpson指数最高;蕹菜组(IF)对硝酸盐、磷酸盐去除率分别达65.70%和67.57%,且与其他组群落结构差异显著(P<0.05)。在门水平上,不同系统中水体的优势菌群为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、Patescibacteria;在属水平上,不同系统中的优势菌群为红球菌属(Rhodococcus)、不动杆菌属(Acinetobacter)、谷氨酸杆菌属(Glutamicibacter)。[结论]甘薯和枸杞更有利于维持水环境的稳定,蕹菜对硝酸盐、磷酸盐去除效果更好。
关键词 虾菜共生;蔬菜种植;微生物;群落结构;高通量测序
中图分类号 S182;S917.1 文献标识码 A 文章编号 0517-6611(2024)10-0103-06
doi:10.3969/j.issn.0517-6611.2024.10.022
Effects of Different Vegetable Cultivation on the Microbial Community Structure in Shrimp-vegetable Symbiotic System
REN Si-qi1,2,YING Zhao-han1,WU Xin-rui1 et al
(1. College of Bioscience, Zhejiang Normal University, Jinhua,Zhejiang 321004;2. Key Laboratory of Wildlife Biotechnology and Conservation and Utilization of Zhejiang Province, Jinhua,Zhejiang 321004)
Abstract [Objective] To study the effects of Ipomoea aquatica, Ipomoea batatas and Lycium chinense on the microbial community structure in shrimp-vegetable symbiotic system.[Method]The composition of microbial community in shrimp-vegetable symbiotic system growing different vegetables was analyzed by high-throughput sequencing technique, and the indexes of nitrate and phosphate in the system were detected. [Result]The number of OTU shared by microorganisms in different shrimp-vegetable symbiotic systems was 450 species,among them, the number of OTU in Lycium chinense group (LM) was the highest (852 species), and the Shannon-Wiener index and Simpson index were the highest. The removal rates of nitrate and phosphate in Ipomoea aquatica (IF) were 65.70% and 67.57%, respectively, and the community structure was significantly different from other groups (P<0.05). At the gate level, the dominant flora in different systems were Proteobacteria, Actinobacteria and Patescibacteria.At the genus level,while the dominant flora in different systems were Rhodococcus, Acinetobacter and Glutamicibacter. [Conclusion]Ipomoea batatas and Lycium chinense were more beneficial to maintain the stability of water environment, and Ipomoea aquatica was more effective in removing nitrate and phosphate.
Key words Shrimp-vegetable symbiosis;Vegetable cultivation;Microorganism;Community structure;High-throughput sequencing
基金項目 金华市重点研发项目(2021-2-017);浙江省重点研发项目(2020C02014)。
作者简介 任思齐(1998—),男,浙江杭州人,硕士研究生,研究方向:水生动物生态学。
*通信作者,教授,硕士,硕士生导师,从事水生生物学研究。
收稿日期 2023-08-01;修回日期 2023-08-24
虾菜共生系统是基于鱼菜共生系统的一种新发展,利用养殖系统中的对虾排泄物(包括颗粒废物固体和溶解的营养物质)作为营养介质,种植可食用蔬菜[1],系统中的微生物群落可降解对虾排泄物,有助于植物吸收,并降低水体中的氨氮、亚硝酸盐、硝酸盐和磷酸盐等含氮、高磷营养盐,从而改善养殖水质,使对虾养殖系统处于稳定状态。因此,虾菜共生系统在水资源循环利用、养殖废弃物高效处理等方面具有明显的优势[2-3]。总体来说,与传统农业相比,虾菜共生系统很好地利用虾-菜-菌之间的互作关系,减少了碳排放和水污染。近年来随着分子生物学的发展,尤其是高通量测序技术的研发及应用,使该技术能够较准确地定性和定量分析微生物的多样性和丰度,有利于精准了解虾菜共生模式下的微生物群落结构[4-9]。
凡纳滨对虾(Penaeus vanmamei)是一种生长快、适应性强的养殖品种,总体上认为5‰以上的盐度对虾的生长和成活率相对较好。在生产实践表明,蕹菜(Ipomoea aquatica Forssk.)、甘薯[Ipomoea batatas(L.)Lam.]和枸杞(Lycium chinense Mill.)3種植物都可在虾菜共生系统中具有较好的生长优势。研究表明,室内对虾循环水养殖对养殖水体水质具有良好的调节效果,可有效控制养殖水体 COD、NH+4-N和NO-2-N浓度,具有较强的可行性[3,10-12],且在鱼菜共生模式下,蕹菜对水体氮磷处理及微生物群落变化的研究颇多,该模式对保持根际微生物在提高蔬菜对环境胁迫的抗逆性上有重要作用,能有效促进植物的生长[13-15]。甘薯和枸杞也是常见的经济作物且这2种作物具有较高的药用价值[16]。但现有研究都缺乏不同植物对虾菜共生系统中水体微生物多样性的相关研究。因此,该研究在以凡纳滨对虾为养殖对象的虾菜共生系统中,探究栽培蕹菜、甘薯、枸杞3种植物对水体微生物多样性的影响,以期为虾菜共生系统微生物的作用机制提供研究基础。
1 材料与方法
1.1 试验设计
基于虾菜共生系统设计试验装置,装置包括养殖缸和种植槽两部分。养殖缸长30.0 cm、宽21.0 cm、高24.5 cm,养殖缸上方嵌套种植槽,种植槽长30 cm、宽21 cm、高12 cm。种植槽进水管口接10 cm长的200目发酵过滤袋,用于破碎颗粒有机物。种植槽填埋10 cm厚的陶粒和火山石,蔬菜种植在陶粒上。水泵抽取养殖水经发酵过滤袋过滤后,水溶性有机物经陶粒生物降解,产生的营养盐被蔬菜吸收后,经溢流口流回养殖区。
试验周期21 d,试验所选蔬菜蕹菜、甘薯、枸杞均为人工栽培的幼苗,根系生长健全。分别选取植株大小相似的菜苗进行试验,试验分别为蕹菜组(IF)、甘薯组(IL)和枸杞组(LM)。每个种植槽栽植12株,设置3个平行组。并同时设置空白组(CK)。试验缸放置5.5 L养殖水,养殖水取自虾菜共生养殖基地(水体盐度为5‰、pH 8.17、硝酸盐0.37 mg/L、磷酸盐5.35 mg/L、氨氮0.12 mg/L、亚硝酸盐0.06 mg/L)。由于对虾在生长过程中会吸收离子元素和排出代谢废物等,因此,为排除对虾这一因素对系统的干扰,该系统采用蔬菜养殖区和水循环区进行试验。
1.2 样品采集
用孔径0.22 μm的醋酸纤维素滤膜(Merk Millipore,USA)对试验前后的水样进行真空抽滤,滤膜装入灭菌后的离心管,液氮速冻,置于-80 ℃超低温冰箱保存。利用 Ezup柱式细菌基因组 DNA 提取试剂盒采取水样DNA(上海生工生物工程股份有限公司),对提取后的 DNA 经琼脂糖凝胶电泳检测其质量和完整性后,进行提取基因组DNA,用带有barcode的特异引物扩增16S rDNA的V3~V4区。
1.3 Illumina Miseq测序
引物序列为341F(CCTACGGGN-GGCWGCAG-3′)和806R(GGACTACHVGGGTATCTAAT-5′)。 将纯化后的扩增产物连接测序接头并构建测序文库,最后送至广州基迪奥生物科技有限公司进行Illumina上机测序。
1.4 数据分析
将测序获得的raw reads进行低质量reads过滤(FASTP软件),并进行Tags拼接(FLASH软件)、Tags过滤、OTU聚类(USEARCH软件的UPARSE算法)和Tags去嵌合体(USEARCH软件的UCHIME算法);使用Qiime软件进行Alpha多样性分析;以相关系数绝对值>0.5且P<0.05为阈值,筛选展示满足条件的结果,绘制物种丰度柱状图;使用R语言vegan包进行维恩图分析;使用R语言GUniFrac包,基于OTU序列进化树和OTU丰度表,计算weighted unifrac距离指数;使用 FAPROTAX(functional annotation of prokaryotic taxa)软件,结合 SILVA的物种注释并整合原核功能数据库,构建 “物种-生态功能分类”的关系网络。
2 结果与分析
2.1 样品测序质量及复杂度分析
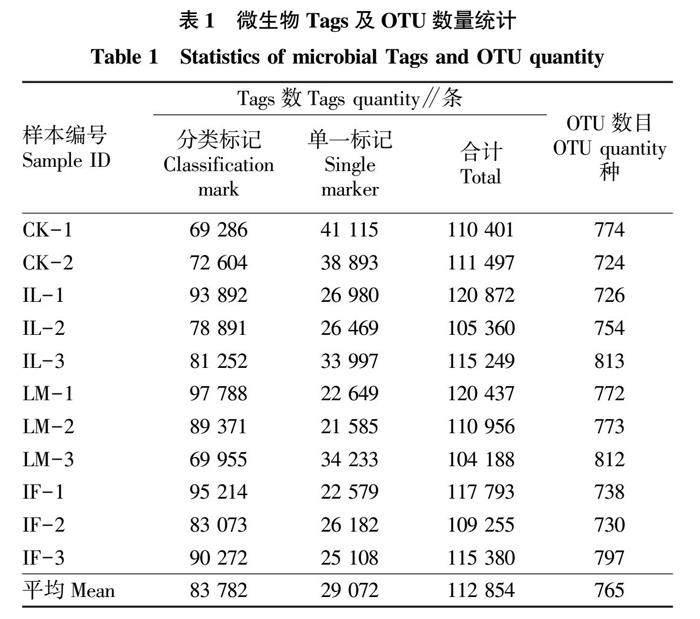
该试验共得到12个样品(对照组CK-3在收集样品时被污染,以11个样本进行展开分析)。从11个样品中得到的平均原始序列为112 854条,构建OTU分类信息单元且获得注释信息的平均Tags数为83 782条,有效率达到74.24%。测序样品检测到OTU平均数(相似度大于97%)为765种(表1)。
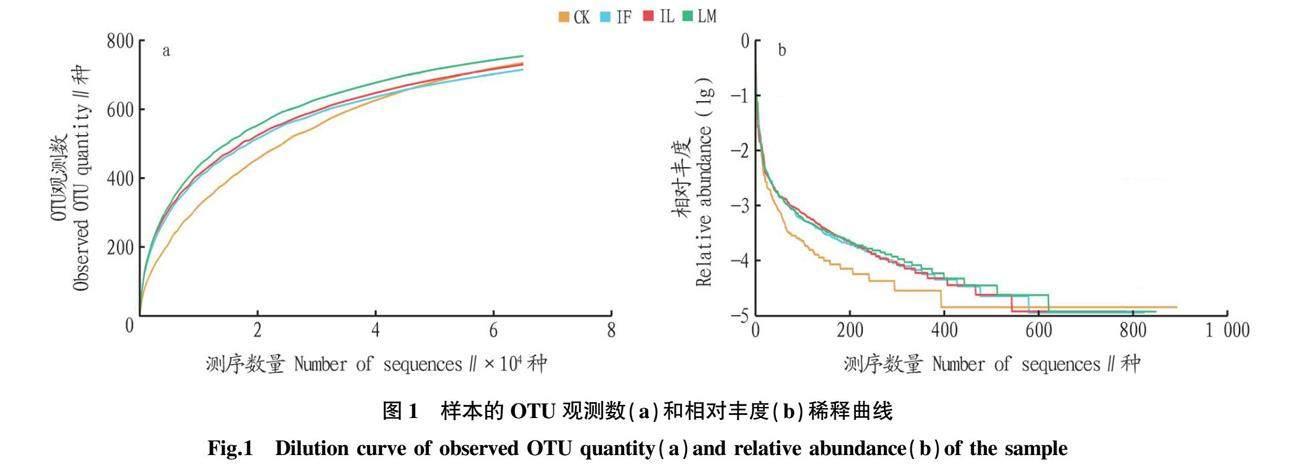
稀释曲线可直接反映测序数据量的完整性,并间接反映样品中物种的丰富程度。对样品进行多次随机抽样,构建稀释曲线如图1a所示,在随机抽取的测序数量大于40 000种时,曲线趋于平缓,表明测序数量渐进合理。当测序数量≥60 000种时,微生物群落OTU数目表现为LM>CK>IL>IF。样品相对丰度稀释曲线(图1b)直观地反映了样品中物种的丰富度和均匀度。LM组在水平方向上的跨度较大,表明枸杞组水体微生物的丰富度较高;而CK组在垂直方向上曲线的跨度较小,表明其水体微生物的均匀程度相对较低。
2.2 微生物群落组成分析
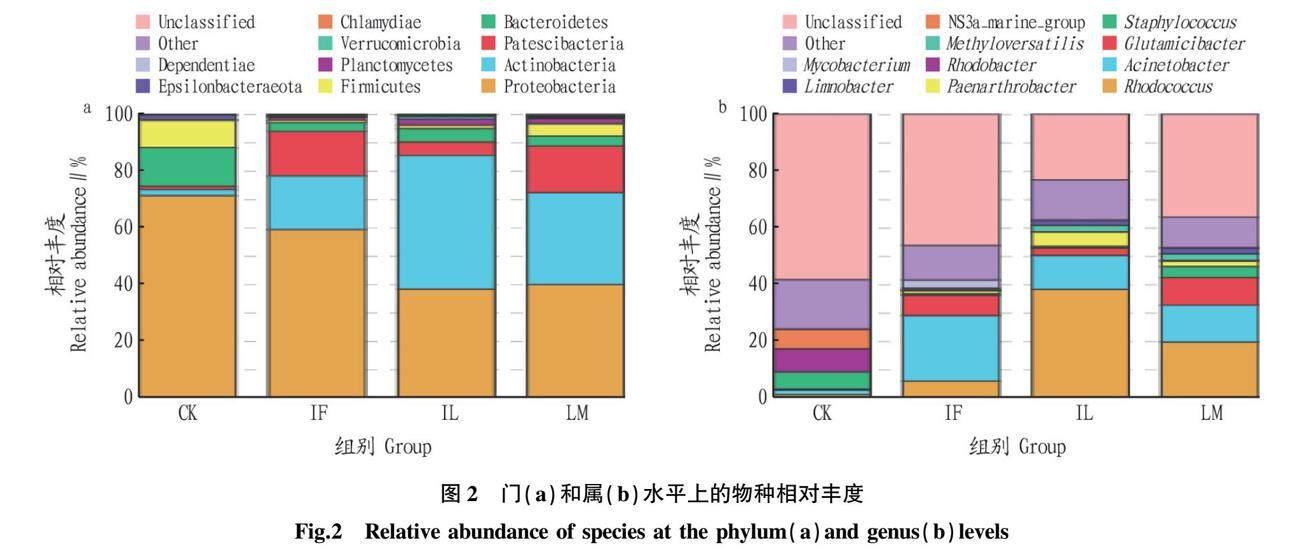
将培养21 d后的3个组与CK组初始水样微生物进行对比,根据物种注释结果,选取各样品丰度排名前10的物种,以门(Phylum)、属(Genus)水平为例绘制物种相对丰度图(图2)。
在门水平上,有以下10种相对丰度较大的物种,分别是Dependentiae、弯曲杆菌门(Epsilonbacteraeota)、衣原体门(Chlamydiae)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、Patescibacteria、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)。从门分类水平上细菌相对丰度变化趋势分析,初始水体门级微生物分布如CK所示,其优势菌门为变形菌门(71.17%)、拟杆菌门(13.70%)、厚壁菌门(9.54%)。经过21 d的培养,蕹菜组(IF)水体的优势菌门为变形菌门(59.15%)、放线菌门(18.95%)、Patescibacteria(15.77%);甘薯组(IL)水体的优势菌门为放线菌门(47.12%)、变形菌门(38.23%)、拟杆菌门(4.73%);枸杞组(LM)水体的优势菌门为变形菌门(39.85%)、放线菌门(32.41%)、Patescibacteria(16.41%)。
在属水平上,有以下10种相对丰度较大的物种,分别是分枝杆菌属(Mycobacterium)、柠檬酸杆菌属(Limnobacter)、NS3a_marine_group、甲基过苜蓿属(Methyloversatilis)、红杆菌属(Rhodobacter)、类节杆菌属(Paenarthrobacter)、葡萄球菌属(Staphylococcus)、谷氨酸杆菌属(Glutamicibacter)、不动杆菌属(Acinetobacter)、红球菌属(Rhodococcus)。从属分类水平上细菌相对丰度变化趋势分析,初始水体属级微生物分布如CK所示,其优势菌属为红杆菌属(8.03%)、葡萄球菌属(5.98%)。同样经过21 d的培养,蕹菜组(IF)水体的优势菌属为不动杆菌属(23.06%)、谷氨酸杆菌属(7.19%)、红球菌属(5.84%);甘薯组(IL)水体的优势菌属为红球菌属(38.17%)、不动杆菌属(11.96%)、类节杆菌属(5.04%);枸杞组(LM)水体的优势菌属为红球菌属(19.57%)、不动杆菌属(13.01%)、谷氨酸杆菌属(9.78%)。红球菌属、不动杆菌属虽在各样品中均存在,因其环境因子的变化导致其所占比例存在明显差异,说明水体微生物的组成受到环境的影响。
根据OTU数目及属水平聚类分析结果和研究需求,将所有样品进行均一化处理,基于各组之间共有和特有的OTU数目绘制Upset图(图3)。从图3可以看出不同样品OTU数目组成相似性及重叠情况,LM组OTU数目最多,为852种,IL组最少,为787种;3组共有的OTU数目为450种,不同样品中特有OTU数目表现为IF组最高(269种),LM组次之(234种),IL组最少(184种)。属水平上,3组共有的OTU数目为159种,IF组特有的OTU数目为39种,IL组和LM组分别为24和20种。IF组2个水平的特有OTU数目均最高。
2.3 微生物多样性分析
Alpha多样性主要关注样品中微生物群落多样性[17],通过该分析方法来反映样品中微生物群落的多样性和丰富度。从表2可以看出,4个水样微生物的Shannon-Wiener多樣性指数和Simpson多样性指数排序均为LM>IF>IL>CK,表明枸杞组根系水样中微生物群落多样性相对较高。Chao1指数和ACE指数分别用于估算样品中所含OTU数目和物种组成的丰富度、均匀度。枸杞组(LM)的Chao1指数最高,与实测的OTU数目相吻合,表明枸杞组(LM)细菌种类数量最多、群落丰度也最高。CK组的ACE指数最高,与实测的OTU数目最低有所偏差,可能是由于一些物种比其他物种更容易被检测到,从而出现物种丰富偏差,导致ACE指数偏高。
该研究中这2种指数的变化趋势除CK组外大体一致,均表现为枸杞组(LM)最大、蕹菜组(IF)最低,表明前者中含有的OTU数目最多,即微生物种类数量和丰度最高,而后者最低。
偏最小二乘法-判别分析(partial least squares-discriiminate analysis,PLS-DA)经常用来处理分类和判别问题,对3组蔬菜相似度进行比较。基于OTU水平的PLS-DA排序结果见图4,第1主成分(t1)为44.5%,第2主成分(t2)为28.9%。不同分组样本使用不同颜色表示,样本组成越相似,样本在图形上的距离越近,IL组和LM组都在第一象限,CK组在第二象限,IF组在第三象限,可见甘薯组(IL)和枸杞组(LM)差异最小。
2.4 聚类分析
为了进一步得到不同样品间群落结构差异,基于Weighted Unifrac距离并对OTU进行多序列比对构建非加权组平均聚类树(UPGMA),结果如图5所示,甘薯组(IL)与枸杞组(LM)相似度最高,与PLS-DA分析结果相同。
2.5 功能预测
根据FAPROTAX[18]预测出水样中生态功能的相对丰度,结果发现(图6),整体细菌群落功能注释相对丰度较高,不同组别之间细菌群落功能注释相对丰度相差较大。蕹菜组(IF)中细菌群落功能注释相对丰度最高,主要体现在硝酸盐反硝化作用(nitrate_denitrification)、亚硝酸盐反硝化作用(nitrite_denitrification)、硝化作用(nitrification)、氮的吸收(nitrogen_respiration)等功能上。甘薯组(IL)中细菌群落功能注释相对丰度最低,化合异化作用(chemoheterotrophy)、硝酸盐还原(nitrate_reduction)、尿素降解(ureolysis)等具有相对较高的丰度。枸杞组(LM)中细菌群落功能注释相对丰度较高,其中纤维素分解(cellulolysis)、光自养(photoautotrophy)、含氧光合作用(oxygenic_photoautotrophy)等丰度较高。
2.7 水质变化
为期21 d试验,各系统的环境较为稳定[水温(27.3±1.0)℃、溶解氧(5.54±0.50)mg/L、pH 8.17±0.04、亚硝酸盐(0.06±0.02)mg/L、氨氮(0.12±0.05)mg/L]。水质变化情况如图7所示,3种蔬菜对养殖水体的硝酸盐、磷酸盐的去除均有较好的效果。蕹菜组(IF)、甘薯组(IL)、枸杞组(LM)对硝酸盐的去除率分别为65.70%、46.18%、40.09%,该结果与“2.6”功能分析结果相同,蕹菜组的去除率显著高于甘薯组和枸杞组(P<0.05)。水体磷酸盐浓度在试验时间内总体保持持续下降的趋势,蕹菜组、甘薯组、枸杞组对水体磷酸盐的去除率分别达到67.57%、50.00%、52.70%,蕹菜组对水体中磷酸盐的去除率显著高于其他蔬菜组(P<0.05)。
3 讨论
3.1 微生物群落组成分析
门水平上的物种丰度图显示,对照组(CK)的优势菌群为变形菌门和拟杆菌门,但整体菌群分布不均匀,变形菌门占绝对优势。与对照组(CK)相比,试验组水体的总体菌群分布更为均匀,优势菌门为变形菌门和放线菌门。变形菌门是一种多功能细菌,能够去除氮和磷,降解有机物和减少化学需氧量,高比例变形菌门对于系统脱氮具有重要作用[19-20];有研究发现拟杆菌门对于降解养殖水体中可溶性有机物具有重要作用[19,21-22]。有研究表明,放线菌门可降解有机物,包括淀粉、蛋白质等大分子,并产生抗生素等抗菌物质[23]。该试验养殖池中放线杆菌门的增加有助于产生抗菌物质,甘薯组(IL)的放线菌门丰度明显高于其他两组,因此甘薯更有益于虾菜共生池的稳定。试验组的变形菌门丰度有所降低,其原因可能为养殖池中对虾排出的氮磷废物及代谢有机物残留,导致原池中对照组(CK)的变形杆菌较多,但经过蔬菜培养池后,水体中的氮磷和有机物减少,从而使变形菌门减少。
属水平上的物种丰度图显示,对照组(CK)中的优势菌属为红杆菌属和葡萄球菌属,其他菌属所占比例较少。与对照组(CK)相比,试验组的水体菌属变化差异较大,红球菌属和谷氨酸杆菌属的占比大幅提高,其中枸杞组(LM)总体菌属分布最为均匀。红杆菌属细菌被认定是新型的抗逆防病的益生菌资源和水产养殖动物肠道的核心定殖菌群[24],红杆菌属归于放线菌门(Actinobacteria),有较强抗性,可适应高盐分环境[25],同时,红杆菌属是污染物微生物降解的最为关键的类群之一[26]。甘薯组(IL)和枸杞组(LM)的优势菌属均为红球菌属(分别占38.17%和19.57%)。红球菌是一类革兰氏阳性菌,属放线菌门(Actinobacteria),可分解代谢多种芳香族化合物[27-28]。红球菌属被认为是有前途的持久性污染物生物降解剂[29],且可以产生大量的水解酶和氧化酶,从而充分利用环境污染物中的碳源进行生物降解[30-31],红球菌属还可以对部分水生细菌病原体表现出显著的抑制活性[32]。因此,在虾菜共生系统的养殖过程中,红球菌属在处理污染物以及对抗病原菌方面具有重要的作用,而甘薯和枸杞对维持水环境稳定有明显的效果。与对照组(CK)相比,试验组中红杆菌属明显减少,是由于在虾菜共生系统中,对虾在养殖过程中会排出盐分等代谢物,但在试验组中,排除了对虾因素对试验干扰,故不会排出这些代谢物,从而导致红杆菌属相对减少。
3.2 水质条件与微生物多样性的关系
FAPROTAX生态功能預测图及水质结果显示,蕹菜组(IF)的微生物组成对硝酸盐、亚硝酸盐的反硝化作用及氮的吸收丰度较高,且对硝酸盐和磷酸盐的去除率达65.70%和67.57%。大量的研究表明,蕹菜对鱼池、虾池的氮有较好的净化效果[33-34],是对重污染河道净化处理的优良生物材料之一[35]。蕹菜的生长有利于净化水质,消除富营养化[12]。蕹菜因其具有生长快、繁殖力强、对水体中氮磷去除效果好等优点[36-37],已被广泛应用于养殖水体中营养物的去除效果研究。蕹菜对水质影响的研究颇多,相较于枸杞和甘薯的研究甚少,枸杞在中国传统医学中占有重要地位,在中国作为食物和草药已有几千年的历史[38-39]。枸杞是一种极具药用价值的蔬菜且对磷酸盐吸收较好,是虾菜共生池的模式下一种极具潜力的蔬菜品种。
Upset图、多样性指数结果显示,枸杞组(LM)OUT数目最多且Shannon-Wiener指数最高,明显高于其他试验组;但蕹菜组(IF)特有OTU数目最高(269种),枸杞组(LM)次之(234种)。现有研究表明,种植基质中微生物组成多样性越高、群落结构越复杂,越能促进植物的生长,单一细菌与真菌菌群对植物生长甚至产生抑制作用[40]。微生物的丰度和多样性随水体营养水平的变化而变化[41],并能显著影响微生物群落功能[42]。在虾菜共生池中配不同面积的不同蔬菜不仅可对氮、磷等含量起到有效控制,也可以对微生物多样性起到促进作用,蔬菜的富集对消除水体富营养化有重要意义。根据水质及多样性情况,推测蕹菜对硝酸盐、磷酸盐去除效果好与其特有OTU数目有关。
4 结论
该研究基于Illumina高通量测序技术,通过对系统养殖水体的细菌16S rDNA基因序列的测定,探讨了不同水培蔬菜的微生物组成及其多样性,并对其功能分析进行了相关研究。结果表明,枸杞组(LM)的OTU数目、Shannon-Wiener指数和Simpson指数最高,表明枸杞养殖的水体生物多样性丰富;蕹菜组(IF)对硝酸盐、磷酸盐去除率分别达65.70%和67.57%,对水体的净化效果较好。不同系统水体中门水平上的优势菌群为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、Patescibacteria;属水平优势菌群为红球菌属(Rhodococcus)、不动杆菌属(Acinetobacter)、谷氨酸杆菌属(Glutamicibacter)。各组间水体的微生物组成差异较大,甘薯和枸杞的组成接近且功能类似,两者对水环境的稳定起到更显著的作用。从水质净化角度来看,蕹菜对硝酸盐、磷酸盐有更强的净化能力,是虾菜共生系统中优良的选择。
参考文献
[1] BARTELME R P,OYSERMAN B O,BLOM J E,et al.Stripping away the soil:Plant growth promoting microbiology opportunities in aquaponics[J].Frontiers in microbiology,2018,9:1-7.
[2] 张健龙,江敏,王城峰,等.凡纳滨对虾(Litopenaeus vannamei)循环水养殖塘挂膜式生物滤器内微生物的多样性[J].渔业科学进展,2017,38(5):73-82.
[3] 张龙,陈钊,汪鲁,等.凡纳滨对虾循环水养殖系统应用研究[J].渔业现代化,2019,46(2):7-14.
[4] 张正,李彬,王印庚,等.基于高通量测序的池塘养殖半滑舌鳎消化道菌群的结构特征分析[J].水生生物学报,2015,39(1):38-45.
[5] RAPIN A,PATTARONI C,MARSLAND B J,et al.Microbiota analysis using an Illumina MiSeq platform to sequence 16S rRNA genes[J].Current protocols in mouse biology,2017,7(2):100-129.
[6] CAPORASO J G,LAUBER C L,WALTERS W A,et al.Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J].The ISME journal,2012,6(8):1621-1624.
[7] XU W J,XU Y,HUANG X S,et al.Addition of algicidal bacterium CZBC1 and molasses to inhibit cyanobacteria and improve microbial communities,water quality and shrimp performance in culture systems[J].Aquaculture,2019,502:303-311.
[8] ORCUTT B N,SYLVAN J B,KNAB N J,et al.Microbial ecology of the dark ocean above,at,and below the seafloor[J].Microbiology and molecular biology reviews,2011,75(2):361-422.
[9] FAN L F,WANG Z L,CHEN M S,et al.Microbiota comparison of Pacific white shrimp intestine and sediment at freshwater and marine cultured environment[J].Science of the total environment,2019,657:1194-1204.
[10] 徐如衛,杨福生,俞奇力,等.凡纳滨对虾循环水养殖可行性研究[J].河北渔业,2015(3):25-28,59.
[11] 祁真,杨京平,刘鹰.封闭循环水养殖南美白对虾的水质动态研究[J].水利渔业,2004(3):37-39.
[12] 臧维玲,戴习林,徐嘉波,等.室内凡纳滨对虾工厂化养殖循环水调控技术与模式[J].水产学报,2008,32(5):749-757.
[13] 杨天燕,孟玮,高攀,等.基于高通量测序的鱼菜共生池塘与普通池塘微生物群落结构比较[J].水生生物学报,2019,43(5):1104-1113.
[14] 徐鹏,张紫英,李文红,等.绿狐尾藻和空心菜对模拟池塘养殖尾水的净化效果分析[J].南方农业学报,2022,53(10):2812-2820.
[15] 邱楚雯,袁新程,施永海,等.池塘鱼菜立体种养系统的微生物群落结构分析[J].大连海洋大学学报,2021,36(3):454-461.
[16] 陈雅林,谭芳,彭勇.枸杞叶的研究进展[J].中国药学杂志,2017,52(5):358-361.
[17] LI B,ZHANG X X,GUO F,et al.Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J].Water research,2013,47(13):4207-4216.
[18] LOUCA S,PARFREY L W,DOEBELI M.Decoupling function and taxonomy in the global ocean microbiome[J].Science,2016,353(6305):1272-1277.
[19] COTTRELL M T,KIRCHMAN D L.Natural assemblages of marine proteobacteria and members of the Cytophaga-Flavobacter cluster consuming low- and high-molecular-weight dissolved organic matter[J].Applied and environmental microbiology,2000,66(4):1692-1697.
[20] 张海耿,马绍赛,李秋芬,等.循环水养殖系统(RAS)生物载体上微生物群落结构变化分析[J].环境科学,2011,32(1):231-239.
[21] COTTRELL M T,KIRCHMAN D L.Community composition of marine bacterioplankton determined by 16S rRNA gene clone libraries and fluorescence in situ hybridization[J].Applied and environmental microbiology,2000,66(12):5116-5122.
[22] 熊向英,王志成,刘旭佳,等.工厂化循环水养殖系统微生物群落结构和功能分析[J].水产科学,2022,41(5):810-819.
[23] ZOTHANPUIA,PASSARI A K,LEO V V,et al.Bioprospection of actinobacteria derived from freshwater sediments for their potential to produce antimicrobial compounds[J].Microbial cell factories,2018,17(1):1-14.
[24] 高繁,干恩磊,刘巍,等.凡纳滨对虾肠道红杆菌科细菌富集碳源筛选及其定向分离[J].微生物学报,2022,62(5):1805-1818.
[25] 杜思垚,陈静,刘佳炜,等.基于宏基因组学揭示咸水滴灌对棉田土壤微生物的影响[J].环境科学,2023,44(2):1104-1119.
[26] 杨浩,杨晓妮,张国珍,等.窖水中微生物降解污染物的关键细菌[J].环境科学,2018,39(10):4766-4777.
[27] WARHURST A M,FEWSON C A.Biotransformations catalyzed by the genus Rhodococcus[J].Critical reviews in biotechnology,1994,14(1):29-73.
[28] ROUND J,ROCCOR R,LI S N,et al.A fatty acyl coenzyme A reductase promotes wax ester accumulation in Rhodococcus jostii RHA1[J].Applied and environmental microbiology,2017,83(20):1-34.
[29] SOLYANIKOVA I,GOLOVLEVA L.Biochemical features of the degradation of pollutants by Rhodococcus as a basis for contaminated wastewater and soil cleanup[J].Mikrobiologiia,2011,80(5):591-607.
[30] 邱孜博,汪荣,张杨,等.红球菌及其生物降解作用研究进展[J].食品科学,2016,37(7):254-258.
[31] 张光军,方萍.红球菌在石油烃类物质降解中的作用[J].环境科学与技术,2013,36(2):93-99.
[32] BODHAGURU M,PRAKASH S,RAMASUBBURAYAN R,et al.Screening,partial purification of antivibriosis metabolite sterol-glycosides from Rhodococcus sp.against aquaculture associated pathogens[J].Microbial pathogenesis,2019,134:1-11.
[33] 黄海平.水蕹菜浮床在精养鱼池中的应用效果研究[D].武汉:华中农业大学,2012.
[34] 叶聪.几种水培蔬菜在凡纳滨对虾养殖塘中的应用开发研究[D].上海:上海海洋大学,2014.
[35] 操家顺,李欲如,陈娟.水蕹菜对重污染河道净化及克藻功能[J].水资源保护,2006,22(2):36-38,41.
[36] 杨晓玲,郭金耀.水蕹菜对富营养化养殖水的净化作用研究[J].作物杂志,2012(1):49-52.
[37] 谭洪新,罗国芝,朱学宝,等.水栽培蔬菜对养鱼废水的水质净化效果[J].上海水产大学学报,2001(4):293-297.
[38] KIM M H,KIM E J,CHOI Y Y,et al.Lycium chinense improves post-menopausal obesity via regulation of PPAR-γ and estrogen receptor-α/β expressions[J].The American journal of Chinese medicine,2017,45(2):269-282.
[39] POTTERAT O.Goji(Lycium barbarum and L.chinense):Phytochemistry,pharmacology and safety in the perspective of traditional uses and recent popularity[J].Planta medica,2010,76(1):7-19.
[40] 劉杰.连作及轮作土壤微生物菌群对黄瓜生长的影响[D].哈尔滨:东北农业大学,2015.
[41] NOGALES B,LANFRANCONI M P,PIA-VILLALONGA J M,et al.Anthropogenic perturbations in marine microbial communities[J].FEMS microbiology reviews,2011,35(2):275-298.
[42] BELL C W,ACOSTA-MARTINEZ V,MCLNTYRE N E,et al.Linking microbial community structure and function to seasonal differences in soil moisture and temperature in a Chihuahuan Desert grassland[J].Microbial ecology,2009,58(4):827-842.

