重金属汞胁迫下菲律宾蛤仔GPx和GST基因表达分析
郑志龙 闫路路 闫喜武 秦艳杰

摘要 为研究重金属汞胁迫下菲律宾蛤仔谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)基因的表达情况,用汞对指示生物菲律宾蛤仔(Ruditapes philippinarum)进行单一慢性暴露试验,分别在0、12、24 h以及2、3、4、5、6、7和8 d时检测菲律宾蛤仔内脏团和鳃中GPx和GST基因的表达情况。结果表明,菲律宾蛤仔内脏团中GPx和GST基因的表达量都呈现波动变化趋势,分别在24和12 h时表达量最高(P<0.05),6 d时GPx基因表达量最低(P>0.05),3 d时GST基因表达量最低(P<0.05);GPx基因在鳃中的表达量在8 d时最高(P<0.05);鳃中GST基因的表达量在5 d时最高(P<0.05)。以上结果表明汞暴露在短期内能够诱导GPx和GST基因进行不同程度的表达,但其随着时间的延长呈明显的抑制作用。该研究结果为揭示重金属汞对菲律宾蛤仔的毒性机理提供了理论依据。
关键词 重金属汞;菲律宾蛤仔;谷胱甘肽过氧化物酶;谷胱甘肽-S-转移酶
中图分类号 S917.4 文献标识码 A 文章编号 0517-6611(2024)10-0113-07
doi:10.3969/j.issn.0517-6611.2024.10.024
Expression Analysis of GPx and GST Genes in Ruditapes philippinarum Under Heavy Metal Mercury Stress
ZHENG Zhi-long1,2, YAN Lu-lu1,2, YAN Xi-wu1,2 et al
(1.College of Fisheries and Life Science, Dalian Ocean University, Dalian, Liaoning 116023;2.Liaoning Shellfish Breeding Engineering Technology Center, Dalian,Liaoning 116023)
Abstract In order to study the gene expression of glutathione peroxidase (GPx) and glutathione-S-transferase (GST) in Ruditapes philippinarum under the stress of heavy metal mercury (Hg), a single chronic exposure experiment on the indicator organism R. philippinarum was carried out. The expression of two genes in visceral mass and gill of R. philippinarum was detected at 0,12 h,24 h and 2, 3, 4, 5, 6, 7 and 8 d. The results showed that the expression multiples of GPx and GST in the visceral mass showed a fluctuation trend, and the expression multiples reached the highest (P<0.05) at 24 and 12 h, respectively. The expression level was the lowest at 6 d(P>0.05)and 3 d (P<0.05). The expression multiple of GPx in the gill was the highest at 8 d (P< 0.05), and the first peak appeared at 5 d. The expression amount of GST was the highest at 5 d (P<0.05). It showed that mercury exposure could induce the expression of GPx and GST in different degrees in the short term,but it had obvious inhibitory effect with the extension of time. This study provided the theoretical basis for revealing the toxicity of heavy metal mercury to R. philippinarum.
Key words Heavy metal mercury;R. philippinarum;Glutathione peroxidase;Glutathione-S-transferase
基金項目 山东省重点研发计划项目(2023LZGCQY001);现代农业产业技术体系专项(CARS-49);国家重点研发计划项目(2018YFD0901400)。
作者简介 郑志龙(1999—),男,福建福州人,硕士研究生,研究方向:水产动物遗传育种与繁殖。
*通信作者,教授,博士,从事水产养殖学研究。
收稿日期 2023-04-21
随着城市化发展的不断加快,大量城市污水和固体废弃物直接排入水中,致使重金属污染严重破坏海洋生态系统平衡,已引起广泛关注。重金属污染物(Hg、Cd、Pb、Cr、Cu、Zn等)流动性低、难以降解且难溶于水,但来源十分广泛,残留时间久并通过食物链被生物富集和传递,最终汇入海洋造成不可逆转的伤害,严重危及人体健康[1]。
重金属汞已成为全球关注的持续性污染物,被列为污染物优先排查的控制目标[2]。重金属汞进入海洋无法降解,只能通过颗粒沉降进入沉积物才能离开海洋,但沉积物中有机组分矿化及生物扰动会促使汞释放出来重新进入水体[3]。在此过程中其对底栖生物又造成了危害,继而造成二次污染,危害海洋生物。
金属的毒性作用已经在许多水生生物中被证实[4]。双壳贝类最具代表性,其金属中毒的主要后果是氧化应激[5]。大量研究表明,金属中毒促进了生物體内活性氧(ROS)的生成,进而导致细胞过氧化损伤、脂质过氧化等[6]。为了减少活性氧对生物的影响,生物体内启动有效的抗氧化防御机制,主要包括谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)[7]。因此,对抗氧化反应和脂质过氧化水平的评价常常被应用于双壳贝类在重金属暴露环境的研究中[8]。谷胱甘肽过氧化物酶(GPx)通过将内源性活性氧维持在相对较低水平来保护细胞免受氧自由基的损害,并减轻其应激反应相关的损害[9]。谷胱甘肽-S-转移酶(GST)是一种Ⅱ期解毒酶,参与有机化合物的结合和解毒,通过催化谷胱甘肽过氧化物酶的活性,发挥抗氧化应激的保护作用[10],因此它被认为是监测海洋海岸生态系统金属污染的生物标记物[11]。
我国是海水养殖大国,贝类是四大海水养殖产品之一。其中,菲律宾蛤仔在水体中分布广泛,对多种重金属(Cd、Zn、Cu、Hg和Cr等)有较高的富集能力,因此菲律宾蛤仔不仅被用于重金属污染监测,而且在海洋毒理学研究中被广泛应用[12]。针对重金属汞的海洋生态毒理学研究,一般包括生长、呼吸、行为、繁殖、滤食和发育等方面[13]。为了保护海洋生物免受汞的毒害,要加强对重金属汞的防治和控制,明确重金属汞对海洋生物的毒性效应。笔者选取谷胱甘肽过氧化物酶(GPx)和谷胱甘肽-S-转移酶(GST)这2个与谷胱甘肽代谢相关的关键基因,通过实时荧光定量PCR方法验证和分析这2个基因
在汞胁迫下菲律宾蛤仔体内的表达情况,旨在为揭示重金属汞对菲律宾蛤仔的毒性机理提供理论依据。
1 材料与方法
1.1 试验动物
试验动物为菲律宾蛤仔,购于大连长兴市场(进货渠道为大连庄河周边养殖场),壳长(3.0±0.5)cm,个体健壮,生活状态良好。
1.2 试验药品
动物组织总RNA提取试剂盒(柱型),购自天根生化科技(北京)有限公司;
SYBR Premix Ex TaqTM Ⅱ Kit,购自宝生物工程(大连)有限公司;
PrimeScriptTM RT reagent Kit,购自宝生物工程(大连)有限公司。
1.3 主要仪器与设备
核酸蛋白检测仪,为德国Implen NanoPhotometer公司产品;
荧光定量检测系统Mx3005p,为美国Agilent Stratagene公司产品;
梯度PCR仪,为德国Eppendorf公司产品;
电泳仪,为北京六一仪器厂产品;
生物电泳图像分析系统,为上海天能科技有限公司产品;
高速冷冻离心机,为德国Hettich公司产品。
1.4 试验方法
1.4.1 汞胁迫下菲律宾蛤仔表达谱研究。
1.4.1.1
测序与序列比对。将经0.094 8 mg/L Hg处理的菲律宾蛤仔分别在0、12 h和6 d时取其鳃和内脏团,并迅速放入液氮中保存。采用Invitrogen公司的Trizol试剂提取RNA;提取RNA后,按照Invitrogen公司的Dynabeads mRNA纯化试剂盒进行mRNA的纯化。将mRNA在fragmentation buffer提供的高盐理性环境下,高温打断;以打断的mRNA为模板,用六碱基随机引物(random hexamers)合成cDNA第一链,加入缓冲液、dNTPs、RNase H和DNA polymerase Ⅰ合成cDNA第二链;经过QiaQuick PCR纯化试剂盒纯化并加入EB缓冲液洗脱,末端修复、加碱基A后加上测序接头,再经过琼脂糖凝胶电泳回收目的片段大小的核酸序列,进行PCR扩增,从而完成整个文库制备工作,构建的文库用Illumina HiSeqTM 2000测序仪进行测序。测序仪产生的原始图像数据经base calling转化为序列数据,序列数据包含reads的序列及reads的测序质量,原始reads数据中带有含测序接头的序列和少量低质量序列;最后,利用SOAPaligner/Soap2软件,将每个样品的clean reads分别与菲律宾蛤仔转录组进行比对,最后将比对得到的基因用于后续生物信息学分析。
1.4.1.2 生物信息学分析。对clean reads进行测序评估,并根据clean reads比对到参考序列(菲律宾蛤仔转录组)上的数量及分布,采用RPKM法(reads per kilobase per million)计算该基因的表达量,计算公式如下:
RPKM(A)=106CNL/103(1)
式中:RPKM(A)为A基因的表达量;C为唯一比对到A基因的reads数;N为唯一比对到参考基因的reads数;L为A基因的碱基数。
通过比较不同样本的数据,利用概率公式筛选出差异表达基因。差异表达基因同时需要满足差异检验FDR≤0.001且基因A与基因B的相对表达量绝对值|log2Ratio(A/B)|≥1。将满足上述条件的差异表达基因进行以下分析:
(1)基因表达模式聚类分析:表达模式相似的基因通常具有相似的功能,因此利用差异表达基因和试验条件同时进行等级聚类分析。
(2)Pathway显著性富集分析:以KEGG pathway为单位,找出差异表达基因中显著性富集的pathway。
为进一步了解差异表达基因的生物学功能,以KEGG pathway为单位,找出与整个转录组相比差异表达基因显著富集的KEGG pathway。按照以下计算公式,计算P值:
P=1-m-1i=0MiN-Mn-iNn
(2)
式中,N为转录组中具有pathway注释的基因数目,n为具有pathway注释的差异表达基因数,
M为转录组中注释为某特定pathway条目的基因数目,
m为注释为某特定pathway条目的差异表达基因数。
设定Q值≤0.05的KEGG pathway为显著性富集,由此确定重金属胁迫下菲律宾蛤仔差异表达基因参与的主要生化代谢途径和信号转导途径。
1.4.2 GPx和GST基因实时荧光定量PCR分析。
1.4.2.1 前期处理和取样。
菲律宾蛤仔暂养7 d后,用96 h半致死浓度(0.094 8 mg/L)的Hg处理菲律宾蛤仔,分别在0、12、24 h以及2、3、4、5、6、7、8 d取其鳃和内脏团,迅速冷冻在液氮中,保存于-80 ℃冰箱中。
1.4.2.2 总RNA的提取。
按照天根生化科技(北京)有限公司提供的动物组织总RNA提取试剂盒说明书提取样品总RNA。
1.4.2.3
RNA纯度及浓度检测。
总RNA经过1%的琼脂糖凝胶电泳检测其完整性,电泳液为0.5×TBE,电泳时间为30 min,电泳后在凝胶成像仪下观察RNA条带。将没有弥散且条带清晰的总RNA在核酸蛋白检测仪上检测RNA纯度和浓度,选择纯度1.9~2.1、浓度≥61.5 ng/μL的RNA样品用于后续试验,将不合格样品重新提取总RNA,直到满足条件为止。
1.4.2.4 cDNA第一链的合成。
将检测合格的RNA样品,分别取800 ng总RNA进行反转录,按照反转录试剂盒说明书进行,整个试验操作在冰上进行,反转录体系如下:5×PrimeScriptTM buffer 4 μL、
PrimeScriptTM RT enzyme Mix I 1 μL、
Oligo dT Primer(50 μmol/L)1 μL、
Random 6 mers(100 μmol/L)1 μL、
Total RNA 900 ng,
用RNase Free H2O補足20 μL。反应条件:37 ℃,15 min;85 ℃,5 s;
4 ℃下分装并保存于-80 ℃冰箱中备用。
1.4.2.5 qRT-PCR引物设计。
根据引物设计原则,设计内参基因和目的基因引物。内参基因Tubulin,目的基因GPx和GST序列均来自菲律宾蛤仔转录组序列。引物设计完成后,委托生工生物工程(上海)股份有限公司进行引物合成,经过引物筛选,设计引物序列如下:
Tubulin-F为AAGCGTCTATGATTCTGG,Tubulin-R为GGTAAGGGCAAAGGTAT;
GPx-F为GAATGTAGCATCCCTCTG,
GPx-R为TCTCCTGGTGTCCAAACT;
GST-F为TGCTTCAGGCTCTTGCT;
GST-R为TATCTTGACGAAACTACCC。
1.4.2.6 GPx和GST基因实时荧光定量PCR。
将反转录得到的所有cDNA各取1 μL,混合后作为cDNA的混合模板,按照2×50、2×51、2×52、2×53、2×54倍数进行稀释,用于标准曲线的制备。确定标准曲线后,对内参基因、GST和GPx基因进行实时荧光定量PCR,反应体系如下:
2×SYBR Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)10.0 μL,
PCR Forward Primer(0.4 μmol/L)0.8 μL,
PCR Reverse Primer(0.4 μmol/L)0.8 μL,
ROX Reference Dye Ⅱ(50×)0.4 μL,
cDNA(≤100 ng)2.0 μL,用ddH2O补足20 μL。qRT-PCR反应程序:95 ℃30 s;95 ℃10 s,56 ℃25 s,72 ℃25 s,40个循环。
2 结果与分析
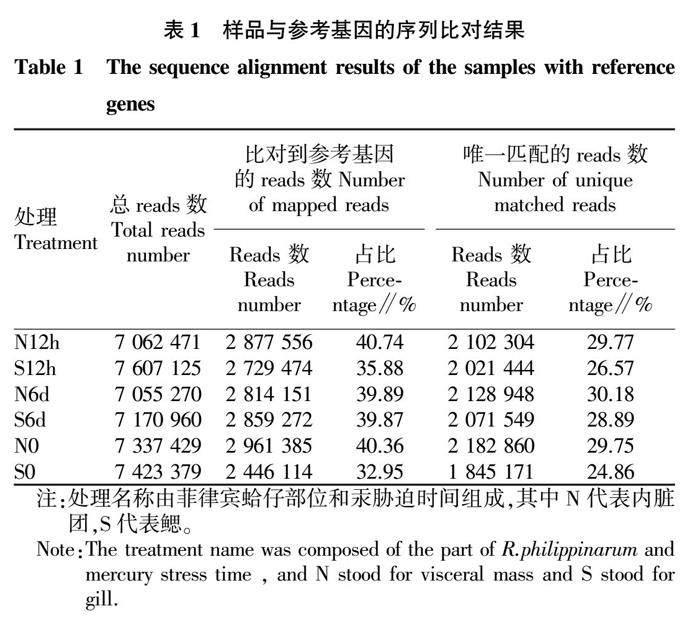
2.1 序列比对结果
将6个样品分别与参考基因进行序列比对,得到所测样品总reads数、比对到参考序列的reads数和唯一比对到参考序列的reads数,结果见表1。
2.2 差异基因表达筛选
差异表达基因筛选原则:
①差异检验中阳性发现错误率(false discovery rate,FDR)≤0.001;
②差异倍数在2倍及以上,即|log2Ratio| ≥1。
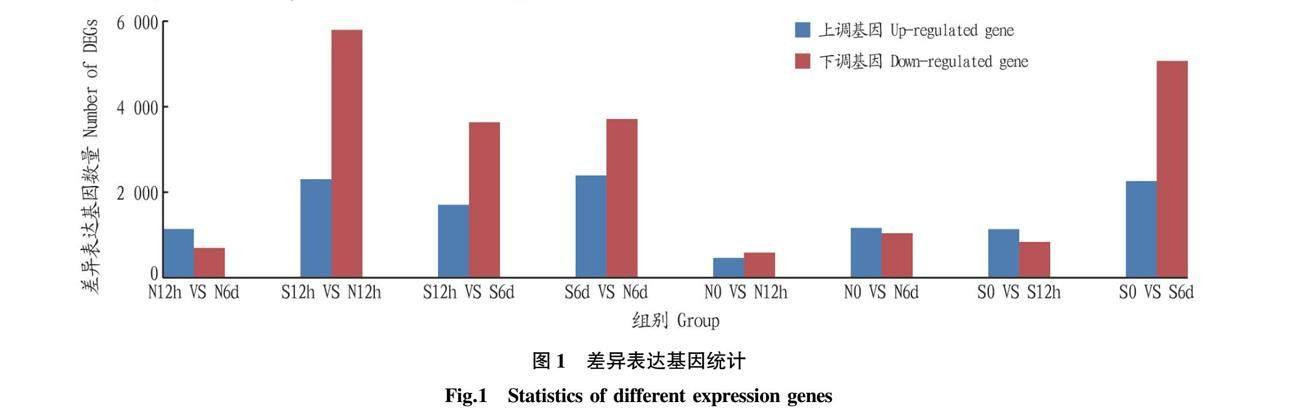
试验以单变量为比对原则,将样品进行两两比对,并得到差异表达基因统计图(图1)。从图1可以看出,S0 VS S6d有2 251个上调基因和5 051个下调基因。
2.3 KEGG Pathway显著性富集分析 通过KEGG通路显著性富集分析,得到KEGG中显著性富集的通路,同时确定差异表达基因参与的主要生化代谢途径和信号转导途径,具体结果见图2。由图2可知,鳃在胁迫12 h时显著基因主
要富集
在丙氨酸、天冬氨酸和谷氨酸代谢,脂肪酸生物合成,氮代谢,牛磺酸和亚牛磺酸代谢,精氨酸和脯氨酸代谢等代谢通路(P<0.05);鳃在胁迫6 d时显著基因主要富集于谷胱甘肽代谢、苯丙氨酸代谢、半胱氨酸和蛋氨酸代谢等代谢通路(P<0.05)。内脏团在胁迫12 h时显著基因主要富集于氨酰-tRNA生物合成、氰基氨基酸代谢、牛磺酸和亚牛磺酸代谢以及丙氨酸、天冬氨酸和谷氨酸代谢等代谢通路(P<0.05);内脏团在胁迫6 d时显著基因主要富集于氨酰-tRNA生物合成、内质网中的蛋白质加工以及氨基糖和核苷酸糖代谢等代谢通路(P<0.05)。
2.4 汞胁迫下蛤仔GPx和GST基因的表达
以Tubulin作为内参基因,以筛选好的引物为荧光定量引物,采用相对定量的方法检测目的基因(GPx和GST基因)在菲律宾蛤仔鳃和内脏团中的表达情况。从图3~6可以看出,在Hg胁迫菲律宾蛤仔试验中,内脏团中GPx基因在24 h时表达量最高(P<0.05),在6 d时表达量最低(P>0.05);鳃中GPx基因在8 d 时表达量最高(P<0.05),在24 h时表达量最低(P<0.05);内脏团中GST基因在12 h时表达量最高(P<0.05),在3 d时表达量最低(P<0.05);鳃中GST基因在5 d时表达量最高(P<0.05)。
2.5 qRT-PCR与表达谱分析结果的比较
以各组GPx和GST基因与对照组的相对表达量为研究指标,分析发现目的基因上下调一致率达到87.5%,仅有1组数据不一致(图7)。
3 讨论
3.1 贝类GPx和GST基因的防御作用
该研究在筛选大量差异表达基因的基础上,用Hg对菲律宾蛤仔进行胁迫,通过荧光定量PCR方法进一步研究基因表达情况。结果发现,谷胱甘肽代谢通路中的大多数酶基因在汞胁迫后的菲律宾蛤仔体内表现出显著的表达变化。其中,谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)是谷胱甘肽代谢通路中的关键酶,在解毒系统和抗氧化系统中均起到非常重要的作
用[14-15],
因此研究这2个酶基因在重金属胁迫菲律宾蛤仔中的表达情况意义重大。目前已有学者研究了文蛤(Meretrix meretrix)[16]、虾夷扇贝(Mizuhopectenyessoensis)[17]、太平洋长牡蛎(Crassostrea gigas)[18]、菲律宾蛤仔(Ruditapes philippinarum)[19]、三角帆蚌(Hyriopsis cumingi)[20]、厚壳贻贝(Mytilus coruscus)[21]等贝类的GPx和GST基因表达情况。Wang等[22]研究Nrf2-Keap1信号通路对多环芳烃暴露下菲律宾蛤仔抗氧化防御系统及氧化损伤的影响,检测了注射dsRNA-Nrf2后的菲律宾蛤仔中CAT、GPx和GST mRNA的表達情况,暴露前12 h CAT和GPx的mRNA表达量显著高于暴露第0天(P<0.05);RpNrf2-dsRNA组4、5 d时检测到GPx和GST-pi mRNA的表达量显著升高(P<0.05);RpNrf2-dsRNA组GST-pi活性在4、5 d时显著低于GFP-dsRNA和PBS组,抑制作用在3 d时达到峰值。Wang等[23]在栉孔扇贝Nrf2-Keap1信号通路在BaP诱导的抗氧化防御反应中的分子机制研究中发现,注射Bap后第1天Cfkeap1-dsRNA组栉孔扇贝消化腺和鳃中的GPx mRNA表达量与对照组相比没有明显差异(P>0.05),而2 d时GPx的mRNA表达量高于对照组,与该试验结果相符。Vidal-Lin等[24]研究发现紫贻贝暴露于最高浓度的PCB 7 d后GST活性受到显著抑制,不同浓度的PCB对GPx活性都有显著诱导作用。以上报道结果和该试验结果均表明在毒物刺激下双壳贝类中GPx和GST基因表达量均发生不同程度的变化,在免疫防御中起重要作用。
3.2 重金属胁迫下GPx和GST基因表达分析
鳃是双壳类软体动物的滤食器官和呼吸器官[25],在Hg胁迫下抗氧化系统和解毒系统中关键酶基因GPx和GST基因分别表现出各自的表达谱。该研究结果表明Hg胁迫下菲律宾蛤仔鳃中GPx基因在5 d时达到第1个峰值(4.5倍左右,P<0.05),在8 d 时达到最高。蒋国萍[26]研究了Hg胁迫下斧文蛤体内GPx、SOD以及CAT基因的表达情况,结果显示GPx、SOD和CAT基因的表达量都呈先上升后下降的趋势,SOD、CAT以及GPx基因的表达量分别在3、1和2 d达到最大。以上结果表明,Hg胁迫下斧文蛤体内抗氧化酶在清除和转运活性氧过程中起到至关重要的作用。暴露于Hg胁迫环境下的菲律宾蛤仔和斧文蛤GPx基因表达量均发生变化,推测在Hg胁迫下双壳贝类鳃组织中GPx基因的表达对双壳贝类起到一定的机体调节和保护作用。该研究结果表明Hg胁迫下菲律宾蛤仔鳃中GST基因的表达量在5 d达到最大(82倍左右,P<0.05)。Jiang等[27]研究了菲律宾蛤仔在汞(Hg2+,2和10 μg/L)、苯并[a]芘单一和联合胁迫下GSTs基因表达量的变化,发现Hg2+和BaP处理显著诱导了菲律宾蛤仔肝胰腺中的GSTs。
双壳贝类的内脏团是消化系统的重要组成部分,能够富集重金属,从而对生物体造成危害[28]。该研究结果表明在Hg胁迫下菲律宾蛤仔内脏团中GPx和GST基因分别在24和12 h时表达量最高,分别为4倍左右(P<0.05)和2.7倍左右(P<0.05)。随着Hg暴露时间的延长,GPx和GST基因分别在6和3 d时表达量最低,分别为0.5左右(P>0.05)和0.2左右(P<0.05)。陈琳琳等[29]研究了汞、硒暴露对紫贻贝(Mytilus edulis)抗氧化酶系统的影响,结果表明汞暴露条件下GPx基因表达量随着暴露时间的延长呈先升高后降低的变化,2 d时表达量最大。该研究进一步推测出Hg对菲律宾蛤仔内脏团中GST基因的抑制程度要高于GPx基因,汞入侵引起了菲律宾蛤仔的应激反应,产生大量的GPx和GST来清除机体产生的活性氧自由基。
3.3 qRT-PCR与表达谱分析结果的比较 以各组GPx和GST基因与对照组的相对表达量为研究指标,分析发现目的基因上下调一致率达到87.5%,还有1组试验数据不一致。这可能与取样批次、养殖环境和个体差异有关。综合来看,荧光定量PCR试验结果与表达谱分析结果相似度高,可见表达谱分析结果准确性高,可直接用于基因表达的分析中,与鲈鱼[30]、斑马鱼[31]等表达谱分析结果基本一致,即表达谱分析试验结果准确,可为后续基因表达分析提供理论依据和参考。
4 结论
综上所述,汞暴露短期内能够诱导菲律宾蛤仔体内抗氧化防御系统来清除氧自由基。随着暴露时间的延长,表现出明显的抑制作用。因此,重金属汞慢性胁迫下菲律宾蛤仔体内GPx和GST基因表达量分析揭示了重金属汞在菲律宾蛤仔体内的作用规律,为深入研究重金属汞在菲律宾蛤仔体内重金属毒性作用提供理论基础。
参考文献
[1] YU B J,WANG X L,DONG K F,et al.Heavy metal concentrations in aquatic organisms(fishes,shrimp and crabs)and health risk assessment in China[J].Marine pollution bulletin,2020,159:1-13.
[2] 杨东方,王磊磊,高振会,等.胶州湾水体重金属HgⅡ.分布和污染源[J].海洋环境科学,2009,28(5):501-505.
[3] 魏爱泓,矫新明,毛成责,等.重金属汞对海洋底栖动物毛蚶和紫贻贝毒性效应研究[J].生态毒理学报,2018,13(6):352-359.
[4] WANG W X,MENG J,WENG N Y.Trace metals in oysters:Molecular and cellular mechanisms and ecotoxicological impacts[J].Environmental science:Processes & impacts,2018,20(6):892-912.
[5] MENG J,WANG W X,LI L,et al.Tissue-specific molecular and cellular toxicity of Pb in the oyster(Crassostrea gigas):mRNA expression and physiological studies[J].Aquatic toxicology,2018,198:257-268.
[6] CHAN C Y,WANG W X.A lipidomic approach to understand copper resilience in oyster Crassostrea hongkongensis[J].Aquatic toxicology,2018,204:160-170.
[7] FERREIRA C P,LIMA D,PAIVA R,et al.Metal bioaccumulation,oxidative stress and antioxidant responses in oysters Crassostrea gasar transplanted to an estuary in southern Brazil[J].Science of the total environment,2019,685:332-344.
[8] COMPANY R,SERAFIM A,BEBIANNO M J,et al.Effect of cadmium,copper and mercury on antioxidant enzyme activities and lipid peroxidation in the gills of the hydrothermal vent mussel Bathymodiolus azoricus[J].Marine environmental research,2004,58(2/3/4/5):377-381.
[9] LIVINGSTONE D R.Cytochrome P-450 and oxidative metabolism in invertebrates[J].Biochemical society transactions,1990,18(1):15-19.
[10] SHEEHAN D,MEADE G,FOLEY V M,et al.Structure,function and evolution of glutathione transferases:Implications for classification of non-mammalian members of an ancient enzyme superfamily[J].Biochemical journal,2001,360(1):1-16.
[11] VIDAL-LIN L,BELLAS J,CAMPILLO J A,et al.Integrated use of antioxidant enzymes in mussels,Mytilus galloprovincialis,for monitoring pollution in highly productive coastal areas of Galicia(NW Spain)[J].Chemosphere,2010,78(3):265-272.
[12] 孫珊,赵玉庭,王立明,等.山东省主要贝类养殖区重金属环境状况及贝类安全风险分析[J].渔业科学进展,2017,38(4):118-125.
[13] ZHANG Q F,LI Y W,LIU Z H,et al.Exposure to mercuric chloride induces developmental damage,oxidative stress and immunotoxicity in zebrafish embryos-larvae[J].Aquatic toxicology,2016,181:76-85.
[14] ZHANG L B,LIU X L,CHEN L L,et al.Transcriptional regulation of selenium-dependent glutathione peroxidase from Venerupis philippinarum in response to pathogen and contaminants challenge[J].Fish & shellfish immunology,2011,31(6):831-837.
[15] SALAZAR-MEDINA A J,GARCA-RICO L,GARCA-OROZCO K D,et al.Inhibition by Cu2+ and Cd2+ of a mu-class glutathione S-transferase from shrimp Litopenaeus vannamei[J].Journal of biochemical and molecular toxicology,2010,24(4):218-222.
[16] 王超.文蛤(Meretrix meretrix)选择群体生长、抗性差异的初步解析[D].北京:中国科学院研究生院(海洋研究所),2011.
[17] 单忠国.虾夷扇贝MyGPx基因的启动子克隆及表达[D].大连:辽宁师范大学,2011.
[18] GAO C,ZHANG X X,LI X M,et al.Toxic effects of heavy metal Cu2+ on the pacific oyster Crassostrea gigas[J].IOP conference series:Earth and environmental science,2017,64:1-11.
[19] JI C L,CAO L L,LI F.Toxicological evaluation of two pedigrees of clam Ruditapes philippinarum as bioindicators of heavy metal contaminants using metabolomics[J].Environmental toxicology and pharmacology,2015,39(2):545-554.
[20] LIU Y M,YANG M,ZHENG L,et al.Antioxidant responses of triangle sail mussel Hyriopsis cumingii exposed to toxic Microcystis aeruginosa and thermal stress[J].Science of the total environment,2020,743:1-9.
[21] QI P Z,TANG Z R.The Nrf2 molecule trigger antioxidant defense against acute benzo(a)pyrene exposure in the thick shell mussel Mytilus coruscus[J].Aquatic toxicology,2020,226:1-10.
[22] WANG H D,PAN L Q,SI L J,et al.Effects of Nrf2-Keap1 signaling pathway on antioxidant defense system and oxidative damage in the clams Ruditapes philippinarum exposure to PAHs[J].Environmental science and pollution research,2021,28:33060-33071.
[23] WANG H P,PAN L Q,XU R Y,et al.The molecular mechanism of Nrf2-Keap1 signaling pathway in the antioxidant defense response induced by BaP in the scallop Chlamys farreri[J].Fish & shellfish immunology,2019,92:489-499.
[24] VIDAL-LIN L,BELLAS J,SORIANO J A,et al.Bioaccumulation of PCB-153 and effects on molecular biomarkers acetylcholinesterase,glutathione-S-transferase and glutathione peroxidase in Mytilus galloprovincialis mussels[J].Environmental pollution,2016,214:885-891.
[25] 孫振兴,张晾,郝丽红,等.菲律宾蛤仔鳃组织的原代培养[J].水产科学,2004,23(2):12-14.
[26] 蔣国萍.海洋酸化条件下重金属Cd2+、Hg2+对斧文蛤生态毒理效应研究[D].上海:上海海洋大学,2016.
[27] JIANG W W,FANG J G,GAO Y P,et al.Biomarkers responses in Manila clam,Ruditapes philippinarum after single and combined exposure to mercury and benzo [a] pyrene[J].Comparative biochemistry and physiology part C:Toxicology & pharmacology,2019,220:1-8.
[28] RUELAS-INZUNZA J,SOTO L A,PEZ-OSUNA F.Heavy-metal accumulation in the hydrothermal vent clam Vesicomya gigas from Guaymas basin,Gulf of California[J].Deep sea research part I:Oceanographic research papers,2003,50(6):757-761.
[29] 陈琳琳,张高生,陈静,等.汞、硒暴露对紫贻贝(Mytilus edulis)抗氧化酶系统的影响[J].生态毒理学报,2011,6(4):383-388.
[30] XIANG L X,HE D,DONG W R,et al.Deep sequencing-based transcriptome profiling analysis of bacteria-challenged Lateolabrax japonicus reveals insight into the immune-relevant genes in marine fish[J].BMC genomics,2010,11(1):1-21.
[31] WANG L K,FENG Z X,WANG X,et al.DEGseq:An R package for identifying differentially expressed genes from RNA-seq data[J].Bioinformatics,2010,26(1):136-138.

