不同产地苦瓜干抗氧化活性成分比较分析
李盼盼 纪宝玉 裴莉昕 何江龙 李秀清 娄玉霞 董诚明 陈随清


摘 要:測定10批苦瓜干所含的主要成分含量以及抗氧化活性,并采用傅里叶变换红外光谱法对苦瓜干进行红外光谱分析,为控制苦瓜干质量、保证其安全使用和后期开发利用提供理论支持。使用硝酸铝显色法、福林酚法和二硝基水杨酸法测定总黄酮、总酚和还原糖含量,并运用1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力法及总抗氧化能力法测定苦瓜干的抗氧化活性。10批苦瓜干的成分含量有所不同,总黄酮、总酚、还原糖含量(w)最高,分别为1.84、5.24、9.00 mg·g-1;苦瓜干对DPPH+自由基均有清除作用,IC50值最佳为3.42 mg·mL-1;苦瓜干的总抗氧化能力最高,为192.02 μg·g-1。苦瓜干粉末的红外光谱图的主要吸收峰均在3290、2920、1740、1610、1370、1230、1020 cm-1附近。苦瓜干富含黄酮、总酚、还原糖成分,一维红外光谱和二阶导数光谱的结合可为苦瓜干的识别分析提供科学数据,有助于苦瓜干的整体质量控制以及有效成分定性分析。
关键词:苦瓜干;含量测定;抗氧化活性;傅里叶变换红外光谱
中图分类号:S642.5 文献标志码:A 文章编号:1673-2871(2024)05-064-07
Comparative analysis of antioxidant active components in dried bitter gourd from different habitats
LI Panpan1, JI Baoyu1, 2, 3, PEI Lixin1, 3, HE Jianglong1, LI Xiuqing1, LOU Yuxia1, DONG Chengming1, 2, CHEN Suiqing1, 3
(1. School of Pharmacy, Henan University of Traditional Chinese Medicine, Zhengzhou 450046, Henan, China; 2. Henan Provincial Herbal Ecological Planting Engineering Technology Research Center, Zhengzhou 450046, Henan, China; 3. Henan Key Laboratory of TCM Resources and Chemistry, Zhengzhou 450046, Henan, China)
Abstract: The main components content and antioxidant activity of 10 groups dried bitter gourd from different habitats were determined, and the dried bitter gourd was analyzed by Fourier transform infrared spectroscopy, which provided theoretical support for controlling the quality of dried bitter gourd, ensuring its safe use and later development and utilization. In this experiment, the content of total flavonoids, total phenols and reducing sugars were determined by aluminum nitrate chromogenic method, folin phenol method and dinitrosalicylic acid method, and the antioxidant activity of dried bitter gourd was determined by 1,1-diphenyl-2-trinitrophenylhydrazine (DPPH)radical scavenging ability and iron ion reducing ability(FRAP)method. The content of total flavonoids, total phenols and reducing sugar in dried bitter gourd were 1.84, 5.24 and 9.00 mg·g-1, respectively. The dried bitter gourd can scavenge DPPH+, and the best IC50 value is 3.42 mg·mL-1. The highest total antioxidant capacity of dried bitter gourd was 192.02 μg·g-1. The main absorption peaks of the infrared spectrum of the dry powder of bitter gourd are all around 3290, 2920, 1740, 1610, 1370, 1230 and 1020 cm-1. The dried bitter gourd is rich in flavonoids, total phenols and reducing sugars. The combination of one-dimensional infrared spectrum and second derivative spectrum can provide scientific data for the identification and analysis of dried bitter gourd, which is helpful for the overall quality control and qualitative analysis of effective components.
Key words: Dried bitter gourd; Content determination; Antioxidant activity; Fourier transform infrared spectroscopy
苦瓜干源于葫芦科植物苦瓜除去种子后干燥近成熟的果实,性寒味苦[1],具有消暑、清热、利尿、增进食欲、帮助消化等多种功效[2]。苦瓜又名凉瓜、锦荔枝、癞葡萄等,属一年生蔓生草本植物,果实一般为长圆形或纺锤形,表面有丘疹,与黄瓜很相似[3]。我国各地均有栽培,以南方省份居多。现代研究表明,苦瓜含有丰富的苦瓜苷、多糖、氨基酸、蛋白质、纤维素和维生素等物质,且富含Ca、K、Na、Mg、Fe、P等多种矿物质[4],具有抗氧化、提高免疫力等多种生物活性[5-6],有独特的保健价值。
红外光谱检测方法通过获取多种分子键及官能团信息、光谱吸收峰位置及强度,从而对多种物质成分进行定性定量分析,具有操作简单、分析快速、灵敏度高、无损、无污染等优势,在中药材及食品真伪鉴别、产地鉴别、含量检测等领域成为研究热点[7-8]。胡子康等[9]利用红外光谱结合化学计量学的方法,对中药材杜仲进行了真伪鉴别;敖冬梅等[10]采用傅里叶变换红外光谱(FTIR)结合聚类分析法,建立了一种快速、无损地对不同产地灰毡毛忍冬药材进行产地区分的聚类分析模型;顾旭鹏等[11]通过高效液相色谱法结合傅里叶变换红外光谱技术,建立金银花有效成分的含量测定模型,为金银花含量的快速、精准测定提供了新方法。
苦瓜作为传统的药食同源瓜果被广泛关注。目前,对苦瓜的研究主要集中于育种栽培[12-13]、吸收元素[14]及干燥方式[15]等方面,对其化学成分和活性的研究较少,故对苦瓜质量的整体性判断显得较为重要。笔者主要采用傅里叶变换红外光谱法对苦瓜干进行定性分析,并对苦瓜干所含主要活性成分含量以及抗氧化活性进行测定分析,为苦瓜干的整体质量控制以及有效成分定性分析研究提供理论依据和数据参考。
1 材料与方法
1.1 材料
10批苦瓜干供试样品为采集或购买,经河南中医药大学纪宝玉教授鉴定均为葫芦科植物苦瓜的干燥近成熟果实,样品来源信息见表1。试验于2022年6月在河南中医药大学药学院生药鉴定与技术实验室进行。
1.2 仪器与试剂
芦丁标准品、没食子酸标准品、葡萄糖标准品来自上海源叶生物科技有限公司;无水乙醇、甲醇(AR)来自天津市富宇精细化工有限公司;NaNO2(AR)来自天津市风船化学试剂科技有限公司;Al(NO3) 3(AR)来自天津市天力化学试剂有限公司;NaOH(AR)来自郑州派尼化学试剂厂;福林酚(AR)來自北京索莱宝科技有限公司;无水碳酸钠(AR)来自天津市凯通化学试剂有限公司;3,5-二硝基水杨酸(DNS)(AR)来自西安道生化工科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)来自上海思域化工科技有限公司;2,4,6-三吡啶基三嗪(TPTZ)来自上海喜垣生物科技有限公司;三氯化铁(FeCl3)来自昌邑宏达化工有限公司。
电子分析天平 FA2004N-01156来自上海民桥精密科学仪器有限公司;高速冷冻离心机JW-3021HR来自安徽嘉文仪器装备有限公司;多功能微孔板读数仪来自河南德信汇仪器设备有限公司;傅立叶变换红外显微系统来自布鲁克科技有限公司。
1.3 方法
1.3.1 供试品溶液的制备 精确称取10批苦瓜干粉末(过3号药典筛)1.00 g,加无水乙醇溶液20 mL,超声处理30 min(功率为500 W,频率为80 kHz),冷却至室温,补足缺失,过滤,装于1.5 mL试管中为供试品溶液。
1.3.2 总黄酮含量的测定 采用亚硝酸钠-硝酸铝显色法测定10批苦瓜干的总黄酮含量[16],稍作优化:分别取1.3.1中供试液290 μL,加入250 μL 70%乙醇和30 μL 5% NaNO2,静置6 min,加入30 μL 10% Al(NO3)3后再次静置6 min,加入400 μL 10% NaOH,摇匀,静置15 min,在510 nm波长处测定其吸光度。以芦丁为标准品,绘制标准曲线,得芦丁回归方程:y=0.838 6x+0.051 1,R?=0.999 7;芦丁标准溶液质量浓度在31.25~1000 μg·mL-1范围内,吸光度与质量浓度呈良好线性关系。通过芦丁标准曲线计算出各样品的总黄酮含量,单位为mg·mL-1。
1.3.3 总酚含量的测定 采用Folin-Ciocalteu法测定10批苦瓜干样品的总酚含量[17],稍作优化:分别取1.3.1中供试液50 μL,加入蒸馏水50 μL,加入500 μL 10%福林酚试剂,混匀后静置6 min,随后加入400 μL 7.5% Na2CO3溶液,混匀后避光静置40 min,在765 nm波长处测定其吸光度。以没食子酸为标准品,绘制标准曲线,得没食子酸回归方程:y=5.491 0 x+0.073 8,R?=0.999 8;没食子酸标准溶液质量浓度在25~150 μg·mL-1范围内,吸光度与质量浓度呈良好线性关系。通过没食子酸标准曲线计算出各样品的总酚含量,单位为mg·mL-1。
1.3.4 还原糖含量的测定 采用蔡锦源等[18]的方法测定10批苦瓜干样品的还原糖含量。稍作优化:分别取1.3.1中供试液0.10 mL,加入0.20 mL DNS试剂和0.4 mL蒸馏水,混匀,沸水浴5 min显色,冷却至室温,加蒸馏水3.3 mL,在540 nm 波长处测定其吸光度。以葡萄糖为标准品,绘制标准曲线,得葡萄糖回归方程:y=1.028 6 x-0.005 2,R?=0.999 2;葡萄糖标准溶液质量浓度在80~480 μg·mL-1范围内,吸光度与质量浓度呈良好线性关系。通过葡萄糖标准曲线计算出各样品的还原糖含量,单位为mg·mL-1。
1.3.5 DPPH+清除能力测定 分别精密吸取供试品溶液20、40、60、80、100 ?L加水稀释至500 ?L成为质量浓度为1.6、3.2、4.8、6.4、8.0 mg·mL-1的样品溶液,加入等体积0.1 mmol·L-1 DPPH·无水乙醇溶液摇匀,于30 ℃条件下避光反应30 min,观察颜色变化,并在517 nm下以无水乙醇为空白对照,测定吸光度值As,同时以无水乙醇代替样品溶液,于517 nm处测定吸光度(Ab),以维生素C为阳性对照[19]。
DPPH+清除率=(Ab-As)/Ab×100%;
注:式中Ab为空白样品吸光度值;As为样品吸光度值。
采用IBM SPSS Statistics建立回归方程,选择DPPH+清除率为50%时对应的浓度即为 IC50值。
1.3.6 总抗氧化能力的测定 将10 mmol·L-1的TPTZ溶液、20 mmol·L-1的FeCl3溶液和300 mmol·L-1的醋酸钠缓冲溶液(pH =3.6)按体积比1∶1∶10混合得到FRAP溶液[20],然后精确称取维生素C标准品,使用超纯水溶解后定容至1 mL,得10 μg·μL-1的维生素C储备液,以水为溶剂将储备液分别稀释至0.5、1.0、1.5、2.0、2.5、3.0 μg·μL-1得工作液。分别精确吸取30 ?L工作液并加入900 ?L FRAP(铁离子抗氧化能力)工作液与90 ?L去离子水,混匀后于593 nm下测吸光度。以吸光度为纵坐标,以对应的标准品浓度为横坐标制成维生素C标准曲线,同法测定10批苦瓜干供试品溶液总抗氧化能力。根据标准曲线求得与供试品相同吸光度值下的样品浓度。苦瓜干的总抗氧化能力用标准物质维生素C溶液的浓度来表示。
FRAP(μg·g-1)=[cVtm]。
注:式中c—表示维生素C溶液样品质量浓度,单位为mg·mL-1;t—表示稀释倍数;m—表示苦瓜干粉末质量,单位为g;V—表示样品体积,单位为mL。
1.3.7 红外光谱采集 取适量苦瓜干样品粉末(过药典5号筛),置于SMART ITR附件的金刚石表面,旋转附件旋钮将样品粉末固定,利用傅里叶变换红外光谱仪得到相应的红外光谱图[21],该傅里叶变换红外光谱仪的光谱范围400~4000 cm-1,分辨率4 cm-1,一个样扫描30次,扫描累加次数300次,扫描时扣除CO2的干扰[22]。
1.4 数据处理与统计分析
测定的数据均独立进行3次重复试验;采用Excel进行数据统计和初步处理;运用Excel和Origin Pro 2021软件进行绘图分析;利用SPSS 26.0进行差异显著性分析和聚类分析。
2 结果与分析
2.1 苦瓜干中总黄酮、总酚、还原糖含量
由表2可知,10批苦瓜干提取物中所含的总黄酮、总酚、还原糖含量有所不同。10批苦瓜干总黄酮含量(w,后同)均大于0.75 mg·g-1,其中KGG-2总黄酮含量最高,为1.84 mg·g-1,KGG-6总黄酮含量最低,为0.79 mg·g-1;10批苦瓜干中KGG-1与KGG-5,KGG-3与KGG-7、KGG-8、KGG-10,KGG-4与KGG-8、KGG-9、KGG-10之间总黄酮含量差异均不显著,其他处理间差异显著。10批苦瓜干总酚含量均大于3.00 mg·g-1,其中KGG-3总酚含量最高,为5.24 mg·g-1,KGG-5总酚含量最低,为3.34 mg·g-1;10批苦瓜干中KGG-1与KGG-5、KGG-6、KGG-8及KGG-10,KGG-5与KGG-6,KGG-4与KGG-8、KGG-9、KGG-10之间总酚含量无显著差异,其他处理间差异显著。10批苦瓜干还原糖含量均大于3.50 mg·g-1,其中KGG-2还原糖含量最高,为9.00 mg·g-1,KGG-6还原糖含量最低,为3.53 mg·g-1;10批苦瓜干中KGG-1与KGG-10,KGG-3与KGG-4、KGG-5,KGG-4与KGG-5、KGG-10,KGG-8与KGG-9之间还原糖含量差异不显著,其他处理间差异显著。
2.2 苦瓜干提取物抗氧化活性
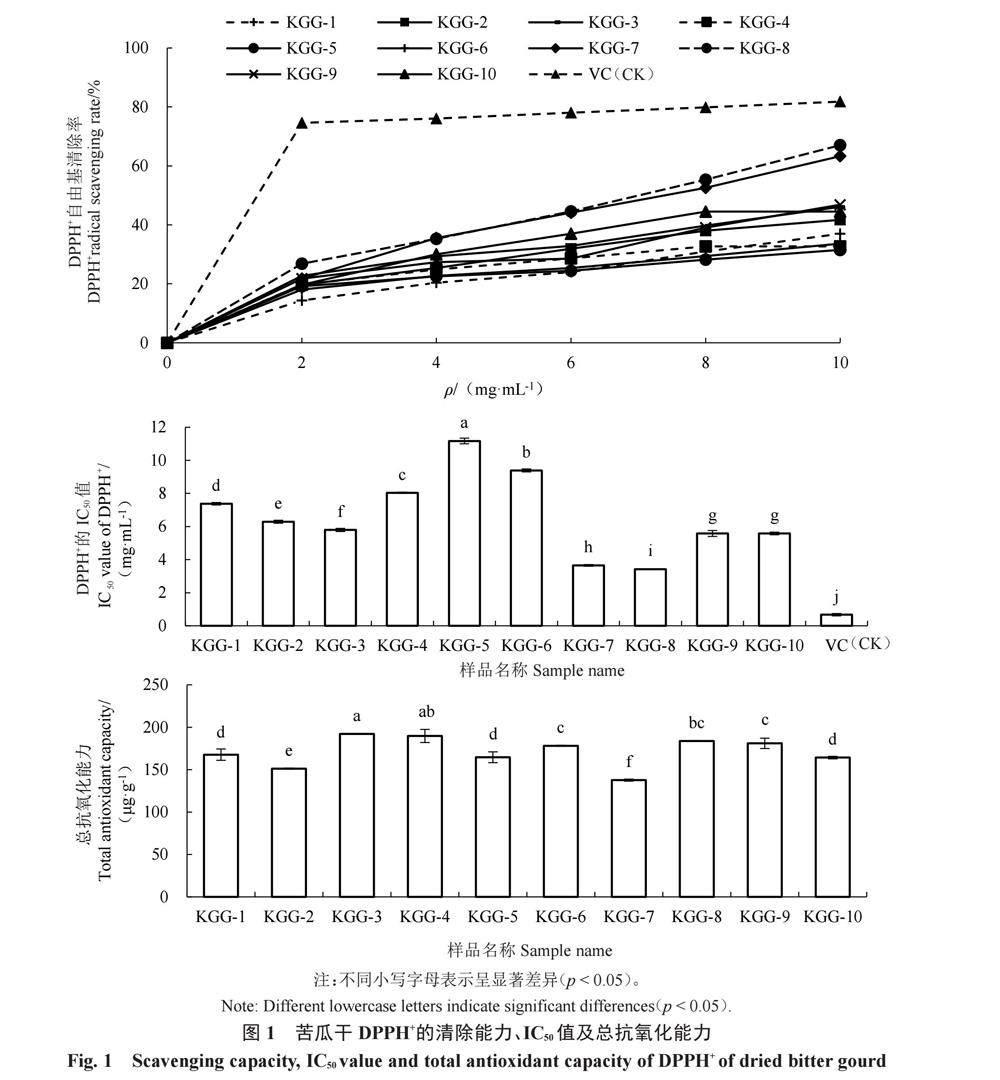
10批苦瓜干提取物DPPH+清除能力及总抗氧化能力测定结果见图1。10批苦瓜干提取物对DPPH+均有一定的清除能力,且在一定范围内呈剂量依赖性,DPPH+的半数清除率(IC50)越低,抗氧化性越高[23]。其中KGG-5的DPPH+清除率最低,IC50值最大,为11.17 mg·mL-1,KGG-8的DPPH+清除率最高,IC50值最小,为3.42 mg·mL-1;10批苦瓜干中除KGG-9与KGG-10间IC50值无显著差异外,其他处理间IC50值存在显著差异。10批苦瓜干提取物均具有一定的抗氧化能力,其中KGG-3的总抗氧化能力最强,为192.02 μg·g-1,KGG-7的总抗氧化能力最弱,为137.57 μg·g-1;10批苦瓜干中KGG-1与KGG-5、KGG-10,KGG-3与KGG-4,KGG-4与KGG-8,KGG-6与KGG-8、KGG-9,KGG-8与KGG-9之间总抗氧化能力无显著差异,其他處理间差异显著。
2.3 苦瓜干红外光谱分析
按照1.3.6的试验方法,分别对10批苦瓜干粉末进行采集和测定,各样品红外光谱叠加见图2。结果表明,苦瓜干在400~4000 cm-1区域内图谱振动特征总体相似,化学成分吸收峰较多。苦瓜干的红外图谱中主要吸收峰均在3290、2920、1740、1610、1370、1230、1020 cm-1附近。其中,3200~3400 cm-1附近的强宽吸收峰为分子间氢键O-H伸缩振动吸收峰[24-25],提示苦瓜干中含有大量多羟基的糖类、糖类衍生物及有机酸类化合物;2920 cm-1附近为C-H伸缩振动吸收峰[26];1740 cm-1附近是C=O伸缩振动峰,可能为黄酮成分特征吸收峰;1610 cm-1附近吸收峰为多种物质的叠加峰,主要为多糖类、苷类物质的O-H弯曲振动吸收峰,或者含有C=O伸缩振动峰,可能存在黄酮等化合物中的不饱和C-C键的吸收峰;1370 cm-1附近为甲基的δC-H对称弯曲振动峰;1020 cm-1及其两侧肩峰为多个峰重叠而成的宽强峰,多归属为多糖、苷类物质中C-O弯曲振动峰[27]。
二阶导数红外光谱见图3,与一维红外光谱相比,可以提高光谱图的表观分辨率,放大红外光谱图的微小差异,重叠的吸收峰可分开,呈现出许多被掩盖谱峰的特征,使一些特征谱带间的差异更明显。在600~1800 cm-1范围内提取平均红外光谱进行分析,通过苦瓜干的二阶导数光谱发现1740、1610、1370、1230、1020 cm-1吸收峰,在二阶导数光谱中仍然存在。同时通过提高分辨率发现,1650、1600、1510、1440、1310、1100、1050、960、830、670 cm-1的峰也被剥离出来。1610 cm-1被细分为1650和1600 cm-1,表明苦瓜干富含多种黄酮类成分。其中,KGG-2、KGG-3、KGG-5、KGG-6及KGG-7在此波段的吸收峰较其他批的苦瓜干略强;1510 cm-1吸收峰在10批苦瓜干红外光谱中位置、形状差异较大;在800~1100 cm-1区域内的吸收峰有明显差异,KGG-2在1050 cm-1附近的吸收峰较其他批次苦瓜干峰形强且尖锐;KGG-2及KGG-3在860及830 cm-1出现明显吸收峰,而其他批苦瓜干只在830 cm-1出现明显吸收峰。综上可知,在分辨率更高的二阶导数光谱上,可以清晰地看到10批苦瓜干吸收峰的特征大体相同,但存在差异性。
2.4 不同产地苦瓜干的聚类分析
聚类分析在中药质量控制、品种分类等方面被广泛使用,可以大概区分品质性状的综合表现[28]。基于10批苦瓜干的3个成分含量、抗氧化能力指标,利用SPSS软件采取组间联接法进行聚类分析,见图4。当欧氏距离为5时,10批苦瓜干可大致分为3类。其中,第I类有2批,分别为KGG-2、KGG-7,总黄酮、还原糖及总酚含量较高,且DPPH+自由基清除率较高,总抗氧化能力弱;第II类有3批,分别为KGG-5、KGG-1、KGG-10,总黄酮、还原糖含量中等,总酚含量相对较少,抗氧化能力较弱;第III类有5批,分别为KGG-3、KGG-4、KGG-6、KGG-8、KGG-9,总黄酮、还原糖、总酚含量相对较高,且DPPH+自由基清除率较低,总抗氧化能力强。
3 讨论与结论
苦瓜作为天然产物,生存环境条件差异会导致某些化学成分含量不同。已有研究表明,苦瓜中含有多糖类、黄酮类、蛋白质类、酚类、皂苷类、生物碱、不饱和脂肪酸等活性成分[29-30]。现代研究表明,自由基具有维持细胞正常代谢、抑制有害病毒和细菌的作用。但体内自由基过多会导致细胞和组织器官损伤,诱发各种疾病,加速机体衰老[31]。抗氧化剂能有效清除自由基,阻断氧化反应,从而起到预防疾病和延缓衰老的作用,而人工合成的抗氧化剂具有一定的潜在毒性,故寻找天然、安全的抗氧化剂逐渐成为现代研究热点之一[32-33]。张红梅等[34]评价了不同果色苦瓜在果实发育期的抗氧化能力,同时比较分析了25个不同品种(系)苦瓜功能性成分与苦瓜总抗氧化能力的相关性[35],与本研究结果大致一致。
笔者通过比较10批苦瓜干的抗氧化活性成分含量和抗氧化活性能力等指标,发现10批苦瓜干中总黄酮、总酚、还原糖含量稳定,最高分别可达到1.84、5.24、9.00 mg·g-1;10批苦瓜干均具有DPPH+清除能力和总抗氧化能力,IC50值最佳为3.42 mg·mL-1;苦瓜干的总抗氧化能力最高为192.02 μg·g-1。红外光谱技术具有类似于指纹特征的综合分析优势,常用于各种组分谱峰叠加及组分间相互作用复杂的中药材质量评价。笔者利用红外光谱技术对10批苦瓜干进行了分析与比较,将红外光谱与二阶导数光谱结合寻找到专属于苦瓜干的红外吸收特征峰,对苦瓜干的化学成分分布递进式地进行分析,获得了苦瓜干的整体结构信息,验证了其所含物质含量的差异性。为日后苦瓜干真伪鉴别和品质评价提供了科学依据,也为苦瓜干的质量标准制定积累了重要的试验数据。
参考文献
[1] 谷俊华,肖付才.基于热风干燥温度的苦瓜片干燥动力学及其品质探究[J].开封大学学报,2022,36(1):87-93.
[2] 胡献国.药食两用说苦瓜[J].家庭医学,2021(7):53.
[3] 张志慧,苏秀兰.苦瓜提取物生物活性及临床应用前景[J].中国组织化学与细胞化学杂志,2021,30(1):95-101.
[4] 谷俊华,黄斐.不同热风干燥温度对苦瓜干品质的影响[J].安徽农业科学,2017,45(16):86-88.
[5] 吴平,王成,王哲,等.响应面优化表面活性剂协同微波提取苦瓜黄酮工艺[J].中国食品添加剂,2018(2):98-104.
[6] 刘宏强,孔兰青,王春仙.苦瓜降糖作用试验分析研究[J].现代食品,2017,3(5):96-97.
[7] 汤琴.不同干制方式苦瓜茶的品质差异及其“降火”相关活性[D].武汉:华中农业大学,2014.
[8] KUMAR R,BALAJI R,SRIPRIYA R,et al.In vitro evaluation of antioxidants of fruit extract of Momordica charantia L.on fibroblasts and keratinocytes[J].Journal of Agricultural and Food Chemistry,2010,58(3):1518-1522.
[9] 胡子康,劉庭恺,饶艳敏,等.近红外光谱结合化学计量学的掺伪杜仲判别[J].化学试剂,2023,45(10):1-7.
[10] 敖冬梅,徐荣,李曼钿,等.不同产地灰毡毛忍冬的傅里叶变换红外光谱与聚类分析[J].中华中医药杂志,2023,38(9):4124-4128.
[11] 顾旭鹏,杨林林,齐大明,等.傅里叶变换红外光谱技术对金银花中有效成分定量模型建立及含量测定[J].光谱学与光谱分析,2024,44(2):467-473.
[12] 麻继仙,木万福,杜康华,等.云南干热区前茬收获后免耕对苦瓜杂交制种效果的影响[J].热带农业科学,2023,43(12):1-4.
[13] 卢盼玲,金海军,张咏雪,等.不同有机肥处理对土壤特性及苦瓜生长和品质的影响[J].江西农业学报,2023,35(10):34-38.
[14] 李婉豫,田丽波,商桑,等.不同氮、钾用量对嫁接苦瓜养分吸收、分配及产量的影响[J].热带作物学报,2021,42(10):2881-2889.
[15] 邓媛元,汤琴,张瑞芬,等.不同干燥方式对苦瓜营养与品质特性的影响[J].中国农业科学,2017,50(2):362-371.
[16] 杨永涛.罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D].广州:华南理工大学,2018.
[17] 程啟斌,李石飞,张立伟.连翘不同部位总酚含量测定及抗氧化活性比较研究[J].化学研究与应用,2016,28(5):610-616.
[18] 蔡锦源,熊建文,黄燕芬,等.白及多糖的超声-微波协同提取工艺及其抗氧化活性研究[J].食品工业科技,2016,37(22):274-278.
[19] 葛思琪,赵庆生,孙广利,等.芦笋总皂苷的提取纯化及抗氧化研究[J].食品研究与开发,2018,39(20):57-62.
[20] BENZIE I F F,STRAIN J J.The ferric reducing ability of plasma(FRAP)as a measure of“antioxidant power”:The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[21] 司雨柔,高韵,解玫莹,等.不同产地桔梗的红外光谱整体成分鉴别研究[J].化学试剂,2021,43(2):210-215.
[22] 陈前锋,侯鹏,刘巧,等.红外光谱法快速鉴别不同产地中药党参的研究[J].西南大学学报(自然科学版),2016,38(6):188-194.
[23] 张婷,姜海慧,冯石卜,等.山茱萸果核不同产地间的抗氧化活性研究[J].陕西中医药大学学报,2023,46(2):23-26.
[24] 刘春阳,白金波,杨尚青,等.枳椇子多糖的酸提取工艺优化及其理化性质与抗氧化活性研究[J/OL].食品与发酵工业,[2023-06-01].https: //doi.org/10.13995/j.cnki.11-1802/ts.035439.
[25] 高韵,司雨柔,王元媛,等.不同产地、不同种属黄精的红外光谱鉴别研究[J].化学试剂,2020,42(3):275-279.
[26] 高凡,丁宁,艾连中,等.百香果高酯果胶-酚酸衍生物的分子特征、体外抗氧化和免疫活性[J].食品科学,2022,43(17):84-94.
[27] 刘江,徐元江,吉哈利,等.藏产卷叶黄精和轮叶黄精的红外光谱鉴别[J].高原农业,2018,2(4):342-346.
[28] 孟岩,李焐仪,单家明,等.不同产地大黄药材中13种活性成分含量测定及其HPLC-FP研究[J].江西中医药大学学报,2022,34(2):76-83.
[29] 刘馨泽,吴新民,蔺冬梅,等.苦瓜化学成分的提取分离及药理活性研究进展[J].中成药,2022,44(1):177-182.
[30] 赖婷.苦瓜中主要活性物质及其生理功能的研究进展[J].食品安全导刊,2020(9):87.
[31] PHANIENDRA A,JESTADI D B,PERIYASAMY L.Free radicals:Properties,sources,targets,and their implication in various diseases[J].Indian Journal of Clinical Biochemistry,2015,30(1):11-26.
[32] 崔剑,李兆陇,洪啸吟.自由基生物抗氧化与疾病[J].清华大学学报(自然科学版),2000,40(6):9-12.
[33] 陈玉霞,刘建华,林峰,等.DPPH和FRAP法测定41种中草药抗氧化活性[J].实验室研究与探索,2011,30(6):11-14.
[34] 张红梅,崔佳维,余纪柱,等.果实发育期对不同果色苦瓜营养成分含量及抗氧化能力的影响[J].江西农业学报,2022,34(3):179-184.
[35] 张红梅,金海军,余纪柱,等.不同苦瓜品种营养和功能成分含量及总抗氧化能力比较[J].分子植物育种,2022,20(3):967-976.

