HPLC法测定不同产地爬山虎茎中白藜芦醇的含量
鲍慧玮++侯晓琳++刘芳馨++张晨++刘佳

【摘要】目的:建立一种测定爬山虎茎中白藜芦醇含量的方法,并对不同产地的爬山虎进行测定。方法:使用Agilent TC-C18柱(4.6mm×250mm,5μm);流动相:甲醇-水(45∶55);柱温:35℃;体积流速:1mL/min;检测波长:290nm;进样量均为10μL。结果:爬山虎中白藜芦醇的进样量在0.002168~0.03252mg/mL范围内呈良好的线性关系,平均回收率为101.2%,RSD值为0.84%,且精密度、稳定性、重复性均良好。结论:该方法可以精密、快速、稳定和高效的测定爬山虎中白藜芦醇的含量。
【关键词】爬山虎茎;白藜芦醇;含量测定;HPLC
【中图分类号】R284.2【文献标志码】 A【文章编号】1007-8517(2016)21-0017-03
Determination of Resveratrol in Different Areas of Boston Ivy Stem by HPLC
BAO HuiweiHOU XiaolinLIU FangxinZHANG ChenLIU Jia*
Changchun University of Chinese Medicine, Changchun 130117, China
Abstract: Objective To establish a method for the determination resveratrol in Boston ivy stem in different places. Methods The chromatographic column: Agilent TC-C18 (4.6mm×250mm, 5μm); The mobile phase: methanol-water(45∶55); The column temperature: 35℃; The volumetric flow rate: 1mL/min; The UV detector was set at 290nm; The sample size: 10μL. Results Resveratrol showed good liner relation when the content was during 0.002168mg/mL~0.03252mg/mL in the samples, the average recovery was 101.2%, RSD=0.84%, good stability, precision and repeatability; Conclusion This method can determine the contents of trans-resveratrol in Boston ivy stem, it is fast, accurate and stable.
Keywords:Boston Ivy Stem; Resveratrol;Content Determination; HPLC
爬山虎(Parthenocissus tricuspidata S. Z.)系葡萄科爬山虎属落叶多年生多分枝木质大藤本,又名地锦、爬墙虎[1-2]。爬山虎茎长10~30m,枝端卷须可发育成粘性吸盘有很强的吸附、攀援能力,可攀援光滑的墙壁和裸露的岩石[3],具有良好的生态适应性,是装饰墙壁、 假山的园林植物。近年来,人们对其黏附、繁殖以及绿化方面的研究较多,其同样具有良好的药效作用,如在抑菌[4]、抗氧化[5]等方面。爬山虎中药用活性成分较多,包括多糖、红色素、多酚类、黄酮类成分等,其中白藜芦醇在抗血栓[6]、抗肿瘤[7]、改善和治疗心血管疾病中起着重要的作用[8-10],其结构见图1,且白藜芦醇在自然界中更加稳定,药效较顺式更强,从爬山虎中分离白藜芦醇也成为其获得方法之一[11]。鉴于爬山虎较高的药用价值,却缺少质量控制方法,本研究利用HPLC法建立一种测定爬山虎中白藜芦醇的方法,以评价不同产地的爬山虎[12]。
1仪器与材料
1.1仪器安捷伦1260型液相色谱仪(美国安捷伦有限公司);AVW20D型电子天平(日本岛津制作所);RE 52-99旋转蒸发器(上海亚荣生化仪器厂);KQ-400KDE型超声波清洗器(昆山市超声仪器有限公司)。
1.2材料反式白藜芦醇对照品(批号:111535-200502,中国药品生物制品检定所);甲醇(色谱纯,美国FISHER公司),乙醇、乙酸乙酯、氯仿、二氯甲烷、石油醚(分析纯,北京化工厂),水(纯净水,杭州娃哈哈集团有限公司)。样品经长春中医学院李波老师鉴定为葡萄科爬山虎属落叶多年生多分枝木质大藤本植物爬山虎茎(Parthenocissus tricuspidata S. Z.),来源及批号见表1。
2方法与结果
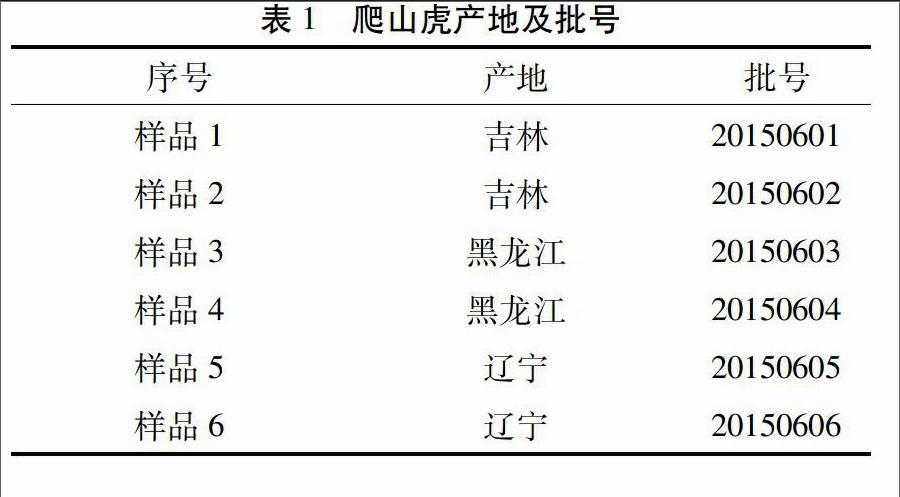
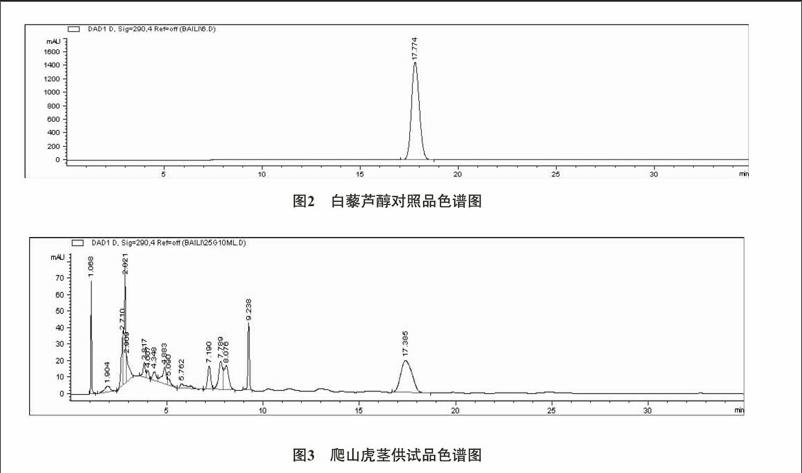
2.1色谱条件与系统适应性试验[7] 色谱柱:Agilent TC C18柱(4.6mm×150mm,5μm);流动相:甲醇-水(45∶55);柱温:35℃;体积流速:1mL/min;检测波长为290nm;进样量均为10μL。理论塔板数按白藜芦醇计算均不低于1500。在此条件下,白藜芦醇与其他物质分离度均符合药典规定,白藜芦醇标准品和爬山虎茎供试品色谱图见图2、图3。
2.2对照品溶液的配制精密称取白藜芦醇对照品10.22mg,置1000mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,制备成0.01022mg/mL的白藜芦醇对照品溶液。
2.3供试品溶液的配制将干燥的爬山虎茎粉碎,过60目筛,精密称定10.5g,加200mL的乙酸乙酯超声提取约20min,过滤,在药渣中加入200mL乙酸乙酯超声提取约20min,过滤,并用200mL乙酸乙酯洗涤药渣,合并乙酸乙酯提取液,旋蒸60℃蒸干,用色谱甲醇溶解并用定容于10mL容量瓶中。
2.4线性关系考察精密称取白藜芦醇对照品10.84mg,置100mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,分别吸取0.2、0.6、1、1.5、2、3ml,置于10mL容量瓶中,用甲醇定容至刻度,摇匀。即浓度为0.002168、0.006504、0.01084、0.01626、0.02168、0.03252mg/mL的线性关系对照品溶液。按照“2.1”方法,分别注入高效液相色谱仪,记录色谱峰面积。以色谱峰面积(Y)对溶液浓度(X)作图,得到白藜芦醇的回归方程为Y=31552X+6.2003,r=0.9995(n=6),表明白藜芦醇在0.002168~0.03252mg范围内呈良好的线性关系。
2.5精密度试验按照“2.1”项下方法分别精密吸取对照品溶液和爬山虎供试品溶液(批号为20150801)各10μL,重复进入高效液相色谱仪6次,测得白藜芦醇对照品和供试品色谱峰面积的RSD值分别为1.79%和1.82%,结果表明此方法精密度良好。
2.6稳定性考察分别在0、2、4、6、8、10、12、24h时,按照“2.1”项下方法分别精密吸取对照品溶液和爬山虎茎供试品溶液(批号为:20150601)10μL,依次进样,测得白藜芦醇对照品和爬山虎供试品色谱峰面积的RSD值分别为1.65%和1.01%(n=8),结果表明供试品溶液中白藜芦醇和对照品在24h内稳定。
2.7重复性实验取爬山虎茎供试品(批号:20150601)6份,每份约10g,精密称定,按“2.3”项下制备供试品溶液,依法进行含量测定,测得白藜芦醇色谱峰面积,并计算出其含量的RSD值为1.95%,结果表明此方法重复性良好。
2.8加样回收率实验取白藜芦醇对照品6份,每份约10mg,定容至100mL容量瓶中,吸取0.5mL,分别加入6份约5g的爬山虎茎供试品(批号:20150601),按“2.3”项下制备供试品溶液,并进行含量测定,计算回收率。结果白藜芦醇的平均回收率为101.2%,RSD值为0.84%(n=6),表明此方法回收率良好。结果见表2。
2.9样品测定取不同产地爬山虎样品,按照“2.3”项下制备供试品溶液,分别精密吸取“2.2”项下对照品溶液和供试品溶液,注入液相色谱仪器中,依法进行含量测定,记录色谱峰面积,并按照外标法计算供试品中白藜芦醇的含量。结果见表3。
3讨论
3.1提取方法的考察分别考察超声提取法、回流提取法对爬山虎中白藜芦醇的提取,发现两种方法均有很好的提取效果。但是回流提取法需要提取时间较长,且其液相色谱图杂质峰较多,故选取超声提取法对爬山虎进行提取。通过对比甲醇、乙醇、乙酸乙酯、氯仿、二氯甲烷、石油醚等试剂对爬山虎的提取结果,发现除石油醚外,提取效果均很好,但其中乙酸乙酯色谱图中干扰主峰的杂质最少,最利于白藜芦醇的分离和测定。
3.2流动相的考察选择甲醇-水和乙腈-水体系对白藜芦醇进行分离,不断的改变有机相和水相的比例,最终确定甲醇-水(45∶55)为最佳分离比例,可将白藜芦醇和其它物质很好的分离开,且分离时间较短,峰形良好。
3.3检测波长的考察因爬山虎茎中成分极其复杂,故通过二极管全波长阵列检测器对供试品在190~400nm波长下进行分析,发现在290nm下,白藜芦醇吸收较好,且在此波长下其与爬山虎中其它组分分离度良好。
爬山虎虽然是一种具有良好药效的药材,但人们往往对于其爬墙能力方面研究较多,对于其药用价值方面研究较少。通过对其成分的分离,发现其中含有较高含量的白藜芦醇。白藜芦醇具有良好的抗肿瘤活性和治疗心血管疾病等药效作用,来近些年来备受人们关注,市场的需求也日益增加。由于爬山虎价格低廉,且生长速度极其迅速,从爬山虎茎中提取、分离反式白藜芦醇也是一种可行的方法。白藜芦醇的含量直接影响其质量,故测定其中白藜芦醇的含量非常重要。本研究建立了一种精密、快速、稳定、高效的HPLC测定方法,测定不同产地爬山虎茎中白藜芦醇的含量,建立了一种可靠的质量评定方法,此方法为其质量控制奠定了研究基础。
参考文献
[1] 张毅功,陆诗雷,孙振元,等.爬山虎属植物利用研究[J].资源科学,2005,27(5):141-145.
[2] 李倩,李娜,巩江,等.爬山虎属植物药学研究进展[J].安徽农业科学,2011,39(14):83-85.
[3] YANG J B, WANG A G, JI T F, et al. Chemical constituents from Parthenocissus quinquefolia [J]. Zhongguo Zhong Yao Za Zhi, 2010, 35(12):1573-1576.
[4] 董爱文,陈建华,周辉,等.爬山虎多糖的提取及抑菌作用[J].广州食品工业科技,2003,14(3):15-17.
[5] 梁晓霞,尹恒,孔令茜,等.爬山虎多糖的体外抗氧化活性研究[J].天然产物研究与开发,2015,27(3):451-454.
[6] 闫启光.白藜芦醇抗血栓作用实验研究[J].中国民族民间医药,2010,19(13):58-59.
[7] 赵光,李珺,陈超阳.葡萄汁中抗肿瘤成分反式白藜芦醇含量的测定及其影响因素[J].中国民族民间医药,2015,24(9):19-21.
[8] 何山,吴斌,潘远江,等. 绿爬山虎中的菧类化合物研究[ J].分析试验室,2007,26(S1):10-11.
[9] CHEN J J, HE S, MAO H, et al. Characterization of polyphenol compounds from roots and stems of Parthenocissus laetevirens by high-performance liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2009, 32(6):737-744.
[10]HE S, JIANG L Y, WU B, et al. Two Novel Antioxidative Stilbene Tetramers from Parthenocissus laetevirens [J]. Helvetica Chimica Acta, 2009, 92(7):1260-1267.
[11] 张恒,高丽娟,王怡宁,等. 酶解法提取爬山虎根皮中白藜芦醇的工艺研究[J]. 湖北农业科学,2016,(2):449-452.
[12]游国叶,李光霞,黄传辉.HPLC法测定乳脂体中白藜芦醇的含量[J].亚太传统医药,2014,10(9):31-32.
(编辑:陶希睿)

