miR-185过表达对MPP+诱导帕金森病模型细胞损伤的影响及其机制
刘啸,张磊,陶伟
1 聊城市第二人民医院神经内科,山东聊城 252600;2 聊城市第二人民医院肿瘤内科
帕金森病(PD)是一种发病率仅次于阿尔茨海默病的神经退行性疾病,多发生于中老年人群[1]。PD 最主要的神经病理改变是中脑黑质致密部的多巴胺能神经元变性丢失和路易斯小体形成[2]。迄今为止,PD 的发病机制仍未完全阐明,临床尚不能完全治愈。有研究认为,多巴胺能神经元过度凋亡和氧化应激是PD 进展的重要原因[3]。因此,抑制多巴胺能神经元凋亡和氧化应激损伤有可能成为阻止PD 进展的有效措施。微小RNA(miRNA)是真核生物中广泛存在的一类内源性非编码单链小RNA 分子,可参与转录后基因表达的调控,在维持神经元存活及其正常功能中具有重要作用。有研究报道,多种miRNA 在PD 中异常表达[4-6]。miR-185 是miRNA家族成员之一。有研究报道,在PD 患者血清中miR-185 表达下调[7],在PD 大鼠中脑黑质和纹状体中也发现miR-185 表达降低[8]。但miR-185 在PD 发病中的分子机制尚不清楚。1-甲基-4-苯基吡啶离子(MPP+)能够引起神经细胞氧化应激损伤甚至凋亡,是目前最常用的PD 细胞模型诱导剂[9]。2022 年6月—12 月,本研究利用MPP+诱导PC12 细胞建立了PD细胞模型,并进一步探讨了miR-185过表达对PD细胞增殖、凋亡和氧化应激损伤的影响。现报告如下。
1 材料与方法
1.1 材料 大鼠PC12 细胞,购自中国科学院上海生命科学研究院细胞资源中心。MPP+,纯度≥98%,购自美国Sigma 公司。miR-185 模拟物(miR-185 mimics)、阴性对照模拟物(NC mimics)以及所有引物序列,购自生工生物工程(上海)股份有限公司。实时荧光定量PCR仪,购自美国ABI公司;多功能酶标仪,购自瑞士TECAN 公司;流式细胞仪,购自美国Thermo Fisher Scientific公司。PrimeScriptTMRT Master Mix、SYBR Premix Ex TaqTMⅡ,购自宝生物工程(大连)有限公司;CCK-8、Annexin V-FITC/PI 细胞凋亡检测试剂盒,购自武汉博士德生物工程有限公司;谷胱甘肽过氧化物酶(GSH)、超氧化物歧化酶(SOD)、丙二醛(MDA)ELISA 试剂盒,购自北京索莱宝科技有限公司。Bcl-2、Bax、GAPDH 一抗及HRP 标记的IgG二抗,购自美国Santa Cruz公司。
1.2 细胞传代培养 将PC12细胞从液氮罐中取出,在37 ℃水浴中快速复苏,然后接种于含10% FBS、1%青链霉素双抗的DMEM培养基,于37 ℃、5% CO2条件下培养。每隔2天更换一次培养基。待细胞生长融合至80%左右时,0.25%胰蛋白酶消化、计数,按1∶3传代。取传3代、对数生长期细胞进行后续实验。
1.3 PD 细胞模型构建与分组转染 取传3 代、对数生长期PC12 细胞,按1×105个/孔接种于96 孔板,随机分为对照组、模型组、NC mimics 组、miR-185 mimics 组。然后将96 孔板于37 ℃、5% CO2条件下培养24 h,模型组、NC mimics 组、miR-185 mimics 组予1 mmol/L MPP+诱导PD细胞模型[10-12],对照组不予MPP+诱导。成模24 h,NC mimics组、miR-185 mimics组按LipofectamineTM2000 说明分别转染NC mimics、miR-185 mimics。对照组和模型组不予转染。转染6 h更换新鲜培养基,继续培养24 h。收集各组细胞,采用TRIzol 法提取细胞总RNA,经紫外可见分光光度计鉴定,OD260/OD280为1.8~2.0。按PrimeScriptTMRT Master Mix 说明,将总RNA 逆转录合成为cDNA。以cDNA 为模板,按SYBR Premix Ex TaqTMⅡ说明进行PCR扩增。引物序列:miR-185上游引物5'-CAATGGAGAGAAAGGCAGTTCC-3'、下游引物5'-AATCCATGAGAGATCCCTACCG-3',U6 上游引物5'-CTCGCTTCGGCAGCACA-3'、下游引物5'-CCAGTGCAGGGTCCGAGGT-3'。PCR反应体系共20 µL:cDNA模板1 µL,上下游引物各0.8 µL,2 × SYBR Premix Ex Taq Ⅱ 10 µL,ddH2O 7.4 µL;反应条件:95 ℃ 10 min,95 ℃ 10 s、58 ℃ 60 s 共40 个循环。以U6 为内参,采用2-ΔΔCT法计算目的基因相对表达量。
1.4 细胞增殖活性检测 采用CCK-8 法。取上述各组细胞,用含10% FBS 的DMEM 培养液重悬,制成密度为5×104/mL单细胞悬液。取细胞悬液200 µL,接种于96孔板,然后将96孔板于37 ℃、5% CO2条件下培养。分别于培养24、48、72 h,每孔加入CCK-8溶液10 µL,37 ℃孵育4 h。酶标仪于450 nm 波长处检测各孔的OD 值。以OD450值作为细胞增殖活性。
1.5 细胞凋亡检测 采用流式细胞术。取上述各组细胞,用不含EDTA 的胰蛋白酶消化,加入1 ×Bingding Buffer 重悬。取细胞悬液5 mL 至流式管中,然后依次加入Annexin V-FITC 5 µL 和PI 5 µL,充分混匀,室温避光孵育15 min,上流式细胞仪检测。
1.6 GSH、SOD、MDA检测 取上述各组细胞,超声波破碎,10 000 r/min 离心10 min、离心半径10 cm,收集上清液。采用ELISA法检测GSH、SOD、MDA。
1.7 Bcl-2、Bax蛋白表达检测 采用Western blotting法。取上述各组细胞,加入细胞裂解液冰上充分裂解,提取细胞总蛋白,经BCA 法蛋白定量合格。然后加入5 × 蛋白上样缓冲液,100 ℃水浴,使蛋白充分变性。取变性蛋白30 µg,SDS-PAGE 分离。电泳结束,采用湿转法将蛋白电泳产物转印至PVDF 膜上。5%脱脂奶粉室温封闭2 h,分别加入Bcl-2(稀释比1∶1 000)、Bax(稀释比1∶1 000)、GAPDH(稀释比1∶2 000)一抗,4 ℃孵育过夜。次日,加入HRP 标记的IgG 二抗,室温孵育1 h。ECL 发光,暗室内曝光、显影、定影。采用Quantity One 软件分析各蛋白电泳条带灰度值。以目的蛋白电泳条带灰度值/内参蛋白电泳条带灰度值作为目的蛋白相对表达量。
1.8 统计学方法 采用SPSS20.0 统计软件。正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组miR-185 表达比较 对照组、模型组、NC mimics组、miR-185 mimics组miR-185相对表达量分别为1.01 ± 0.03、0.61 ± 0.10、0.57 ± 0.12、1.97 ±0.22。与对照组比较,模型组和NC mimics组miR-185相对表达量均显著降低(t分别为9.38、8.71,P均<0.05),而miR-185 mimics 组miR-185 相对表达量显著升高(t=10.59,P<0.05);与模型组比较,NC mimics组miR-185 相对表达量变化不明显(t=0.63,P>0.05),miR-185 mimics组miR-185相对表达量显著升高(t=13.79,P<0.05);与NC mimics组比较,miR-185 mimics 组miR-185 相对表达量显著升高(t=13.68,P<0.05)。
2.2 各组细胞增殖活性和细胞凋亡率比较 见表1。
表1 各组细胞增殖活性和细胞凋亡率比较(± s)
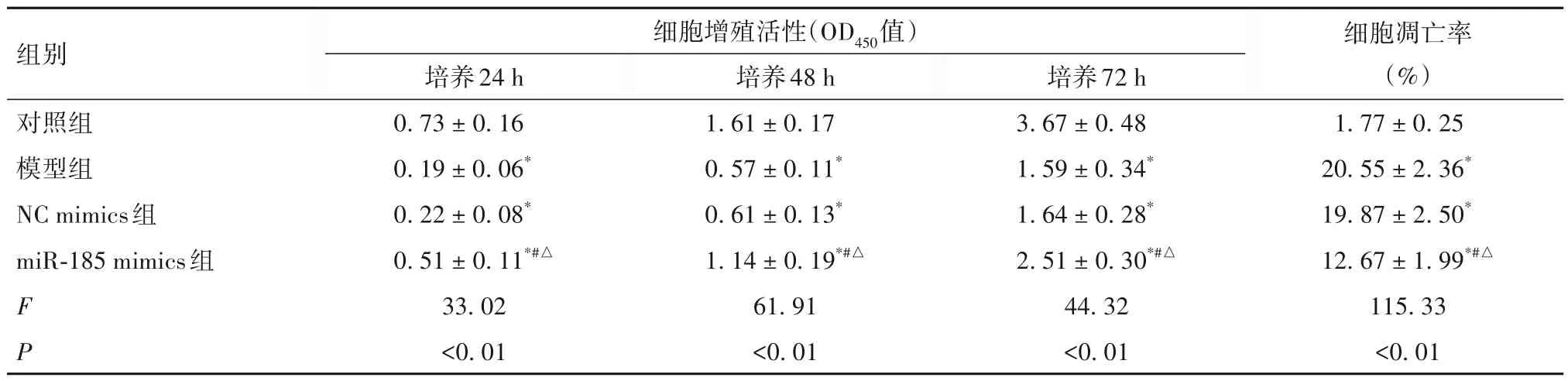
表1 各组细胞增殖活性和细胞凋亡率比较(± s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与NC mimics组比较,△P<0.05。
?
2.3 各组GSH、SOD、MDA含量比较 见表2。
表2 各组GSH、SOD、MDA含量比较(± s)
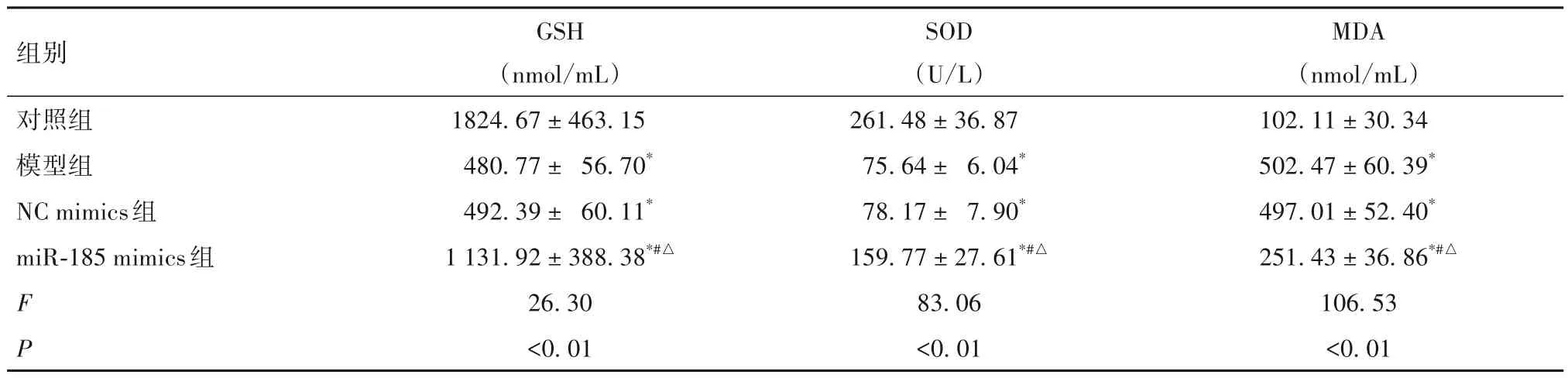
表2 各组GSH、SOD、MDA含量比较(± s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与NC mimics组比较,△P<0.05。
?
2.4 各组Bcl-2、Bax蛋白表达比较 见表3。
表3 各组Bcl-2、Bax蛋白相对表达量比较(± s)
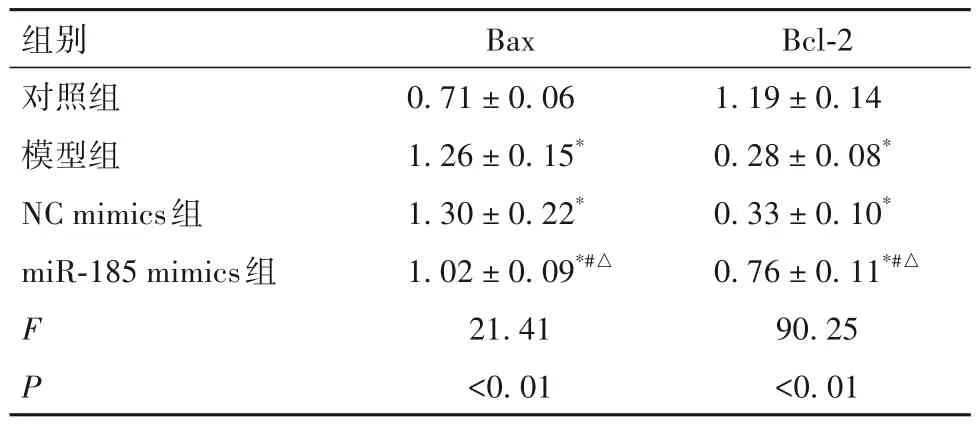
表3 各组Bcl-2、Bax蛋白相对表达量比较(± s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与NC mimics组比较,△P<0.05。
?
3 讨论
PD 是一种中老年人常见的神经退行性疾病。近年来,随着人口老龄化加剧,PD 的患病率逐年上升。PD 的发病机制非常复杂,可能是遗传因素、环境因素、神经系统老化等共同作用所致,但其具体发病机制仍未完全阐明。中脑黑质致密部的多巴胺能神经元丢失是PD最主要的神经病理学特征,而氧化应激可能是导致多巴胺能神经元丢失的关键驱动因素,也被认为是PD重要的发病机制之一。外源性神经毒素诱导的动物或细胞模型是研究PD 的重要工具。MPP+是神经毒素MPTP 的一种毒性代谢物,能够选择性破坏黑质多巴胺能神经元,被广泛用于PD相关动物和细胞模型构建以及PD 的药物研发[10-12]。本研究采用1 mmol/L MPP+诱导PC12细胞成功构建了PD 细胞模型,这也是目前国内外应用较多的PD细胞建模方法。
miRNA 是一类内源性非编码单链小RNA 分子,可参与转录后基因表达的调控,在维持神经元存活及其正常功能中具有重要作用。有研究报道,在PD患者血浆和脑组织中存在多种miRNA 异常表达[13],其在神经退行性疾病的病理生理过程中发挥重要作用。CHEN等[14]研究报道,PD患者血浆中miR-133b、miR-221-3p 表达升高,二者均可作为PD 早期诊断的非侵入性生物标志物。GONG 等[15]研究发现,miR-132-3p在PD患者血清和细胞模型中高表达,其高表达可诱导小胶质细胞活化,从而参与PD的病理生理过程。DONG 等[16]研究发现,在PD 细胞模型中miR-421 表达升高、MEF2D 表达降低,miR-421 高表达可通过负调控MEF2D表达而促进多巴胺能神经元死亡。miR-185是miRNA 家族成员之一。有研究报道,在PD 患者血清中miR-185 表达下调[7],在PD 模型大鼠中脑黑质和纹状体中也发现miR-185 表达降低[8],提示miR-185可能在PD发病中起着重要作用。
本研究结果发现,与对照组比较,模型组培养24、48、72 h 细胞增殖活性均显著降低,细胞凋亡率显著升高;抗氧化物GSH、SOD 含量均显著降低,过氧化产物MDA 含量显著升高;凋亡抑制因子Bcl-2蛋白相对表达量显著降低,促凋亡因子Bax 蛋白相对表达量显著升高。结果表明,PD 细胞模型构建成功。本研究通过RT-qPCR 检测发现,模型组miR-185 表达明显低于对照组。为了进一步探讨miR-185 对PD 细胞增殖、凋亡和氧化应激损伤的影响,本研究将miR-185 mimics、NC mimics 转染PD 模型细胞,结果发现,miR-185 mimics 组miR-185 相对表达量明显高于NC mimics 组,表明miR-185 mimics的转染效率较高。本研究结果还发现,与NC mimics组比较,miR-185 mimics 组培养24、48、72 h 细胞增殖活性均显著升高,细胞凋亡率显著降低;抗氧化物GSH、SOD 含量均显著升高,过氧化产物MDA 含量显著降低;凋亡抑制因子Bcl-2蛋白相对表达量显著升高,促凋亡因子Bax 蛋白相对表达量显著降低。结果提示,miR-185 过表达能够提高PD 细胞增殖活性并抑制其凋亡,具有明显的保护作用。
综上所述,miR-185 过表达能够促进PD 细胞增殖并抑制其凋亡,具有明显的保护作用;减轻氧化应激损伤以及抑制Bax 蛋白表达和促进Bcl-2 蛋白表达可能是其作用机制之一。

