帕博利珠单抗电荷异构体阳离子交换高效液相色谱检测方法的建立及验证
蔡丽星,李翱翔,张琳,沈培玉,张坤明,邱建华
上海生物制品研究所有限责任公司,上海 200051
在单克隆抗体生产过程中,翻译后修饰可导致电荷缺失或增加,产生不均一的电荷异构体。翻译后修饰主要包括C-末端赖氨酸截除、糖基化修饰、氧化、脱酰胺基、异构化、氧化、聚集等[1-5]。其中酸性异构体主要是由抗体发生N-末端谷氨酰胺/谷氨酸环化、唾液酸修饰、半胱氨酸残基修饰等产生的[6-7];碱性异构体主要是由抗体发生C-末端赖氨酸截除、氧化、天冬酰胺脱氨基/天冬氨酸异构体修饰等产生的[8-9]。电荷异构体的产生与抗体稳定性及生物学活性密切相关,因此,在抗体生产过程中监控其电荷异构体的含量对生产工艺及抗体功能的稳定性具有重要作用[10-11]。目前,常用于检测抗体电荷异构体的方法主要有等电聚焦(isoelectric focusing,IEF)电泳法和离子交换色谱(ion-exchange chromatography,IEX)法[12-15],其中IEF电泳法的原理是基于整个抗体的电荷量,对抗体局部电荷分布差异的检测灵敏度较低;IEX 法是根据抗体表面电荷的差异分离抗体的电荷异构体,具有较高的灵敏度,常用于抗体电荷异构体检测,该方法是电荷异构体分析的金标准[16]。基于IEX法的阳离子交换高效液相色谱(cation exchange chromatography high performance liquid chromatography,CEX-HPLC)法是根据分子所带电荷的不同来分离化合物。由于抗体在低于其等电点的pH环境下带有正电荷,因此能够与阳离子交换柱基质上的负电荷相互吸引而结合至离子交换柱上,通过逐渐增加流动相中的盐浓度洗脱带有不同电荷性质的化合物。
免疫细胞表面的程序性死亡受体1(programmed death receptor 1,PD1)与肿瘤细胞表面的细胞程序性死亡配体1(programmed cell death ligand 1,PDL1)介导的免疫逃逸在肿瘤微环境中发挥了重要作用[17-19],可通过制备PD1单抗与肿瘤细胞表面的PDL1结合,从而抑制肿瘤细胞的免疫逃逸。帕博利珠单抗是人源化抗PD1 的单抗,美国FDA 已批准其用于治疗晚期黑色素瘤及非小细胞肺癌[21-23]。为监控帕博利珠单抗生产过程中电荷异构体的含量,本研究建立了用于检测帕博利珠单抗电荷异构体含量的CEXHPLC 法,验证其专属性、精密性、线性、准确性及耐用性,并采用该方法检测3 批帕博利珠单抗成品的电荷异构体含量。
1 材料与方法
1.1 样品 帕博利珠单抗标准品(批号:RS-PE-002)、成品(批号:S20210501、S20210502、S20210603)及制剂缓冲液均由上海生物制品研究所有限责任公司第一研究室制备。
1.2 主要试剂及仪器 二水合磷酸二氢钠、十二水合磷酸氢二钠、氯化钠、氢氧化钠及磷酸均购自国药集团化学试剂有限公司;高效液相色谱仪(9-126、9-084)及样品瓶均购自美国Waters公司;MabPac SCX-10色谱柱购自美国Thermo Fisher Scientific 公司。
1.3 溶液的制备 流动相A:将1.209 g 二水合磷酸二氢钠和0.806 g 十二水合磷酸氢二钠加至900 mL超纯水中,混匀,至完全溶解,用磷酸调节pH至6.30±0.05,超纯水定容至1 L,经0.2 μm 滤膜抽滤,超声10 min 脱气。流动相B:将1.209 g 二水合磷酸二氢钠、0.806 g 十二水合磷酸氢二钠、5.850 g 氯化钠加至900 mL 超纯水中,混匀,至完全溶解,用5 mol/L氢氧化钠调节pH 至6.30±0.05,混匀,超纯水定容至1 L,经0.2 μm滤膜抽滤,超声10 min脱气。
1.4 色谱条件 色谱柱为MabPac SCX-10。紫外检测器波长为280 nm,柱温箱温度为35 ℃,样品盘温度10 ℃,进样体积40 μL,流速0.5 mL/min。采用梯度洗脱(0~1 min:流动相B 从0升至5%;1~30 min:流动相B从5%升至35%;30~32 min:流动相B从35%升至100%;32~33 min:流动相B为100%等度洗脱;33.00~33.01 min:流动相B 从100%降至0;33.01~43 min:流动相B为0等度洗脱)。
1.5 方法的验证
1.5.1 专属性 取1 mL 流动相A 置于样品瓶,命名为MPA;用流动相A 将帕博利珠单抗标准品稀释为1.00 mg/mL,置于样品瓶,命名为1.00 mg/mL RSPE-002;用流动相A 按标准品的稀释倍数稀释制剂缓冲液,置于样品瓶,命名为制剂缓冲液。按1.4项方法依次进样1 针MPA、1 针制剂缓冲液、3 针1.00 mg/mL RS-PE-002和1针MPA。计算最后1针流动相A 总峰面积与3 针标准品总峰面积平均值的比值。
1.5.2 精密性
1.5.2.1 重复性用流动相A 将帕博利珠单抗标准品稀释为0.50、1.00 和1.50 mg/mL,置样品瓶,按1.4项方法进样1次,重复检测3次。计算总峰面积、主峰面积、主峰保留时间和主峰面积百分比的相对标准偏差(RSD)。
1.5.2.2 中间精密性 用流动相A 将帕博利珠单抗标准品稀释为0.50、1.00和1.50 mg/mL,置于样品瓶,由2名实验员分别用两台不同的仪器按1.4项方法进样1次,重复检测3次。计算主峰面积百分比和主峰保留时间的RSD。另由1 名实验人员分别在2个不同时间用流动相A 将标准品稀释为0.50、1.00和1.50 mg/mL,置于样品瓶,按1.4项方法进样1次,重复检测3次。
1.5.3 线性范围用流动相A 将帕博利珠单抗标准品稀释为0.50、0.75、1.00、1.25 和1.50 mg/mL,置样品瓶,按1.4 项方法进样1 次,重复检测3 次。以标准品理论稀释浓度为横坐标,分别以总峰面积、主峰面积、酸性异构体峰面积和碱性异构体峰面积为纵坐标,绘制回归曲线,获得回归方程,计算R2。
1.5.4 准确性用流动相A 将帕博利珠单抗标准品稀释成0.50、1.00和1.50 mg/mL,置样品瓶,按1.4项方法进样1次,重复检测3次。将总峰面积和主峰面积数据分别代入线性验证的回归曲线中,获得实际浓度值,并计算回收率。
1.5.5 耐用性 配制pH分别为6.20、6.30和6.40的流动相A,用其将帕博利珠单抗标准品分别稀释为1.00 mg/mL,置样品瓶,按1.4 项方法进样3 次,计算标准品的总峰面积和主峰面积百分比的RSD。用流动相A 将标准品稀释为1.00 mg/mL,置样品瓶,将色谱柱温度分别设为31、33、35、37和39 ℃,按1.4项方法进样3 次,计算总峰面积和主峰面积百分比的RSD。
1.6 方法的应用 用流动相A 将3 批帕博利珠单抗成品分别稀释为1.00 mg/mL,置样品瓶。按1.4项方法进样1次,计算3批成品酸性异构体、主峰、碱性异构体面积百分比及主峰保留时间的RSD。
1.7 数据采集及分析 应用Empower 3 软件进行数据采集及分析。
2 结果
2.1 标准品的CEX-HPLC分析 帕博利珠单抗标准品酸性异构体的洗脱时间为18~24 min,碱性异构体的洗脱时间为26~32 min。最后1 个酸性异构体峰及第1 个碱性异构体峰与主峰的分离度分别为1.28 和1.42。酸性异构体峰、主峰及碱性异构体峰面积百分比分别为17.9%、65.1%、17.0%。见图1。
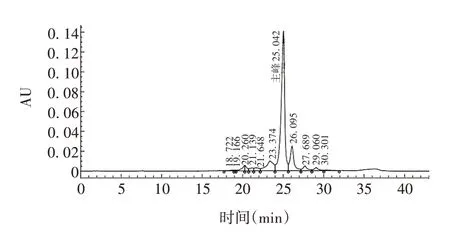
图1 帕博利珠单抗标准品的CEX-HPLC检测色谱图Fig.1 CEX-HPLC chromatogram of pembrolizumab standard
2.2 方法的验证
2.2.1 专属性 流动相A(MPA)和制剂缓冲液图谱在样品出峰处无明显干扰峰出现,最后1针流动相A样品残留为0.1%,<5%,见图2。表明该方法具有良好的专属性。
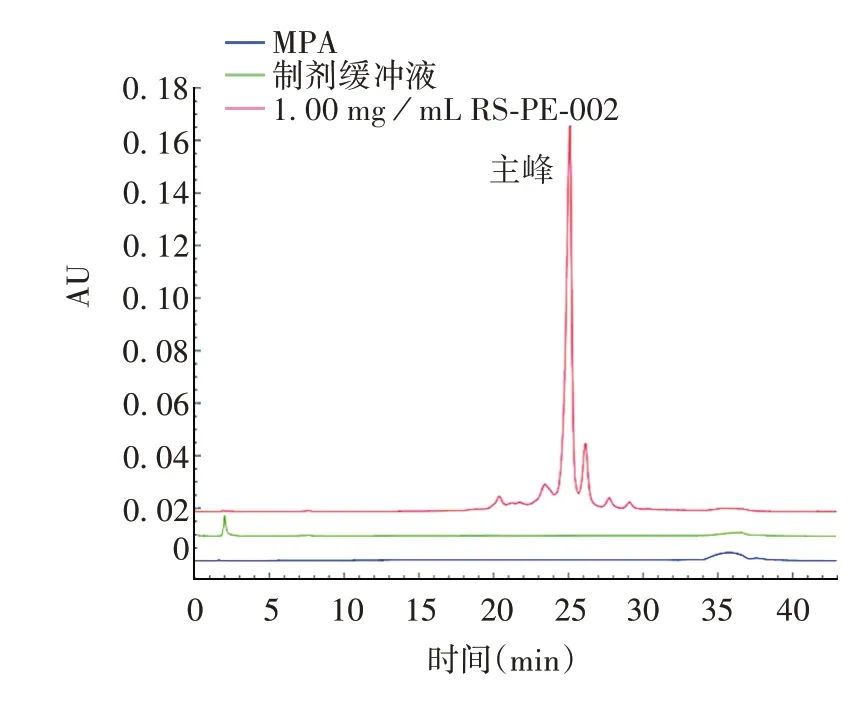
图2 专属性验证结果Fig.2 Verification for specificity
2.2.2 精密性
2.2.2.1 重复性 3针浓度为0.50 mg/mL标准品总峰面积、主峰面积、主峰面积百分比及主峰保留时间的RSD分别为0.7%、0.6%、0.2%和0.1%。3 针浓度为1.00 mg/mL 样品总峰面积、主峰面积、主峰面积百分比及主峰保留时间的RSD分别为0.2%、0.2%、0.1%和0。3针浓度为1.50 mg/mL样品总峰面积、主峰面积、主峰面积百分比及主峰保留时间的RSD分别为0.2%、0.2%、0.1%和0。RSD均<2%,见表1。表明该方法具有良好的重复性。

表1 重复性验证结果Tab.1 Verification for repeatability
2.2.2.2 中间精密性 2名检测人员分别在2台不同的仪器上检测时,不同浓度样品主峰面积百分比RSD分别为0.7%、0.3%和0.2%,不同浓度样品主峰保留时间RSD分别为1.2%、1.1%和1.2%,RSD均<2%,见表2。同一名检测人员在不同日期检测样品时,不同浓度样品主峰面积百分比RSD分别为0.2%、0.2%和0.1%,主峰保留时间RSD分别为0.1%、0.1%和0.04%,RSD均<2%。见表3。表明该方法具有良好的中间精密性。

表3 不同日期中间精密性验证结果Tab.3 Verification for intermediate precision between different dates
2.2.3 线性范围 总峰面积及异构体峰面积与标准品理论浓度回归曲线见图3。总峰面积及异构体主峰、酸性峰及碱性峰面积均与标准品理论稀释浓度呈良好的线性关系,线性方程分别为y=6 736 055.13x-108 727.22、y= 4 369 142.40x- 26 238.60、y =1 291 858.13 x - 120 546.93 和y = 1 075 055.20 x +38 057.73,R2均为1.00。
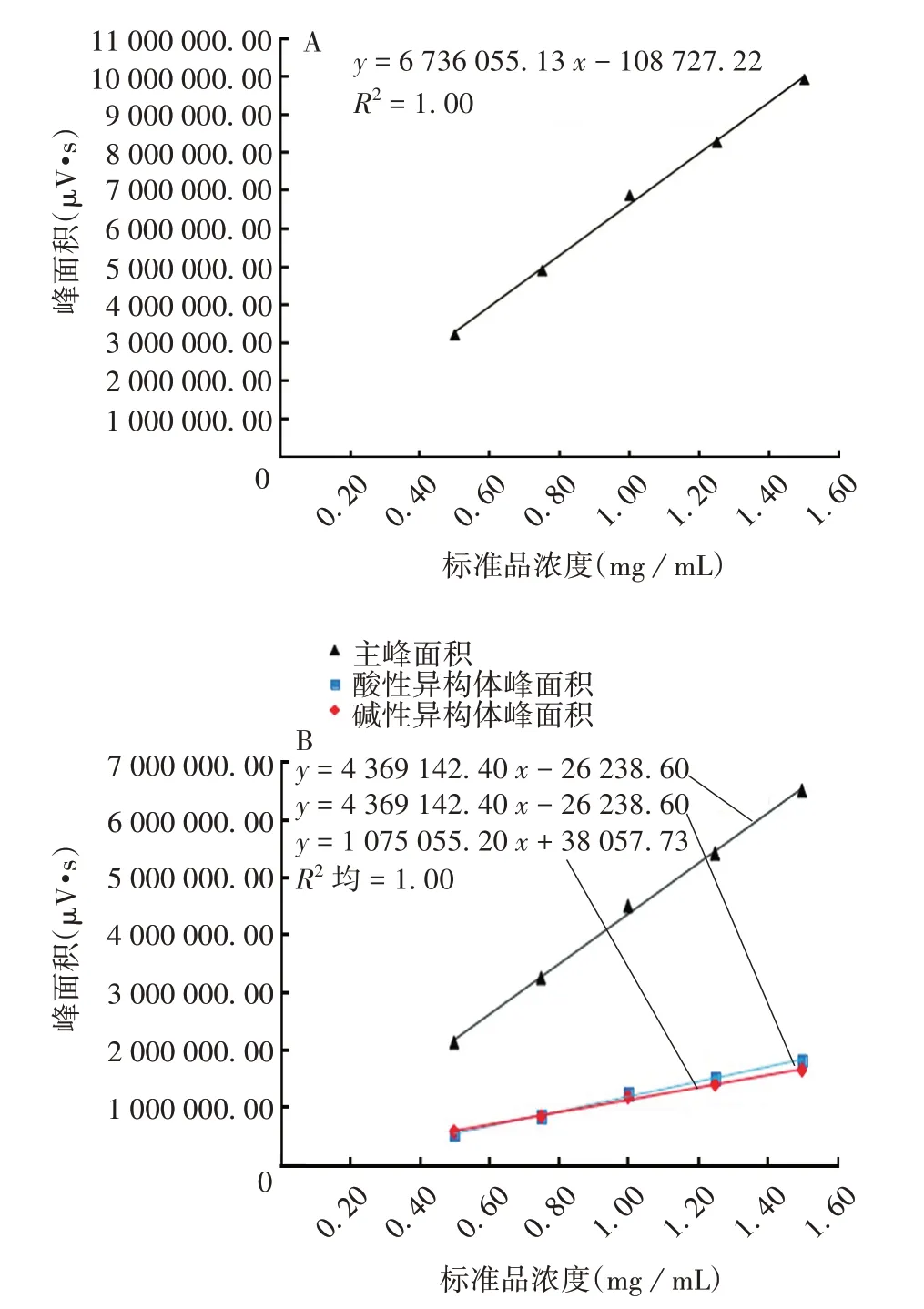
图3 总峰面积(A)及异构体峰面积(B)与标准品理论浓度的回归曲线Fig.3 Regression curves of total peak area(A)and isomer peak area(B)with theoretical concentration of standard
2.2.4 准确性 3 个浓度标准品的总峰和主峰面积回收率为96.81%~106.07%,均在90.0%~108.0%范围内,见表4。表明该方法具有良好的准确性。
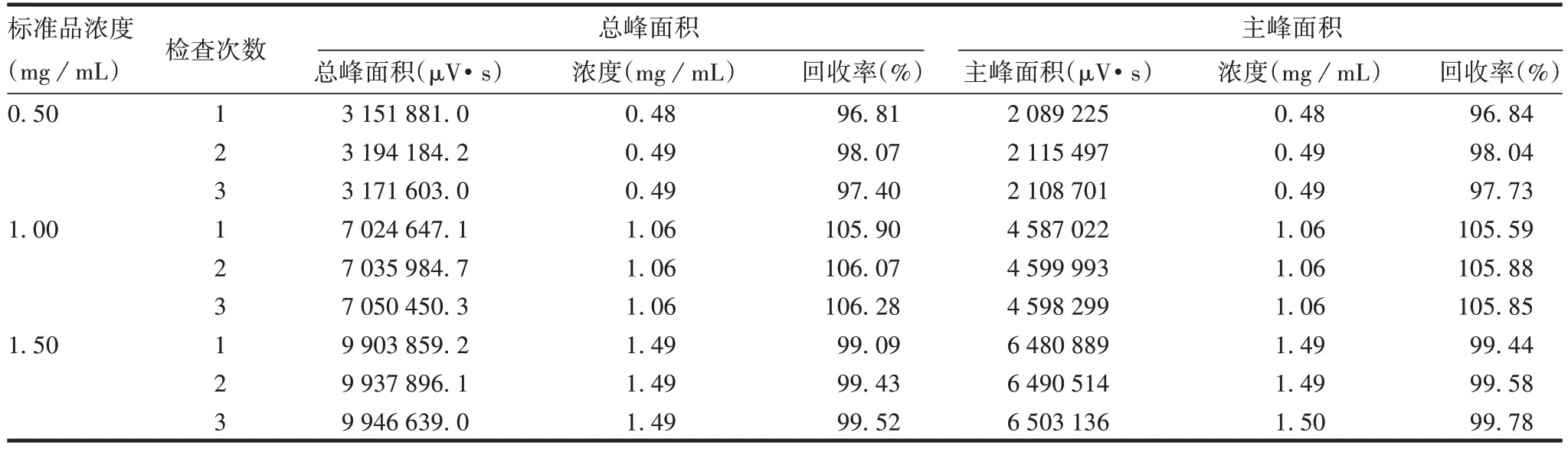
表4 准确性验证结果Tab.4 Verification for accuracy
2.2.5 耐用性 3种pH流动相A标准品的总峰及主峰面积百分比RSD分别为1.5%和1.9%,不同色谱柱温度条件下标准品总峰和主峰百分比RSD分别为0.4%、0.3%,RSD均<2%,见表5。表明pH在6.30±0.10及温度在31~39 ℃范围内波动时,不影响样品检测结果,该方法具有良好的耐用性。
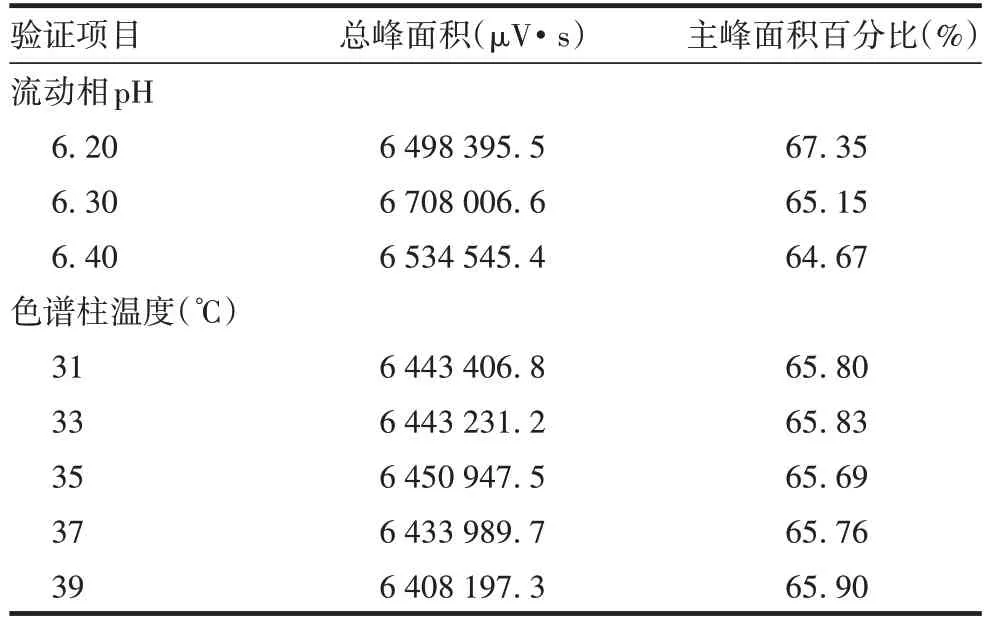
表5 耐用性验证结果Tab.5 Verification for durability
2.3 方法的应用 S20210501、S20210502、S20210603批帕博利珠单抗成品的酸性异构体面积百分比分别为17.4%、18.5%、17.2%,主峰面积百分比分别为68.4%、64.9%、66.2%,碱性异构体面积百分比分别为14.2%、16.6%、16.6%。见图4。3 批成品主峰保留时间RSD为0,表明该方法对不同批样品的检测结果稳定。
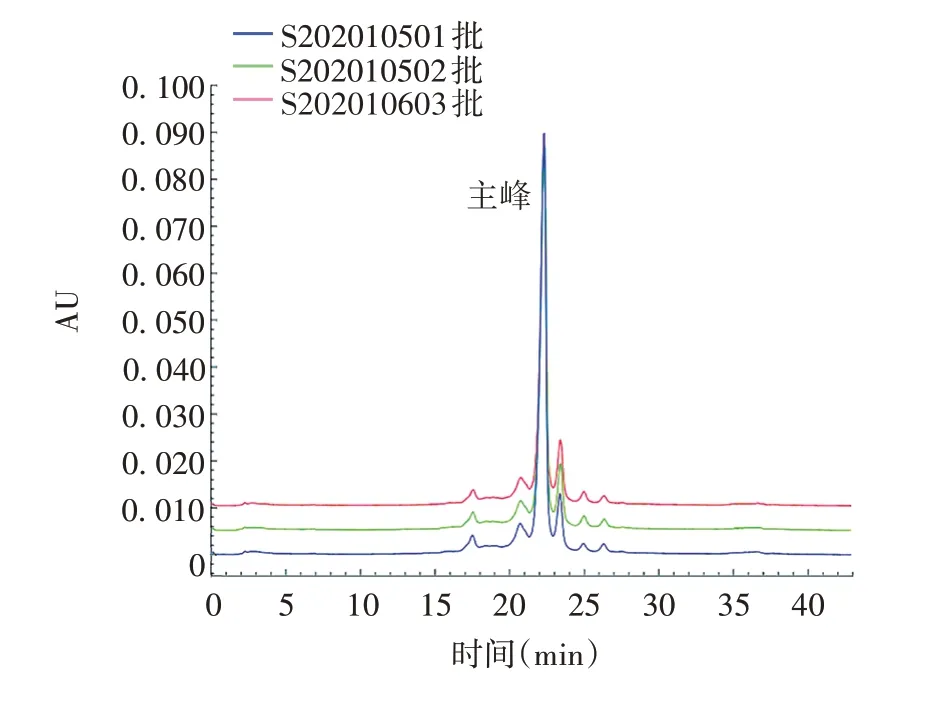
图4 3批帕博利珠单抗成品的CEX-HPLC色谱图Fig.4 CEX-HPLC chromatogram of three batches of pembrolizumab finished products
3 讨论
目前,单抗大多采用哺乳动物细胞表达系统进行生产,因此在生产的过程中常发生翻译后修饰或降解,从而产生不同的电荷异构体。单抗翻译后修饰主要包括C-末端赖氨酸截除、糖基化修饰、氧化、脱酰胺基、异构化、氧化、聚集等。这些修饰可改变蛋白表面的电荷状态,从而直接或间接影响蛋白的结构及生物学活性。研究发现,单抗唾液酸化修饰可降低抗体与NK 细胞FcγRⅢa的亲和力,从而降低抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cellular cytotoxicity,ADCC)[24];单抗Fc 端蛋氨酸氧化可降低其与新生儿Fc受体(neonatal Fc receptor for IgG,FcRn)的结合,从而降低抗体在血液中的半衰期[25]。同时,在生产过程中对单抗电荷异构体的监测,也是确保生产批次一致性的重要质量标准。因此,构建帕博利珠单抗电荷异构体的检测方法对确保产品的稳定性、有效性及批间一致性具有重要作用。
基于帕博利珠单抗的等电点偏弱碱性,本研究建立了用于检测其电荷异构体的CEX-HPLC 法,并对该方法进行专属性、精密性、线性范围、准确性、耐用性验证。专属性验证结果表明,空白对照样品中无干扰峰且能够特异性检定目的蛋白;精密性验证结果表明,该方法在不同人员、不同时间和不同机器间是可重现的;线性验证结果表明,总峰面积、主峰面积、酸性异构体峰面积及碱性异构体峰面积均与样品的理论稀释浓度呈良好的线性关系;准确性验证结果表明,样品回收率在96.81%~106.07%之间,该方法具有良好的准确性;耐用性验证结果表明,流动相pH在6.30±0.10及色谱柱温度在(35±4)℃范围内波动均不影响检测结果。3批帕博利珠单抗成品主峰保留时间RSD为0,表明该方法在不同批次间检测的重复性及稳定性良好。因此,该方法可用于后续研发工作、扩大生产的工艺检定及稳定性研究。但帕博利珠单抗酸性异构体及碱性异构体的具体修饰类型还需后续通过液质联用系统进行进一步分析鉴定。

