百日咳毒素兔多克隆抗体的制备及其ELISA定量检测方法的建立和验证
宋欣然,张茗婧,伊丽男,彭少丹,王帆,张国强,司伟雪,朱涛,
1.天津科技大学生物工程学院,天津 300457;2.康希诺生物股份公司,天津 300301
百日咳毒素(pertussis toxin,PT)是百日咳杆菌的主要致病因子,通常认为PT 在诱导临床免疫方面起重要作用[1-9]。由于PT具有多种毒性作用,因此需脱毒后才可作为疫苗有效成分。但采用不同的脱毒剂和脱毒条件对PT 进行化学脱毒后[10-14],其免疫原性和抗原性会发生较大差异,与化学定量检测相比,免疫学定量检测方法更适用于脱毒后样品抗原的定量监控,目前在欧美国家,组分百白破联合疫苗生产工艺过程中均采用酶标法进行质量控制。为此,本研究制备了PT 兔多克隆抗体(简称多抗),建立了特异性好,灵敏度高,结果判定更直观的定量检测PT抗原含量的双抗体夹心ELISA 法,并对方法进行验证及初步应用。
1 材料与方法
1.1 疫苗及样品 卡介苗购自成都生物制品研究所有限责任公司;待测样品为康希诺生物股份公司自制的PT脱毒工艺研发过程中样品。
1.2 实验动物 6 只SPF 级青紫蓝兔,3 ~4 月龄,雌雄各半,体质量2.5 ~3.5 kg,购自天津裕达实验动物养殖有限公司,动物许可证号:SCXK(津)2016-0001,动物合格证号:0010805。动物饲养于SPF 级动物房,动物房环境条件控制在室温(18 ~26 ℃),相对湿度40% ~70%,通风良好,光照12 h 明暗交替,动物自由进食与饮水。本实验均以科研为目的对实验动物进行养殖和使用,且按照《国家实验动物管理法规》(国务院令第676号)动物伦理相关规定进行。
1.3 主要试剂及仪器 免疫家兔和方法优化用抗原(纯度大于90%的PT 纯化蛋白)、丝状血凝素(filamentous hemagglutinin,FHA)纯化蛋白、黏着素(pertactin,PRN)纯化蛋白、菌毛蛋白(fimbriae proteins,FIM)原液、白喉类毒素、破伤风类毒素、PBS-5%甘油溶液、PBS-15%甘油溶液、His-吐温溶液和PT标准品(改良Lowry 法[15]测定蛋白含量为663 μg/mL)均由康希诺生物股份公司自制;完全弗氏佐剂和HRP 均购自美国Sigma公司;ELX808酶标仪购自美国Biotek公司;洗板机购自美国Thermo公司。
1.4 PT兔多抗的制备
1.4.1 动物免疫 青紫蓝兔经耳缘静脉采集免前血后免疫卡介苗,1 ~2 周后给与PT 纯化蛋白:将PT 纯化蛋白与完全弗氏佐剂充分乳化后,经腹股沟淋巴结或背部皮下多点注射,共免疫4 次,间隔3 周。初次免疫及二次免疫剂量为50 μg/只,第3 次免疫剂量为100 μg/只,第4 次免疫剂量为150 μg/只。每次免疫前采血,末次免疫后2 周经颈总动脉采集全血,分离血清,双抗原夹心法检测抗体滴度。
1.4.2 抗体纯化 取兔血清,加入醋酸钠缓冲液,调pH 至4.5,滴加辛酸后室温搅拌30 min;2 ~8 ℃,10 000 ×g离心30 min,弃沉淀,上清中加入等体积0.1 mol/L PBS 溶液,调pH 至7.4,加入固体硫酸铵,室温搅拌15 min,2 ~8 ℃静置过夜;室温搅拌10 min,2 ~8 ℃,5 000×g离心30 min,弃上清,沉淀用0.01 mol/L PBS溶液复溶透析。
1.5 PT 兔多抗的HRP 标记 PT 兔多抗透析至碳酸盐缓冲液,将适量HRP 活化,二者混匀并充分反应后,加入等体积饱和硫酸铵溶液,静置过夜后离心收集沉淀。将沉淀透析至磷酸盐缓冲液中,得到酶标抗体,加入等体积甘油后,于-20 ℃保存[16]。
1.6 包被抗体与酶标抗体工作浓度的筛选 采用棋盘滴定法。PT兔多抗按1、5 μg/mL包被,酶标抗体按1∶4 000、1∶8 000、1∶16 000稀释。分别用以上组合方式检测系列稀释的PT 纯化蛋白标准品及标样(以标准品作为样品),以标准品直线回归系数(R2)、标准曲线首点A450值及标样回收率最优值作为包被抗体浓度与酶标抗体稀释倍数的确定依据。在确定的包被浓度下对酶标抗体稀释度进行微调(1∶5 000、1∶6 000、1∶8 000),对酶标抗体工作浓度进行再确认,并用此条件对标准品和标样各重复测定8次。
1.7 方法的验证
1.7.1 特异性以PT 纯化蛋白作为阳性对照,用建立的方法对百日咳疫苗生产过程中使用的缓冲液(PBS-5%甘油溶液、PBS-15%甘油溶液、His-吐温溶液),及吸附无细胞百(三组分)白破联合疫苗中其他抗原成分(PRN 纯化蛋白、FHA 纯化蛋白、FIM 原液、白喉类毒素、破伤风类毒素)进行检测,验证方法的特异性。
1.7.2 线性 将PT 纯化蛋白标准品进行2 倍系列稀释,将抗原含量与A450值进行线性回归,建立回归方程,计算R2。根据R2值确定该方法标准曲线的最佳定量范围。试验重复8次。
1.7.3 准确性 取PT纯化蛋白标准品,分别稀释2、5、10倍,使标准品浓度分别为331.5,132.6,66.3 μg/mL,用建立的方法重复检测3 次,计算变异系数(CV)及回收率,验证方法的准确性。
回收率(%)= ELISA 法检测样品含量/标准品理论含量×100%
1.7.4 精密性 分别在3 块酶标板上用建立的方法检测PT纯化蛋白标准品,每块板上平行检测3次,计算板内、板间标准差(SD)及CV,验证方法的精密性。
1.7.5 灵敏度 将PT 纯化蛋白标准品2 倍系列稀释至128 000 倍,用建立的方法进行检测,以阴性对照孔(含1% BSA 的稀释液)A450均值的2.1 倍作为Cutoff值,样品A450值大于Cut-off值时判为阳性。判为阳性的最大稀释度所对应的蛋白浓度为检测下限。
1.8 方法的初步应用
1.8.1 脱毒过程样品中PT抗原含量的检测 分别取5 种不同工艺制备的PT 纯化蛋白脱毒过程样品,每个工艺路线选取7个不同时间点的1批样品,采用建立的方法检测抗原含量,以监测不同脱毒工艺下抗原含量随时间的变化情况。
1.8.2 其他百日咳抗原纯化过程样品中PT 抗原残留量检测 取百日咳FIM 原液纯化过程样品6 批,2倍系列稀释后,取100 μL,采用建立的方法检测PT抗原含量。
1.9 数据采集与分析 采用Graphpad Prism 8.0软件对数据进行统计分析,实验结果以Mean±SD表示,并计算CV。
2 结果
2.1 PT 兔多抗的滴度和纯度 4 次免疫后6 只兔PT多抗滴度几何平均值为4.6。纯化后多抗SDS-PAGE纯度在85%以上。
2.2 PT 抗原含量双抗体夹心ELISA 检测方法工作条件的确定 检测结果表明,用1 μg/mL PT 兔多抗包被,1∶8 000 稀释的酶标抗体检测时,标准曲线首点A450值满足要求(最佳定量范围在1.8 ~2.2),标准曲线R2为0.99,标样回收率大于80%,此条件可作为双抗体夹心法的候选工作条件,见表1。在此包被浓度下对酶标抗体稀释度进行微调后,候选条件的R2大于0.99,标样回收率大于90%,见表2。用此条件对标准品重复测定8 次,标准曲线R2为0.994 5 ±0.001 7;对标样重复测定8次,平均回收率为98.86%,CV为3.89%。最终确定PT 抗原含量双抗体夹心ELISA检测方法的工作条件为PT兔多抗包被浓度为1 μg/mL,酶标抗体稀释度为1∶8 000。
2.3 方法的验证
2.3.1 特异性 检测结果表明,原倍PRN 纯化蛋白和FIM 原液的A450值偏高,原因是PRN 和FIM 菌种均由百日咳杆菌改造而来,未将表达PT 蛋白的基因敲除,可能存在少量PT 残留;而FHA 菌种已将PT 蛋白基因敲除,因此A450值较低;白喉类毒素和破伤风类毒素均未检出。见表3。表明该方法特异性良好。
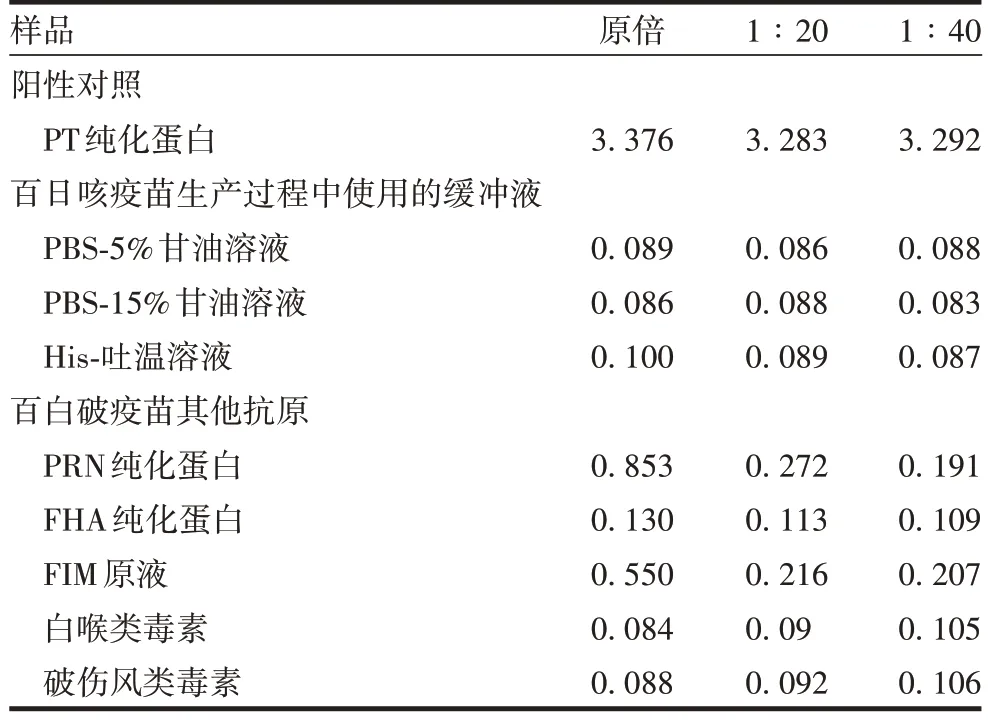
表3 特异性验证结果(A450)Tab.3 Specificity verification results(A450)
2.3.2 线性 标准曲线优化后最佳定量范围在25 ~400 ng/mL 之间,重复测定8 次的R2为0.994 5 ±0.001 7,CV为0.17%,见图1。表明该方法的标准曲线线性良好。

图1 标准曲线Fig.1 Standard curve
2.3.3 准确性 3 种不同稀释度的PT 纯化蛋白的回收率在91% ~104%之间,CV<1%,见表4。表明该方法准确性良好。
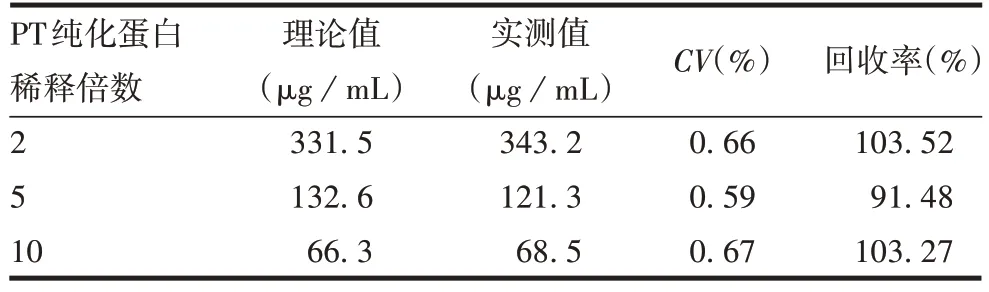
表4 准确性验证结果Tab.4 Accuracy verification results
2.3.4 精密性 检测结果的板内CV在2.99%~5.26%之间,见表5。板1与板2 6次检测结果的Mean±SD为(660.88±40.43)μg/mL,CV为6.12%;板1与板3 6次检测结果的Mean ± SD为(651.32 ± 27.74)μg/mL,CV为4.26%;板2 与板3 6 次检测结果的Mean ± SD为(677.97±28.16)μg/mL,CV为4.15%。
2.3.5 灵敏度 PT纯化蛋白标准品稀释32 000倍时,蛋白浓度为20.719 ng/mL,A450为0.271,大于Cut-off值,判定结果为阳性。该方法的灵敏度为20.719 ng/mL,检测下限为41.438 ng/mL。见表6。
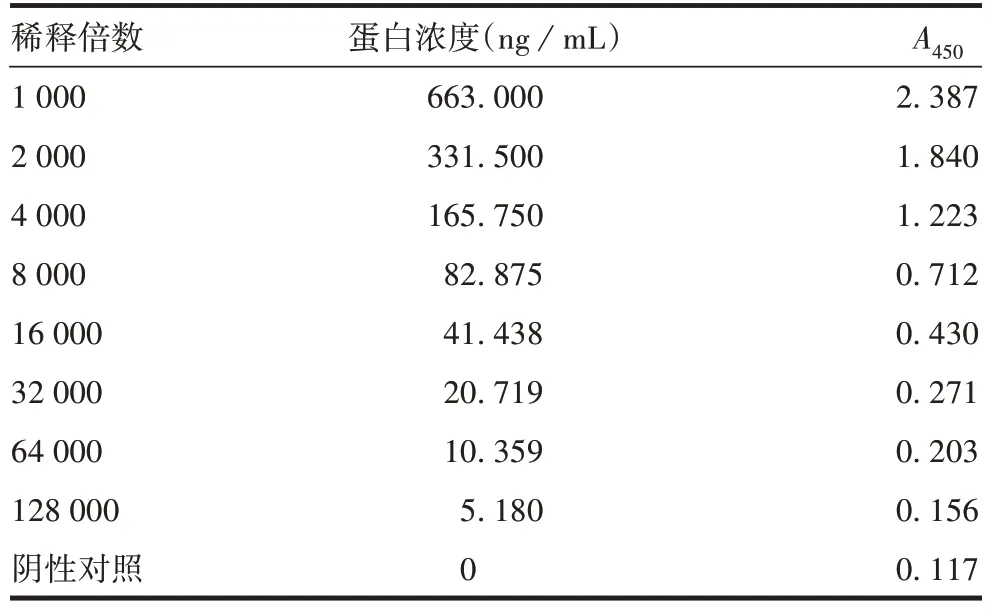
表6 灵敏度验证结果Tab.6 Sensitivity verification results
2.4 方法的初步应用
2.4.1 脱毒过程样品中PT抗原含量检测 采用建立的方法进行检测,工艺1、2、3(为相似工艺)的脱毒过程样品在7 个取样时间点下的抗原含量变化趋势基本一致;工艺4、5(为相似工艺)的脱毒过程样品在7个取样时间点下的抗原含量变化趋势基本一致。见图2。
2.4.2 其他百日咳抗原纯化过程样品中PT 抗原残留量检测 百日咳FIM 是从百日咳菌毛的纤毛中提取获得,因此猜测百日咳FIM 原液中可能残留少量PT 抗原,用建立的方法检测6 批百日咳FIM 原液纯化后样品中PT抗原含量分别为-1.897、29.173、25.840、24.815、15.073、25.840 ng/mL,均低于方法检测下限,表明纯化效果良好。
3 讨论
目前无细胞百白破疫苗中百日咳抗原大多采用共纯化工艺,主要定量方法包括凯氏定氮法或Lowry法[17],上述方法只能对样品中总蛋白含量进行定量,无法将百日咳各抗原成分分别进行准确定量,也无法监测各批样品中单个抗原的浓度和比例。而且PT 脱毒反应是一系列复杂的化学反应,在脱毒反应过程中PT 发生一系列结构变化[18],目前暂无有效方法监测脱毒反应过程中该变化情况。因此,建立一种能够对PT 脱毒过程样品进行准确定量的检测方法尤为重要。
本研究旨在建立一种快速、准确定量PT 抗原含量的双抗体夹心ELISA 法,该方法具有良好的特异性、线性、准确性、板内板间精密性和灵敏度,且结果判定较为直观,可信度高[19-25]。表现为与PT 抗原呈良好的浓度依赖性,与PT 抗原缓冲液、百白破疫苗其他抗原成分均无明显交叉反应。PT纯化蛋白标准品经2 倍系列稀释后,该方法在25 ~400 ng/mL 之间的线性R2为0.994 5±0.001 7(n=8,CV=0.17%),呈良好的线性。对3种不同稀释度的PT纯化蛋白检测的回收率为91%~104%,CV<1%,准确性高。板内及板间CV范围在2.99%~5.26%和4.15%~6.12%,精密性好。检测灵敏度达20.719 ng/mL,检测下限为41.438 ng/mL,灵敏度良好。使用该方法可对PT不同化学脱毒工艺过程样品进行抗原含量检测,可实现对脱毒工艺效果的实时监测,为疫苗研发过程提供内部质控手段。

