信号肽对SARS-CoV-2 S1、RBD、RBD二聚体蛋白在Expisf9昆虫细胞中分泌表达的影响
吴清胜,李媛媛,姚春萍
国药中生生物技术研究院有限公司,北京 101111
SARS-CoV-2 是2019 年COVID-19 的病因,WHO宣布COVID-19 为大流行病[1-2]。疫苗被认为是人类面对病毒感染最有效的预防手段,基于不同技术路线的疫苗均在加紧研制中[3-4]。基因工程亚单位疫苗无需P3 实验室,易于放大生产,对抗原的改造可提高其免疫原性[5-8]。杆状病毒-昆虫细胞系统(baculovirus-insect cell system,BICS)具有安全性高、重组蛋白表达水平高、能同时表达多个基因,可对重组蛋白进行正确折叠和翻译后修饰等优势,广泛应用于预防性及治疗性疫苗和基因治疗药物的研发及生产[9-11]。
SARS-CoV-2 通过S 蛋白上受体结合域(receptor binding domain,RBD)与宿主细胞的受体血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)结合[12],S1 蛋白、RBD、RBD 二聚体蛋白具有良好的免疫原性,是制备疫苗的理想抗原[13-15]。信号肽是引导新合成肽链转移至内质网上的一段多肽,一般由15 ~30 个氨基酸残基组成,位于合成肽链的N-端。信号肽引导蛋白质的分泌是细胞内蛋白质释放到细胞外的主要方式之一,可提高分泌表达效率[16-18]。信号肽在蛋白质合成过程中会被位于内质网腔表面的信号肽酶水解、切除,不会在重组蛋白上引入外源序列。
本研究采用BICS对比不同信号肽对SARS-CoV-2 S1、RBD、RBD 二聚体蛋白分泌表达量的影响,为疫苗的开发奠定基础,同时为BICS 表达其他外源蛋白时,N-端基因序列优化提供参考。
1 材料与方法
1.1 细胞及质粒 ExpiSf9TM细胞、pFastBac1TMdonor plasmid和DH10BacTMChemically Competent Cells(DH-10BacTM感受态细胞)均购自美国ThermoFisher Scientific Inc。
1.2 主要试剂及仪器 蛋白marker、Lipofectamine 3000、FBS、ExpiSf9 cells和ExpiSfTMCD Medium 均购自美国ThermoFisherScientificInc;SFX-InsectMedium、XK16/20 Column 和Ni Sepharose excel 均购自美国Cytiva 公司;Strep-Tactin®XT Superflow®resin 和Bio-tin购自德国IBA Lifesciences 公司;IPTG 即用型溶液、X-Gal 即用型溶液购自北京兰杰柯科技有限公司;氨苄西林(Amp)、卡那霉素(Kan)、庆大霉素(Gen)、四环素(Tet)、X-Gal 溶液、IPTG 溶液和新型一步法快速WB 试剂盒均购自生工生物工程(上海)股份有限公司;RBD蛋白、SARS-CoV-2 ELISA 检测试剂盒购自北京义翘神州科技股份有限公司;IC1000Countstar®自动细胞计数仪购自上海睿钰生物科技有限公司。
1.3 重组pFastBac1 转移载体的构建 使用SignalP 5.0在线软件对6种不同的信号肽进行分析。根据蛋白、N-端信号肽不同,以及C-端是否有Tag,共分25组,其中S1 蛋白编号A1 ~A9;RBD 蛋白编号B1 ~B8;RBD-dimer 蛋白编号C1 ~C8。委托生工生物工程(上海)股份有限公司进行密码子优化、基因合成、重组pFastBac1转移载体构建。
1.4 重组杆粒的构建 将25 种重组pFastBac1 载体转化DH10BacTM感受态细胞,进行蓝白斑筛选。挑取白斑,使用相同方法进行二次筛选。挑取3 个单克隆菌落,置于1 ~5 mL含Amp(终浓度50 μg/mL)的LB液体培养基中,37 ℃培养12 h。提取重组Bacmid 杆粒,使用M13 通用引物(上游:5′-GTTTTTCCCAGTCACGAC-3′,下游:5′-CAGGAAACAGCTATGAC-3′)进行PCR 鉴定。委托生工生物工程(上海)股份有限公司,根据目的基因序列设计引物对基因进行全序列测序后,向菌液中加入等体积的50%灭菌甘油,-80 ℃保存菌种。
1.5 三级毒种库的建立 使用Lipofectamine 3000 转染试剂,将25 种重组Bacmid 转染6 孔板中贴壁的昆虫细胞,27 ℃静置培养4 ~6 d;显微镜下观察到明显的细胞病变后,离心收集上清液,接种至摇瓶中悬浮培养,细胞活率降至50%左右时,收获培养上清液,加入2% FBS,经0.22 μm 滤膜过滤,制备原始毒种库,-80 ℃冻存。依次制备主代和工作毒种库。
1.6 细胞培养及表达
1.6.1 细胞生长曲线的绘制及接种和收获时间的确定 使用摇瓶培养Expisf9细胞,每天取样并计数,绘制细胞生长曲线。
将B2、C4 病毒分别接种至不同密度的细胞,分别为对数生长中前期(2.8 × 106个/mL)和对数生长中期(1.2×107个/mL),评价通过延后接种时间,提高接种病毒时的细胞密度是否可增加表达量。
比较接种病毒后第4 和第5 天离心上清中目的蛋白的表达量,确定最佳收获时间。
1.6.2 25 种病毒分泌表达量的检测 采用ELISA法。将25种病毒接种至10 mL(125 mL摇瓶)ExpiSf9TM细胞,传代至100 mL(500 mL 摇瓶)培养4 d 或细胞活率降至50%以下时,使用ELISA 试剂盒检测培养上清中的表达量。
1.6.3 重复验证 从A 系列蛋白(RBD 蛋白)中分别选择分泌表达量最高,且N-端带有不同信号肽的2 种病毒,再次培养,进行8%固定浓度SDS-PAGE、Western blot和表达量的重复验证。
1.7 放大培养及纯化 取B6 工作病毒1 支,放大培养至3 L(5 L 摇瓶),离心收集上清液,使用Ni Sepharose excel 和Strep-Tactin®XT Superflow®resin 填料进行2步纯化,并取样进行8%固定浓度SDS-PAGE分析。
1.8 数据采集及分析 使用OriginLabOriginPro 软件绘制细胞曲线。
2 结果
2.1 重组pFastBac1 转移载体的构建 使用SigalP 5.0 对6 种信号肽进行分析,结果见表1。根据不同组合,共构建25种重组pFastBac1转移载体,见图1。

表1 SigalP 5.0软件对6种信号肽的分析结果Tab.1 Evaluation results of 6 signal peptides by SigalP 5.0 software
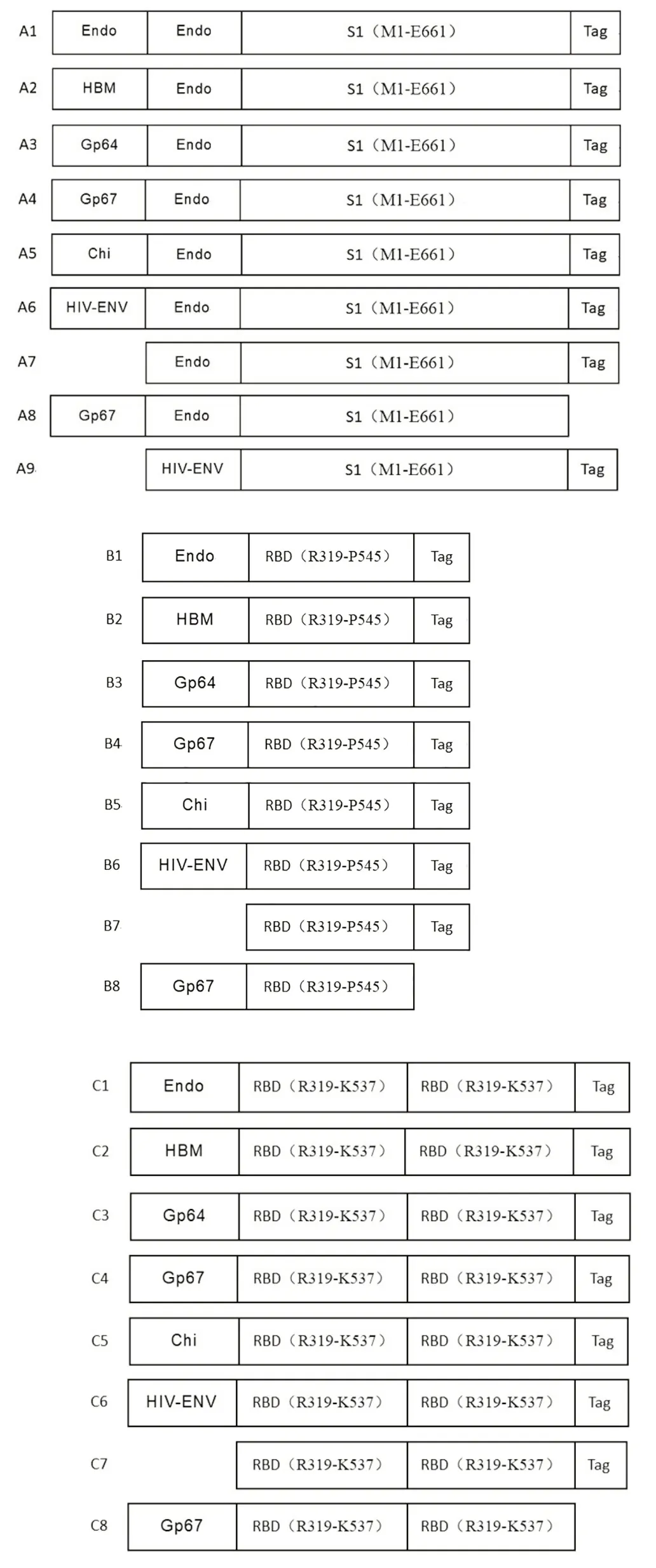
图1 25组重组基因构建示意图Fig.1 Construction schematic diagram of 25 recombinant genes
2.2 重组Bacmid 的鉴定 第1 次蓝白斑筛选,大部分为白斑;第2 次蓝白斑筛选,均为白斑。每组挑取3 个单克隆编号1 ~3,使用M13 引物,进行菌落PCR再次筛选,PCR 产物经1%琼脂糖凝胶电泳鉴定,条带大小符合(2 560 bp+目的基因)重组Bacmid 的大小,见图2。挑选A1-1、A2-2、A3-1、A4-2、A5-1、A6-2、A7-2、A8-1、A9-2;B1-2、B2-3、B3-3、B4-2、B5-3、B6-2、B7-2、B8-1;C1-1、C2-1、C3-2、C4-3、C5-1、C6-3、C7-1、C8-2编号的重组菌测序,结果无突变。
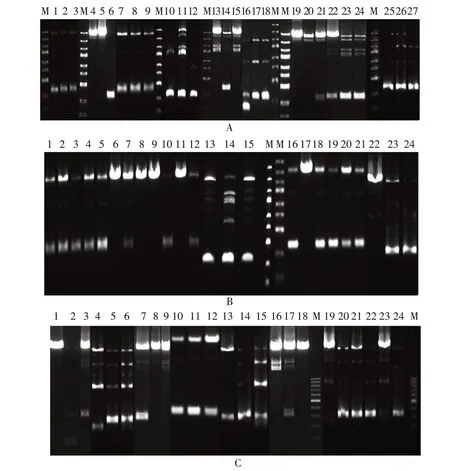
图2 阳性重组菌的菌落PCR鉴定Fig.2 Colony PCR identification of positive recombinant bacteria
2.3 三级毒种库的建立 A、B、C 系列的25 组重组Bacmid 杆粒转染6 孔板中贴壁的昆虫细胞,与未转染的对照细胞相比,细胞密度不再明显增加,细胞发生病变,直径变大,细胞内折光性强的颗粒增多,最后脱壁死亡,见图3。P0 代病毒接种悬浮培养的昆虫细胞,细胞直径变大,死亡,见图4。
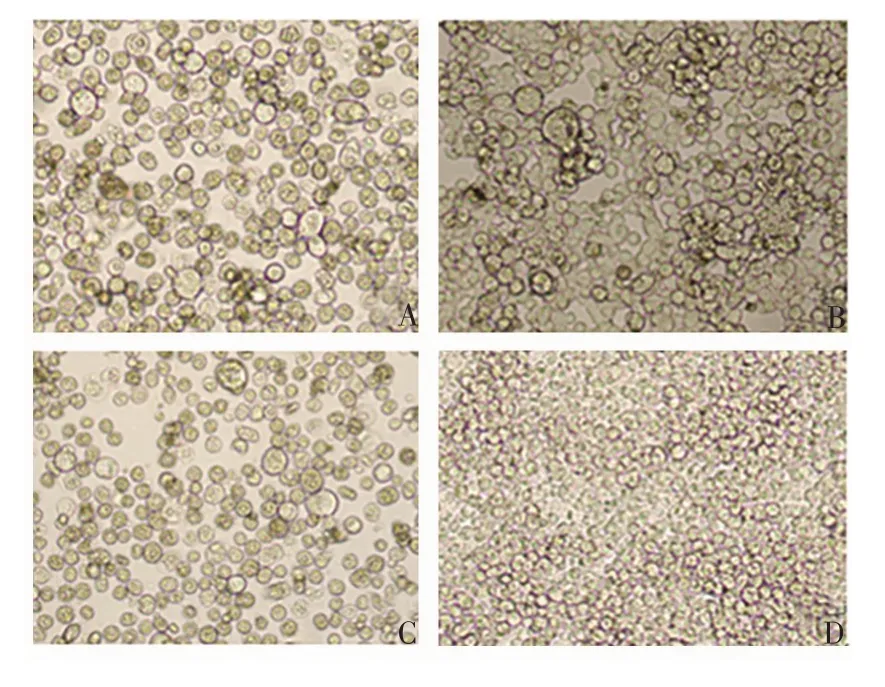
图3 转染后贴壁细胞的显微镜观察(×200)Fig.3 Microscopy of adherent cells after transfection(×200)
图4 接种病毒后悬浮细胞的显微镜观察(台盼蓝染色,×200)Fig.4 Microscopy of suspended cells after inoculation with virus(trypan blue staining,×200)
2.4 细胞培养及表达
2.4.1 细胞生长曲线及接种和收获时间的确定ExpiSf9 细胞生长速度较快,倍增时间短;对数期长,细胞密度高。细胞生长曲线见图5。将B2、C4病毒分别接种至不同密度的细胞中,分泌表达量无明显提高;接种病毒后4 d的分泌表达量明显高于5 d。见表2。

表2 病毒接种至不同生长时期细胞不同时间的分泌表达量(mg/L)Tab.2 Secretory expression of cells at different growth stages after virus inoculation for different time duration(mg/L)
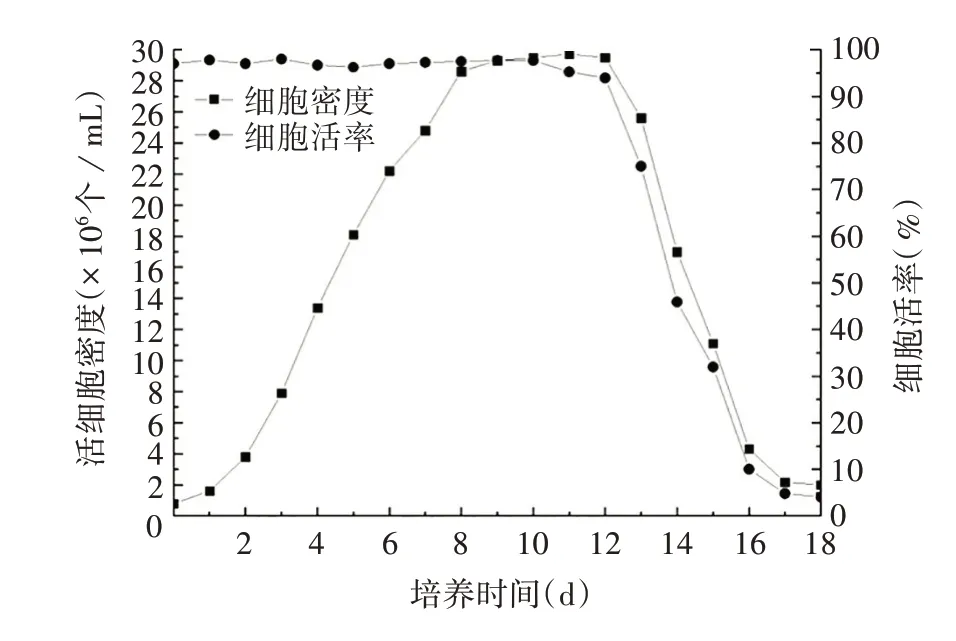
图5 ExpiSf9细胞的生长曲线Fig.5 Growth curve of Expisf9 cells
2.4.2 25 种病毒的分泌表达量 ELISA结果显示,在A 系列(S1 蛋白)中,A8 和A4(Gp67 信号肽)的表达量最高,其次是A9(N-端含HIV-ENV 信号肽);在B系列(RBD 蛋白)中,B6(HIV-ENV 信号肽)的表达量显著高于其他组,其次为B4(Gp67 信号肽);在C 系列(RBD 二聚体蛋白)中,C4(Gp67 信号肽)的表达量最高,其次是C3(Gp64信号肽)。见表3。

表3 25种病毒培养上清液的分泌表达量(mg/L)Tab.3 Secretory expression of culture supernatant of 25 viruses(mg/L)
2.4.3 重复验证 选择A4和A9进行重复验证,SDSPAGE 和Western blot 分析显示,二者均有清晰的目的条带(S1 蛋白相对分子质量约75 000),表达量接近,见图6。2 次传代培养上清中抗原表达量一致性好,A4稍高于A9,结果与初次试验一致,见表4。
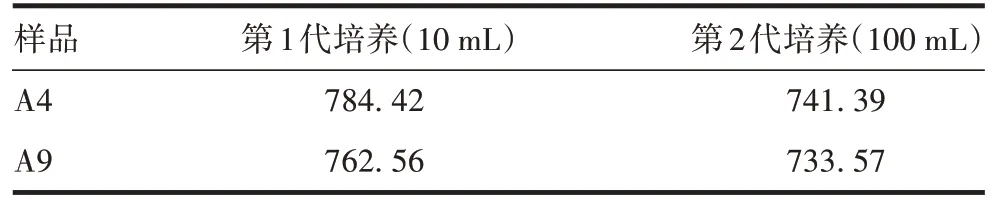
表4 重复验证培养上清液的分泌表达量(mg/L)Tab.4 Secretory expression of culture supernatant in repeated verification(mg/L)
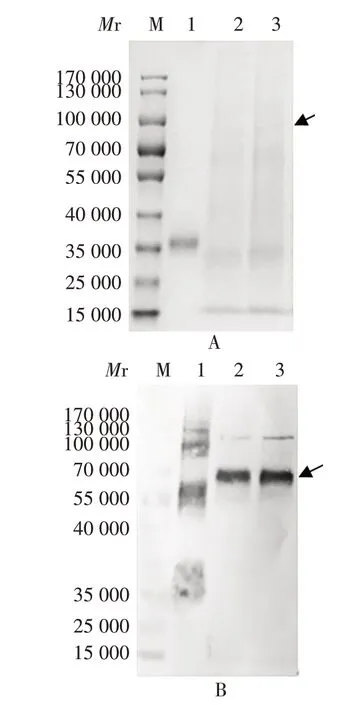
图6 重复验证SDS-PAGE(A)和Western blot(B)结果Fig.6 SDS-PAGE(A)and Western blot(B)results in repeated verification
2.5 放大培养及纯化 选择B6放大培养至3 L,经镍柱和Strep-Tactin®XT 柱纯化获得RBD 蛋白,见图7和图8。
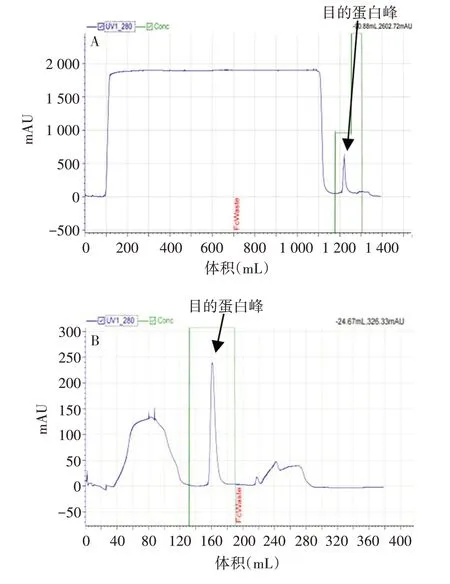
图7 层析图谱Fig.7 Chromatogram of purification

图8 培养体积放大至3 L的SDS-PAGE分析Fig.8 SDS-PAGE analysis after culture volume was enlarged to 3 L
3 讨论
ELISA 检测结果显示,不同信号肽组之间分泌表达量差异明显:A1 组(N-端为原始序列的S1-tag)的分泌表达量显著低于A9(N-端截短S1-tag),表明S蛋白N-端序列严重降低了S 蛋白在昆虫细胞中的分泌表达量;含Gp67 信号肽的3 种蛋白的分泌表达量均较高,其中S1 和RBD 二聚体蛋白分泌表达量最高的信号肽为Gp67,RBD 蛋白分泌表达量最高的是信号肽HIV-ENV,表明蛋白的氨基酸序列不同,最适信号肽在一定程度上会有差异。而C-端和N-端添加标签对蛋白的分泌表达无明显影响。另外,通过增加传代后的培养时间,可提高细胞密度,但接种病毒后,并不能明显提高表达量,表明表达量的提高取决于多种因素,主要是细胞状态及接毒后是否有充足的营养供应,蛋白表达时,有必要在细胞生长过程中,特别是接种病毒后,进行补料。重组蛋白的表达产量决定了工艺的难易程度、成本和产品竞争力。影响重组蛋白的表达产量有很多因素,如改造宿主,优化培养基、培养过程、调控序列、蛋白结构等[19-22]。蛋白质的分泌过程是关键步骤之一,极大地限制了重组蛋白的产量和质量。信号肽在指导和有效地将分泌蛋白转运至细胞内质网中发挥着重要作用[23-24]。通过优化信号肽和补料分批培养,可显著增强目的蛋白的分泌和表达[25-26]。本研究结果显示,S1 与RBD 二聚体蛋白分泌表达量最高的信号肽相同,是GP67 信号肽,而RBD 蛋白的最适信号肽是HIV-ENV 信号肽。表明N-端序列会影响蛋白的分泌,信号肽序列有一定的通用性,但也与要表达的目的蛋白序列有关。

