原型株及变异株SARS-CoV-2灭活疫苗在大鼠体内的免疫原性评价
徐康维,许丽,鲁旭,李晶,戈小琴,王开芹,权娅茹,李长贵
1.中国食品药品检定研究院国家卫生健康委员会生物技术产品检定方法及其标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室,北京 102629;2.北京科兴生物制品有限公司,北京 100085;3.北京科兴中维生物技术有限公司,北京 102601
自2019 年末,SARS-Cov-2 在全球范围内迅速传播[1-3]。近年,各种变异株不断出现,WHO 将变异株分为值得关注变异株(variant of concern,VOC)和待观察变异株(variant of interest,VOI)两类。VOC是指传播性、严重程度和/或免疫力有重大变化,可能对流行病学状况产生影响的变异株,如Alpha 株(B.1.1.7)、Beta 株(B.1.351)、Gamma株(P.1)、Delta株(B.1.617.2)和Omicron 株等[4],这些VOC 在Spike蛋白的受体结合位点区域(receptor binding domain,RBD)和N-末端结构域(N-terminal domain,NTD)均有突变。2020年10月,于南非首次发现Beta株(B.1.351)[5],与原型株比较,在Spike蛋白中有9个氨基酸位点突变,其中3个突变(K417N、E484K和N501Y)位于RBD中,可能使其与宿主细胞血管紧张素转换酶(angiotensin converting enzyme,ACE)受体的结合亲和力更高[6-8]。2021 年1 月,于美国首次发现Gamma 株(P.1)[9],该毒株Spike 蛋白中包含10 个突变,RBD 中也有3 个突变(L18F、K417N 和E484K)。2021 年3 月,于印度首次发现Delta 株,该毒株具有更强的传播能力和致病力。2021年6月—2021年底,Omicron突变株成为全球主要流行毒株,其Spike 蛋白中包含10个突变[10]。
上述突变株的出现降低了现有疫苗的保护能力[8,11-12],因此,广谱疫苗的研发成为研究热点,部分疫苗在动物实验中已显示出一定的广谱保护效果,但目前尚无相关产品上市[13-16]。研发针对变异株的疫苗是更现实的解决方案,目前,已有多种针对变异株的mRNA疫苗、重组疫苗及灭活疫苗处于临床前或临床研究阶段[17-21]。本研究采用原型株及Beta 株(B.1.351)、Gamma株(P.1)、Delta株(B.1.617.2)制备的SARS-Cov-2灭活疫苗分别免疫大鼠,评价其免疫原性,以期为该疫苗候选疫苗株的选择提供参考。
1 材料与方法
1.1 病毒及细胞 SARS-Cov-2原型株(CZ01)、Beta 株(B.1.351)、Gamma株(P.1)、Delta株(B.1.617.2)和Vero细胞均由北京科兴中维生物技术有限公司提供。
1.2 疫苗 原型株、Beta 株、Gamma株、Delta株SARSCoV-2 灭活疫苗原液及成品均由北京科兴中维生物技术有限公司生产(各株病毒的Vero 细胞培养液经β-丙内酯灭活、超滤及柱纯化获得疫苗原液,稀释后与氢氧化铝佐剂混合,制备为疫苗成品,疫苗蛋白含量均为6 μg/mL[22])。
1.3 主要试剂 BSA 购自美国Sigma 公司;HRP 标记的羊抗兔IgG 购自荷兰Nordic Mubio 公司;199 培养基购自美国Gibci公司。
1.4 实验动物 SPF 级Wistar 大鼠,雌性,6 周龄,体质量180~220 g,由斯贝福(北京)生物技术有限公司提供,实验动物生产许可证号为:SCXK(京)2019-0010,实验动物使用许可证号为:SYXK(京)-2020-0054。本实验对大鼠的所有处理均以科研为目的,且按照中检院《实验动物福利伦理审查指导原则》等动物伦理相关规定进行[文件号:中检动(福)第2021(B)023号]。
1.5 动物免疫 分别采用1.2 项中4 种SARS-CoV-2灭活疫苗经大腿肌内免疫大鼠,3 μg 病毒蛋白/(0.5 mL·只),间隔14 d 再次免疫,免疫剂量及途径同上,同时设阴性对照组(生理盐水),每组5 只。初次免疫后14、28和42 d,经静脉采血,分离血清。
1.6 大鼠血清IgG抗体水平的检测 采用间接ELISA法[23-24]。用PBS 缓冲液(pH 7.2)分别将疫苗原液稀释至蛋白浓度为1 μg/mL,加入96孔板,100 μL/孔,4 ℃孵育过夜;PBST洗涤5次,加入封闭液(含1%BSA的PBS),200 μL/孔,室温孵育1 h;加入大鼠血清(用封闭液进行800倍稀释后,再进行2倍系列稀释,共11 个稀释度),100 μL/孔,室温孵育2 h;PBST 洗涤5 次,加入HRP 标记的羊抗兔IgG(用封闭液按1∶5 000 稀释),室温孵育1 h;PBST 洗涤5 次,加入TMB 显色底物,100 μL/孔,室温显色15 min;加入0.5 mol/L 的硫酸,50 μL/孔,终止反应,用酶标仪检测A450/630。以>2.1 倍空白孔A450/630的最高稀释度作为血清效价;血清效价<800时,记为400。
1.7 大鼠血清中和抗体水平的检测 采用微量中和试验,需在生物安全三级实验室内完成[23-24]。将大鼠血清样本于56 ℃水浴灭活30 min,用199 培养基进行4倍稀释;将199培养基加入96孔板,50 μL/孔,再加入等体积分数的稀释血清(2 倍系列稀释,共11个稀释度),每份血清设2 个复孔;用199 培养基将SARS-CoV-2稀释至100 CCID50/50 μL,加入96孔板,50 μL/孔,37 ℃,5%CO2培养箱中静置中和120 min;将Vero细胞稀释至(1.2~2.0)×105个/mL,加入96孔板,100 μL/孔,继续培养5 d;显微镜下观察细胞病变情况。以半数细胞出现病变的稀释度计为血清中和抗体效价,中和抗体效价<8 按4 计算,≥8 判为中和抗体阳转,并计算抗体效价的几何均值(geomeric mean titer,GMT)。
1.8 抗原比的计算 参照流感病毒抗原性差异评价方法,以R =公式对血清中和抗体效价的结果进行抗原比计算(r1 为甲血清对乙病毒的中和效价/甲血清对甲病毒的中和效价;r2 为乙血清对甲病毒的中和效价/乙血清对乙病毒的中和效价),R表示两株病毒间抗原性差异,1 ≤R <1.5时表明两株病毒抗原性无明显差异;1.5 ≤R <2 时表明两株病毒抗原性差异较小;R ≥2 时表明两株病毒抗原性有明显差异。R <1时则取倒数进行评价[25]。
1.9 数据采集及分析 应用EXCEL 2019 软件进行数据采集及分析,GraphPad Prism 8软件进行作图。
2 结果
2.1 大鼠血清IgG 抗体水平 初次免疫后14 d,大鼠血清中即可检测到IgG抗体;初次免疫后28 d,IgG抗体效价较14 d提高10倍以上;初次免疫后42 d,IgG抗体效价较28 d略有下降,但仍高于14 d。各毒株免疫后血清不仅具有较高水平的相应毒株IgG抗体,对其他3个毒株也具有较高的IgG抗体效价。见表1。
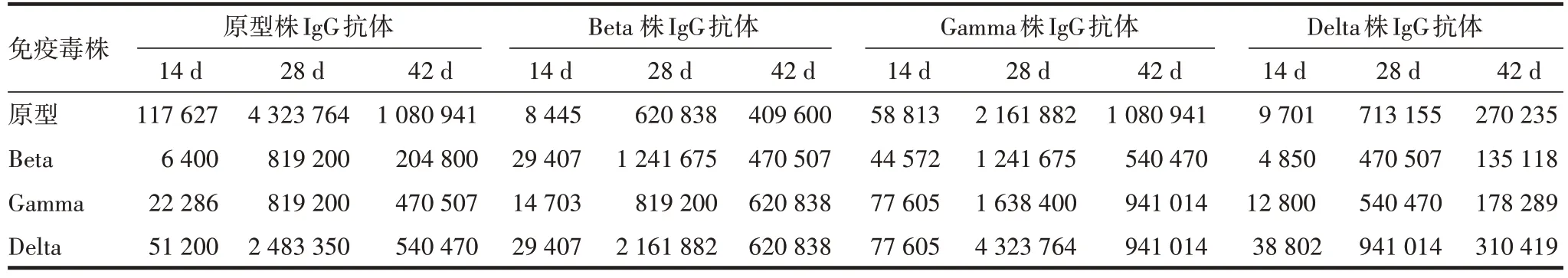
表1 ELISA法检测大鼠免疫血清IgG抗体水平Tab.1 Detection of serum IgG antibody titers in immunized rats by ELISA
2.2 大鼠血清中和抗体水平 初次免疫后14 d,多数大鼠血清可检测到中和抗体,其中原型株和Delta 株疫苗免疫血清针对4株病毒的中和抗体均阳转;Beta株疫苗免疫血清针对Beta株和Gamma株病毒中和抗体均阳转,针对原型株中和抗体阳转率为80%,针对Delta 株中和抗体阳转率为40%;Gamma 株疫苗免疫血清针对Beta 株和Gamma 株病毒的中和抗体均阳转,针对原型株和Delta株中和抗体阳转率均为80%。Delta 株疫苗免疫血清对Delta 毒株的中和抗体效价最高,GMT为366;Beta 株疫苗免疫血清对Delta毒株的中和抗体效价最低,GMT为5。初次免疫后28 d,4种毒株免疫血清中和抗体均阳转,中和抗体效价较14 d 有大幅升高。初次免疫后42 d,中和抗体效价较28 d 总体略有下降,其中Delta 株疫苗免疫后针对4株毒株均具有较高的中和抗体效价,提示该疫苗具有较好的免疫原性。各毒株疫苗免疫后血清与相应毒株的中和效价最高,与其他毒株的中和效价降低。见表2。

表2 微量中和试验检测大鼠血清中和抗体效价(GMT)Tab.2 Detection of neutralizing antibody titers in rat serum by microneutralization(GMT)
2.3 不同毒株间的抗原比以初次免疫14 和28 d 大鼠血清中和抗体GMT 计算抗原比,4 株病毒间抗原比为2.3~8.1,均>2;以初次免疫后42 d 大鼠血清中和抗体GMT 计算抗原比,4 株病毒间抗原比为1.6~4.0,其中Beta 株与Gamma 株间抗原比为1.6,原型株与Gamma 株间抗原比为1.8,抗原性差异较小。见表3。
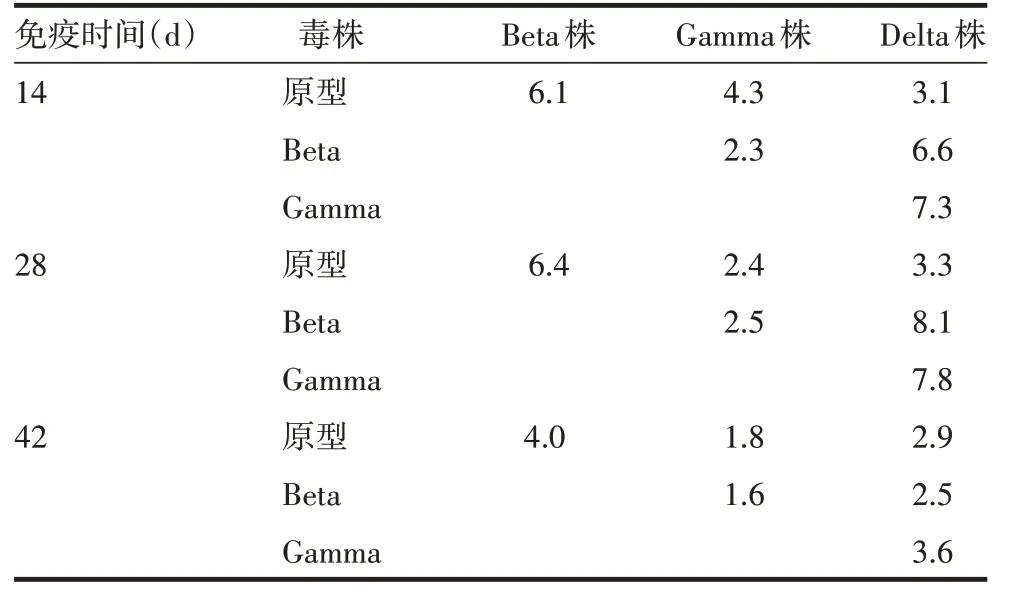
表3 不同SARS-CoV-2毒株间的抗原比Tab.3 Antigenic ratios between different strains of SARS-CoV-2
3 讨论
随着SARS-CoV-2 不断进化和变异,导致疫苗的保护效果逐步降低,研究显示,SARS-CoV-2 原型株感染患者血清对Beta 株的中和效价平均降低了9.4倍,原型株mRNA 疫苗免疫血清中和效价降低了10.3~12.4 倍[26];SARS-CoV-2 原型株感染患者血清对Gamma株中和效价平均降低了3.4倍,SARS-CoV-2原型株mRNA 疫苗免疫血清对Gamma 株血清中和效价降低了3.8~4.8 倍[8],SARS-CoV-2 原型株感染患者血清对Delta 株中和效价降低约2 倍[27],因此需要研发更加有效的疫苗。
本研究采用原型株、Beta 株、Gamma 株和Delta株SARS-CoV-2 制备的灭活疫苗对大鼠进行免疫,结果显示,原型株或Delta 株疫苗初次免疫后14 d,大鼠血清对4株病毒的中和抗体全部阳转;采用Beta株和Gamma株疫苗免疫的大鼠血清对Beta株和Gamma株病毒的中和抗体全部阳转,针对原型株或Delta 株病毒的中和抗体部分阳转。加强免疫后,所有大鼠血清中和抗体均阳转,且中和抗体效价较14 d 有大幅升高。总体上,Beta 株和Gamma 株疫苗免疫大鼠血清中和抗体水平较低,原型株和Delta 株疫苗免疫大鼠血清中和抗体水平较高。Delta 株疫苗免疫后42 d 的大鼠血清对4 株病毒均具有较高的中和抗体效价,提示该疫苗可能具有较好的免疫原性。参照不同毒株流感病毒抗原性差异的分析方法[20],本研究还对上述4株SARS-CoV-2 的抗原比进行了分析,结果显示,Beta 株与Gamma 株间,原型株与Gamma 株间抗原性差异较小,原型株与Beta 株间抗原性差异较大,这与WANG 等[26]实验结果一致。初次免疫后42 d,各毒株抗原性差异较14和28 d小,提示随着抗体亲和力的成熟,大鼠产生了更多针对不同毒株间较为保守的中和表位的抗体。本研究对SARS-CoV-2灭活疫苗研发毒株的选择提供了参考。

