呼吸道合胞病毒重组F蛋白疫苗的制备及免疫效果评价
王晶,卢井才,宋月爽,王宇迪,于洋,赵永红,张鑫,付璐,刘大维,姜春来
1.吉林农业大学生命科学学院,吉林 长春 130118;2.长春百克生物科技股份公司,吉林 长春 130012
呼吸道合胞病毒(respiratory syncytial virus,RSV)是造成婴幼儿与老年人呼吸道疾病的主要病原体之一[1]。当机体免疫力低下时,RSV 可引起上呼吸道感染,严重者可导致支气管炎和肺炎,甚至死亡,严重威胁婴幼儿及老年人的生命和健康。据报道,全球每年因RSV 感染住院的儿童约320 万例,死亡人数可达12万例,主要发生在发展中国家[2];在一些经济发达国家,每年因感染RSV 而住院的老年人占总人群的14.5%,其中死亡约5.5 万例[3]。RSV 感染后产生的保护性免疫为一过性免疫,因此,感染后易发生再次感染[4],给医疗系统造成了沉重的疾病负担[5]。在适宜的气候中,RSV 感染每年有1次感染高峰,主要集中在冬春季,维持4 ~6 个月,具有明显的季节性[6]。由于RSV 具有传染性,接种RSV 疫苗是预防RSV 感染最有效的方式,但目前国内尚无有效的疫苗上市。
RSV 属于副黏病毒科肺炎病毒属,有包膜,基因组全长15 200 bp[7]。病毒包膜上有黏附蛋白(attachment glycoprotein,G)、融合蛋白(fusion protein,F)和小疏水蛋白(small hydrophobic protein,SH)3 种表面蛋白,其中,G 和F 蛋白对RSV 病毒粒子的黏附和入侵十分重要,也是病毒表面的主要保护性抗原[8]。G蛋白主要介导病毒与宿主细胞的黏附,根据G 蛋白抗原性不同可将RSV 分为A、B 两个亚型[9]。F 蛋白介导病毒与宿主细胞膜融合,其具有较高的保守性[10],可刺激机体产生具有型交叉保护性中和抗体,因此成为目前疫苗研发的热点蛋白[11],F 蛋白也是目前商用RSV 抗体的主要靶抗原。在RSV 感染过程中,F 蛋白有两种构象:融合前F 蛋白构象(pre-fusion F,pre-F)和融合后F 蛋白构象(post-fusion,post-F)[12]。使用结构明确的免疫原进行免疫能够诱导机体产生高中和活性的抗体,预防RSV 感染[13]。随着对RSV结构等方面研究的不断深入,对RSV F 蛋白结构、抗原性和免疫原性的理解显著提高,为RSV 疫苗的开发奠定了良好的基础。
目前,以pre-F 构象为靶点的候选疫苗最有前途,因为这种融合前形式可诱导更强的RSV 中和抗体,且比帕利珠单抗强10 ~100倍[14]。RIGTER 等[15]开发了一种基于pre-F 的安全有效的鼻内亚单位疫苗,发现融合前特异性抗体D25和AM22可识别重组F 蛋白,并将pre-F 与细菌样颗粒-F(bacterial like particle-F,BLP-F)结合后,经小鼠或棉花大鼠的鼻内进行接种,结果发现,能够有效诱导F 特异性免疫球蛋白(IgG),并在RSV 攻毒时显著降低肺中的病毒滴度。此外,与接种福尔马林灭活RSV 疫苗的动物相比,接种BLP-F 的动物诱导了高水平的F 特异性IgA(sIgA)抗体和血清RSV 中和抗体,且未表现出任何疾病增强的症状。
来源于母体的免疫是新生儿对传染病最主要的早期防御[16],可通过对孕妇进行免疫接种,增加母体抗体向婴儿的转移,以预防新生儿及6 月龄内婴儿严重的RSV 相关疾病。因此,这种被动保护对婴儿来说是一个很好的选择。对于这种母传免疫,注射疫苗能够诱导更强烈的全身免疫应答。预防性单克隆抗体也是预防RSV 感染的一个有效手段,目前已获得批准使用的预防性单克隆抗体包括Palivizumab和Nirsevimab。Palivizumab 是获得美国食品药品管理局(Food and Drug Administration,FDA)批准用于预防RSV 感染的单克隆抗体[17],但其使用具有局限性,不能用于RSV 感染后治疗,且需反复注射、费用昂贵,目前未在国内上市[18]。Nirsevimab 是2022 年11 月被欧盟(European Union,EU)批准用于预防新生儿和婴儿由RSV 所致下呼吸道疾病的单克隆抗体[19],作为一种被动免疫疗法,能够直接为婴儿提供免疫力,以单剂量肌肉注射在整个RSV 季节内提供针对RSV的即时保护。疫苗是预防RSV感染的最有效方式,目前,美国FDA已批准两种预防老年人RSV感染的疫苗:GSK 公司研制的Arexvy 以及Pfizer 公司研制的Abrysvo。
本研究制备了一种RSV pre-F,并在动物模型中比较两种免疫途径(鼻内和注射)的效果。两种不同免疫途径的RSV 候选疫苗分别为与BLP结合的鼻内疫苗(BLP-F)和与铝佐剂配制的注射疫苗(AL-F)。BLP 是近年来发现的新型佐剂,其主要成分为肽聚糖,因其大小和形状与细菌相似,因此被命名为细菌样颗粒[20],其生物材料来源于乳酸乳球菌。与其他常见的黏膜免疫佐剂相比,BLP 在安全性方面具有良好的优势。乳酸乳球菌是一种革兰阳性益生菌,广泛应用于食品工业,被认为是安全的食品级微生物[21]。由于乳酸乳球菌具有生长速度快、易于操作和遗传背景清楚等特点,常被用作基因工程的宿主菌[22]。随着分子生物学的发展,乳酸乳球菌作为载体在递呈病毒、细菌抗原等方面得到了广泛应用[23]。铝佐剂在人用疫苗生产中应用最广泛[24],已使用近百年。疫苗中铝佐剂主要包括氢氧化铝[Al(OH)3]佐剂、磷酸铝佐剂和无定形羟基磷酸铝硫酸盐佐剂,其中Al(OH)3佐剂和磷酸铝佐剂使用较广泛[25],本研究选用的为Al(OH)3佐剂。在小鼠模型中,根据血清中的IgG抗体、中和抗体水平以及黏膜中的sIgA水平对这两种免疫途径的RSV疫苗进行评估。以期为优化疫苗设计提供指导,并对不同RSV 感染的高危人群提供免疫思路。
1 材料与方法
1.1 质粒、细胞、细菌及病毒 pcDNA 3.1载体、CHO细胞与和乳酸乳球菌由荷兰MUCOSIS 公司提供;RSV(A/Long)和Hep-2细胞购自ATCC。
1.2 实验动物 40只SPF级BALB/c小鼠,雌性,6 ~8 周龄,体质量18 ~26 g,购自中国食品药品检定研究院,合格证号:1112511911004180。所有实验均得到BCHT 机构动物护理和使用委员会批准(BCHTAEEI-2018-001),并按照已批准的指南执行。
1.3 主要试剂及仪器 胎牛血清购自美国Gibco公司;Lentil lectin sepharose 4B柱购自美国GE公司;Al(OH)3佐剂购自美国ACCURATE 公司;F 蛋白标准品由荷兰MUCOSIS 公司提供;丙烯酰胺、双甲基丙烯酰胺、十二烷基磺酸钠和PVDF 膜购自北京Promega 生物技术有限公司;异氟醚购自上海吉至生化科技有限公司;山羊抗小鼠IgG-HRP和山羊抗小鼠IgA-HRP购自美国Southern Biotech 公司;三氯乙酸购自天津光复精细化工有限公司;甲基α-D-吡喃甘露糖苷购自上海圻明生物科技有限公司;抗RSV F 蛋白小鼠单克隆抗体购自ABMAX Product List 京天成生物技术(北京)有限公司;TMB 购自美国Sigma 公司;ELISA试剂盒购自深圳欣博盛生物科技有限公司;酶标仪购自TECAN 上海贸易有限公司;凝胶成像系统购自耶拿分析仪器(北京)有限公司。
1.4 基因构建及表达 选择欧洲RSV 血清型A 分离株F 蛋白26-515 残基对应的基因片段,并将两个碱性furin 酶切位点中精氨酸突变为赖氨酸(即将RARR突变为KAKK,将KKRKRR突变为KKKKKK)[15,26]。再将该基因序列根据人类密码子偏好进行序列优化并合成基因序列。将目的基因插入pcDNA3.1 载体中,合成的编码基因序列克隆至CD5 信号肽DNA 序列下游的框架中;将人工GCN4异亮氨酸三聚体基序和LysM 肽聚糖结合域添加至F26-515蛋白编码序列的C-端[15,27]。再将含RSV F26-515 序列的pcDNA3.1表达载体转染至CHO 细胞中,37 ℃,5% CO2条件下进行扩增培养表达F蛋白。收集细胞培养上清,利用Lentil lectin sepharose 4B 柱纯化F 蛋白,甲基α-D-吡喃甘露糖苷洗脱[28]。结合后的重组F26-515 蛋白进行Western blot 鉴定[15]:蛋白经12% SDS-PAGE 分离后,转移至PVDF 膜上;PBS 洗涤1 次,用含5%脱脂奶粉的PBS 封闭,置脱色摇床上振荡孵育1 h;PBST洗膜3 次,每次10 min,加入抗RSV F 蛋白小鼠单克隆抗体(用封闭液稀释1 000 倍),室温振荡孵育1 h;PBST洗膜3次,每次10 min,加入山羊抗小鼠IgG-HRP(用封闭液稀释5 000 倍),室温振荡孵育1 h;PBST洗膜3次,每次10 min,加入配好的DAB显色发光液,避光显色5 min;最后加入终止液H2SO4终止显色。以此对重组F26-515蛋白进行鉴定。
1.5 BLP 佐剂的制备 乳酸乳球菌培养后,经热酸处理,用磷酸盐缓冲盐水(PBS)洗涤,再通过离心或超滤方式纯化,获得BLP[29]。
1.6 疫苗的制备
1.6.1 BLP-F 疫苗 将纯化的F 蛋白与BLP 佐剂在18 ~25 ℃下混合30 min,PBS洗涤3次去除未结合蛋白,得到BLP-F RSV疫苗[21,30],2 ~8 ℃保存。12%SDSPAGE 分析F 蛋白与BLP 的结合,通过BLP-F RSV 疫苗与F蛋白标准品电泳条带灰度的比较,计算与BLP结合的蛋白量。
1.6.2 AL-F疫苗 将纯化后的F蛋白稀释至400μg/mL,与1 mg/mL Al(OH)3佐剂按照体积分数1∶1 混合,2 ~8 ℃摇床混匀过夜,即为AL-F疫苗。
1.7 疫苗的免疫原性评价
1.7.1 动物分组及免疫 将40只BALB/c小鼠随机分为4 组:BLP-F、BLP 对照、AL-F 和AL 对照组,每组10 只。BLP-F 和BLP 对照组经鼻内接种,AL-F 和AL对照组经皮下接种。采用异氟醚麻醉小鼠,BLP-F和BLP 对照组接种剂量为10 μL,AL-F 和AL 对照组接种剂量为100 μL,分别于第0、14、28 天各免疫1次。末次免疫后2周,经眼眶采血,分离血清,-80 ℃下保存。用0.5 mL 含完全蛋白酶抑制剂的PBS 冲洗鼻咽,获得洗鼻液,5 000 ×g离心20 min,-80 ℃保存。
1.7.2 ELISA抗体效价检测 用抗原包被缓冲液将F蛋白稀释为500 ng/mL 后加入96 孔板,100 μL/孔,4 ℃包被过夜;PBST 洗涤3 次;加入封闭液(含1%牛血清蛋白),200 μL/孔,37 ℃封闭2 h;PBST 洗涤,加入系列稀释的样品(用含1%牛血清蛋白的PBS 溶液从1∶8开始2倍系列稀释),37 ℃孵育45 min;PBST洗涤,加入山羊抗小鼠IgG-HRP 或山羊抗小鼠IgAHRP(1∶5 000稀释),100 μL/孔,37 ℃孵育1 h;PBST洗涤,加入TMB,100 μL/孔,显色15 ~30 min;加入H2SO4终止液,酶标仪450 nm 波长处读取吸光度值。试验中设立IgG 标准曲线。血清中IgG 抗体水平通过标准曲线进行计算。黏膜IgA 效价为样品稀释倍数的倒数,背景A450≥0.1。
1.7.3 中和抗体效价检测 采用空斑试验。用含2.5%胎牛血清的DMEM-Ham′s F12 稀释热灭活的血清样品至1∶8,再2 倍系列稀释,加入96 孔板,每孔再加入500 PFU RSV(A/Long),37 ℃孵育2 h;接种Hep-2 细胞,37 ℃,5% CO2培养箱中孵育5 ~6 d;用4.0%甲醛溶液和0.05%结晶紫固定细胞24 h。以可降低50%细胞病变的抗体稀释度的倒数作为中和抗体效价。
1.8 统计学分析 利用GraphPad Prism 9.0软件进行统计分析。实验数据以平均值±标准差表示,组间差异的比较采用t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 表达及纯化F蛋白的鉴定 纯化的F蛋白经12%SDS-PAGE 分析,可见相对分子质量约100 000 的目的条带,见图1。经Western blot 进一步确认,该蛋白为RSV F蛋白。
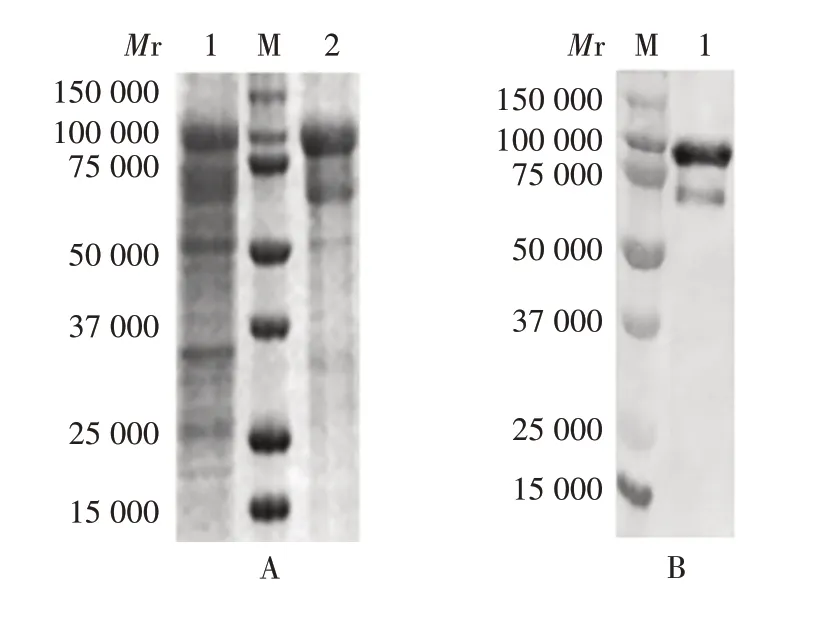
图1 纯化F蛋白的SDS-PAGE和Western blot鉴定Fig.1 Identification of purified F protein by SDS-PAGE and Western blot
2.2 重组F蛋白与BLP的结合12%SDS-PAGE 分析显示,与BLP对照相比,F蛋白成功与BLP结合,见图2。条带定量分析显示,BLP可有效结合F蛋白,其结合能力约为50 μg F蛋白/mg BLP。
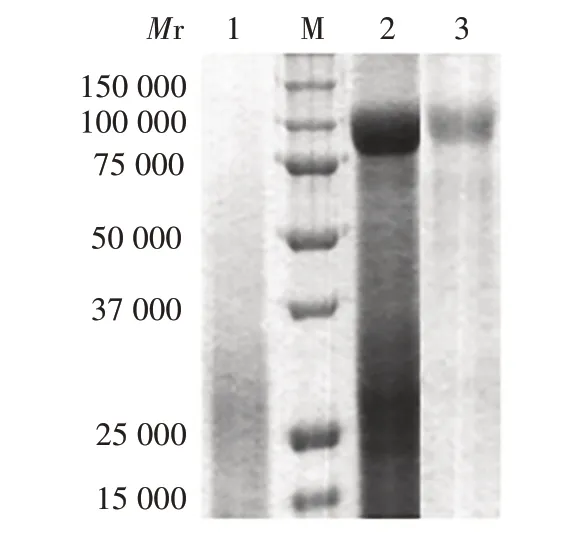
图2 F蛋白与BLP结合的SDS-PAGE分析Fig.2 SDS-PAGE analysis of binding of F protein to BLP
2.3 疫苗的免疫原性
2.3.1 黏膜与注射疫苗诱导小鼠血清IgG 抗体效价的比较 与对照组相比,BLP-F 黏膜疫苗和AL-F 注射疫苗均能诱导较高水平的血清抗F 抗体;AL-F 注射疫苗诱导的特异性抗F 抗体水平明显高于BLP-F黏膜疫苗(t=-4.38,P=0.007)。见图3。表明黏膜疫苗和注射疫苗均能诱导血清中的全身免疫应答。
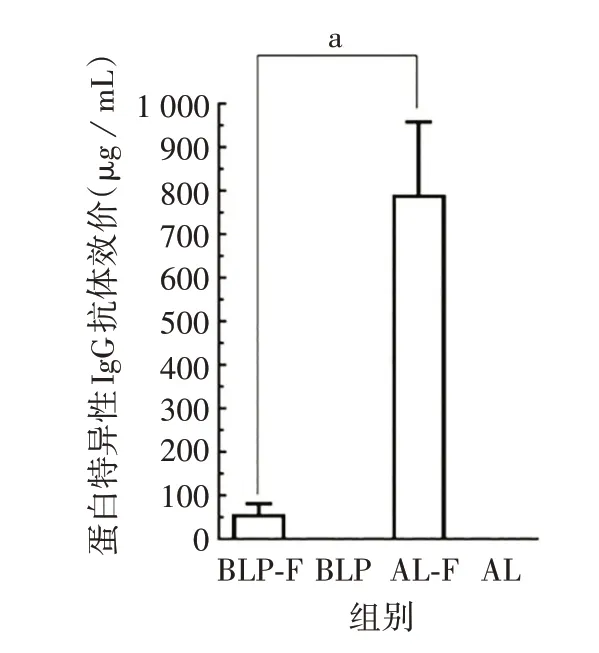
图3 两种RSV 疫苗免疫小鼠血清中F蛋白特异性IgG 抗体效价Fig.3 F protein-specific IgG titers in serum of mice immunized with two RSV vaccines
2.3.2 黏膜与注射疫苗诱导小鼠鼻腔IgA 抗体效价的比较 与对照组相比,BLP-F 黏膜疫苗在免疫后的小鼠鼻洗液中诱导了更高水平的针对F 蛋白的特异性IgA 抗体,而AL-F 注射疫苗不能诱导黏膜特异性IgA 抗体,见图4。表明仅黏膜疫苗能够诱导黏膜特异性IgA抗体免疫应答。
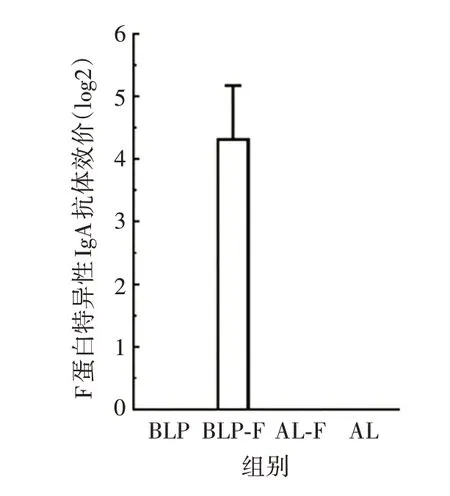
图4 两种RSV 疫苗免疫小鼠鼻洗液中F 蛋白特异性IgA抗体效价Fig.4 Titer of F protein-specific IgA antibody in nasal lotion of mice immunized with two RSV vaccines
2.3.3 黏膜与注射疫苗诱导小鼠血清中和抗体效价的比较 与对照组相比,BLP-F 黏膜疫苗和AL-F 注射疫苗均能诱导较高水平的中和抗体,AL-F 注射疫苗诱导的中和抗体滴度显著高于BLP-F 黏膜疫苗(t=-3.92,P=0.011)。见图5。
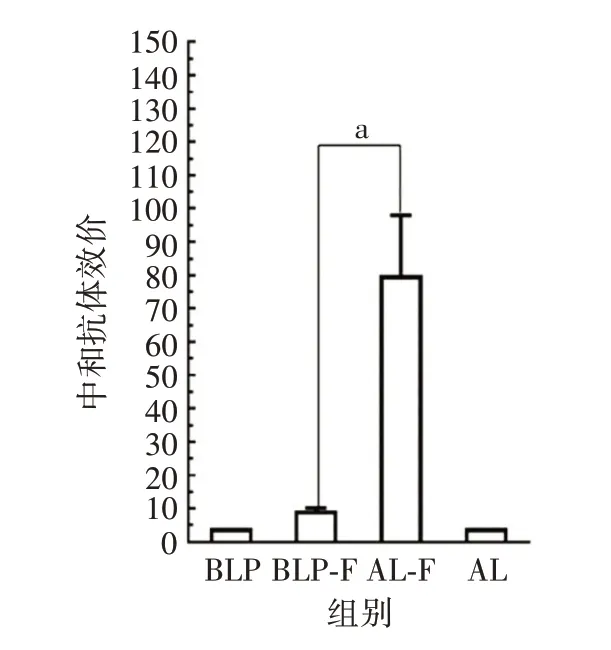
图5 两种RSV疫苗免疫小鼠血清中和抗体效价Fig.5 Neutralizing antibody titers in serum of mice immunized with two RSV vaccines
3 讨论
RSV 是一种具有传染性的病原体,主要通过呼吸道传播,引起婴幼儿及老年人的呼吸道疾病。虽然接种疫苗是预防RSV 感染的有效手段,但目前国内尚无获得许可的RSV疫苗。有效的RSV疫苗应在呼吸道系统感染部位提供保护,作为抵御感染的第一线防线。黏膜疫苗可诱导黏膜免疫反应,预防黏膜感染,因此是RSV疫苗的主要研究重点。
本研究证明了BLP-F 黏膜疫苗的免疫原性,并制备了一种以铝为佐剂的注射疫苗(AL-F),结果发现,该疫苗在小鼠血清中诱导的IgG 抗体和中和抗体水平比BLP-F疫苗更高,但不能在黏膜中诱导sIgA抗体。
黏膜疫苗可诱导全身和黏膜免疫反应,但血清中IgG 滴度明显低于注射疫苗。目前使用的疫苗多为注射疫苗,可诱导较强的全身免疫反应,但诱导的黏膜免疫反应较低或不能诱导黏膜免疫反应,与本研究结果一致。虽然sIgA 在预防感染方面的作用毋庸置疑,但目前尚无合适的方法来评估IgA的具体功能。攻毒模型也并不适用于评价黏膜免疫的效果,因为攻毒并不能完全模拟自然感染事件,主要原因是建立攻毒模型需使用的病毒量比自然感染的病毒量更高;而在采用大量病毒的攻毒模型背景下,IgA将无法发挥其正常功能。目前,对于具有保护作用的黏膜抗RSVIgA 中和抗体水平或长期IgAB 细胞记忆的产生水平无统一标准,这是评价RSV 疫苗是否具有保护水平的两个关键要求。因此,目前判断临床试验中的RSV疫苗是否具有抗RSV感染的保护作用为时尚早。
考虑到本研究的两种疫苗和疫苗接种目标人群的差异,在这一点上很难明确得出黏膜疫苗和注射疫苗哪种具有更好的保护作用。因此,建立合适的功能评价方法和动物模型以更好地评价IgA 在黏膜中的作用十分重要;即确定IgA的中和抗体。后续研究将采用联合免疫的方式评估这两种疫苗作为免疫原的可行性,以同时增强全身和黏膜免疫应答。

