蓝莓果渣花色苷提取纯化工艺研究
张芷瑜 张天伟 杨馥菡 李会珍 张志军

DOI:10.3969/j.issn.1000-9973.2024.03.029
引文格式:張芷瑜,张天伟,杨馥菡,等.蓝莓果渣花色苷提取纯化工艺研究[J].中国调味品,2024,49(3):175-181.
ZHANG Z Y, ZHANG T W, YANG F H, et al. Study on extraction and purification process of anthocyanins from blueberry residue[J].China Condiment,2024,49(3):175-181.
摘要:蓝莓果渣中的花色苷经超声辅助乙醇法进行提取,通过正交试验确定提取的最优条件为料液比1∶30 (g/mL)、pH 3.0、乙醇体积分数50%、超声时间30 min,然后利用大孔树脂对粗提得到的花色苷进行分离纯化,对比了XDA-6、LX-16、LX-41、LX-180S、LK825、DM21 6种大孔树脂的吸附和解吸效果。结果表明,LK825型大孔树脂的吸附率和解吸率分别为90.36%、90.19%,具有较强的吸附能力和较好的解吸性能,故选用LK825型大孔树脂进行纯化试验。LK825型大孔树脂静态试验的最优条件为吸附平衡时间7 h、解吸平衡时间5 h、提取液pH 3.0、解吸液pH 3.0、解吸液乙醇体积分数60%。动态试验的最优参数为上样流速1.0 mL/min、上样液体积22 BV、上样浓度1.0 mg/mL、洗脱流速1.5 mL/min、解吸液体积9 BV。纯化后蓝莓果渣花色苷的含量和色价分别是纯化前的12.8倍和17.9倍,纯度明显提高。
关键词:蓝莓果渣;花色苷;提取;纯化
中图分类号:TS201.1 文献标志码:A 文章编号:1000-9973(2024)03-0175-07
Study on Extraction and Purification Process of Anthocyanins from Blueberry Residue
ZHANG Zhi-yu1,2, ZHANG Tian-wei1,2, YANG Fu-han2, LI Hui-zhen1,2, ZHANG Zhi-jun1,2*
(1.College of Chemistry and Chemical Engineering, North University of China, Taiyuan 030051,
China; 2.Jinzhong Industrial Technology Innovation Institute, North University of China,
Jinzhong 030600, China)
Abstract: The anthocyanins in blueberry residue are extracted by ultrasonic-assisted ethanol method. The optimal extraction conditions determined through orthogonal experiment are solid-liquid ratio of 1∶30 (g/mL), pH of 3.0, ethanol volume fraction of 50% and ultrasonic time of 30 min, and then macroporous resins are used to separate and purify the anthocyanins obtained by crude extraction. The adsorption and desorption effects of six macroporous resins such as XDA-6, LX-16, LX-41, LX-180S, LK825, DM21 are compared. The results show that the adsorption rate and desorption rate of LK825 macroporous resin are 90.36% and 90.19% respectively, which has strong adsorption capacity and good desorption property. Therefore, LK825 macroporous resin is selected for purification test. The optimal conditions for the static test of LK825 macroporous resin are adsorption equilibrium time of 7 h, desorption equilibrium time of 5 h, extraction solution pH of 3.0, desorption solution pH of 3.0 and ethanol volume fraction in desorption solution of 60%. The optimal parameters of dynamic test are loading flow rate of 1.0 mL/min, loading solution volume of 22 BV, loading concentration of 1.0 mg/mL, elution flow rate of 1.5 mL/min and desorption solution volume of 9 BV. After purification, the content and color value of anthocyanins in blueberry residue are 12.8 times and 17.9 times of those before purification, and the purity is significantly improved.
Key words: blueberry residue; anthocyanins; extraction; purification
收稿日期:2023-09-23
基金项目:山西省重点研发计划项目特优农业技术创新专项(2022ZDYF123)
作者简介:张芷瑜(1999—),女,硕士研究生,研究方向:植物有效成分提取。
*通信作者:张志军(1973—),男,教授,博士生导师,研究方向:植物功能成分提取与高效利用。
蓝莓是杜鹃花科越橘属植物,有着极其丰富的营养价值。蓝莓不仅可以鲜食,而且可以作为原料加工成人们喜爱的食物,如:蓝莓饮料、果干、果酒等。花色苷因具有抗氧化活性、预防心血管疾病、延缓衰老、清除自由基、抗癌和抑菌等生物活性[1-2],在医药、食品、化妆品等多个领域内应用广泛。以蓝莓为原料的生产加工过程中会有大量的副产物生成,其中以果渣为主,蓝莓果渣中花色苷成分颇多[3],因此将蓝莓果渣中的花色苷进行提取纯化具有很高的研究价值。
水溶性花色苷可经超声辅助溶剂浸提出,超声波技术能使提取物的细胞壁破裂,增大了提取物与溶剂间相互运动的速度和频率,使得溶剂的穿透力增强,有利于将目标成分提取出来[4]。采用该方法得到的花色苷含有多种杂质,如蛋白質、糖类、脂肪和有机酸等[5],并且粗提得到的花色苷存在保存时间较短的问题,因此要进行分离纯化,以期获得高纯度的花色苷。大孔树脂具有稳定性强、效率高、操作简单和成本低等优点[6-8],被广泛应用于不同物质的富集纯化。本试验采用超声辅助酸化乙醇对蓝莓果渣进行粗提,以花色苷含量为指标,确定提取的最优工艺条件,将粗提得到的花色苷采用大孔树脂纯化技术进行分离纯化,通过考察静态试验和动态试验中各因素对花色苷分离纯化效果的影响,确定了纯化过程的最优工艺参数,为后续的开发利用提供了条件。
1 材料与方法
1.1 试验材料
蓝莓果渣:取自晋中市乌金山地区,鲜果榨汁后冷冻,备用;盐酸、氢氧化钠、氯化钾、无水乙酸钠、无水乙醇、磷酸氢二钠、柠檬酸(均为分析纯):天津市恒兴化学试剂制造有限公司;XDA-6、LX-16、LX-41、LX-180S型大孔树脂:西安蓝晓科技新材料股份有限公司;LK825、DM21型大孔树脂:天津波鸿树脂科技有限公司;层析柱(20 mm×300 mm):日嘉实验仪器经销部。
1.2 仪器设备
BQS-08A超声波清洗器 杭州宝珀超声波科技有限公司;5702RH离心机 南京伊若达仪器设备有限公司;SHZ-95B旋转蒸发仪 巩义予华仪器有限责任公司;UV7600紫外可见分光光度计 上海棱光技术有限公司;ZA305AS分析天平 上海赞维衡器有限公司;BK-DI10超纯水机 上海佰博康仪器有限公司。
1.3 试验方法
1.3.1 花色苷的提取方法
取一定量的蓝莓果渣,按照比例加入一定pH值的乙醇溶液,于50 ℃的条件下超声提取一段时间。超声提取结束后,设置转速为5 000 r/min,时间为10 min,离心。取上清液在50 ℃的条件下进行旋蒸,除去乙醇,即得花色苷粗提浓缩液。
1.3.2 花色苷含量的测定
花色苷含量经pH示差法测定。依次由pH为1.0的氯化钾-盐酸缓冲液和pH为4.5的乙酸钠-盐酸缓冲液将提取液稀释至一定倍数,混合均匀,室温下遮光放置30 min,以蒸馏水为空白组,依次于520,700 nm处检测吸光度[9-12],计算公式如下:
C(mg/g)=A×V×n×Mε×L×m。
式中:A为(A520 nm-A700 nm)pH 1.0-(A520 nm-A700 nm)pH 4.5;V为提取液总体积(mL);n为稀释倍数;M为矢车菊素-3-O-葡萄糖苷的相对分子质量(449.2 g/mol);ε为矢车菊素-3-O-葡萄糖苷的摩尔消光系数(26 900 L/(mol·cm));L为比色皿光程(cm);m为样品质量(g)。
1.3.3 单因素试验方法
以花色苷含量为衡量标准,依次考察料液比(1∶10、1∶20、1∶30、1∶40、1∶50,g/mL)、pH值(2.0,2.5,3.0,3.5,4.0)、乙醇体积分数(30%、40%、50%、60%、70%)和超声时间(20,30,40,50,60 min)对提取效果的影响。
1.3.4 正交试验方法
根据单因素试验结果,设计三因素三水平正交试验方案,选用L9(33)正交表进行正交试验,确定最佳提取工艺。
1.3.5 大孔树脂的预处理
将6种大孔树脂(XDA-6、LX-16、LX-41、LX-180S、LK825、DM21)放入烧杯中,加入95%乙醇,浸泡过夜,保证树脂颗粒溶胀完全,再经5%盐酸浸泡12 h,用纯水洗至无残留酸,最后经5%氢氧化钠浸泡12 h,用纯水洗至无残留碱,备用[13-14]。
1.3.6 大孔树脂的筛选
将粗提得到的浓缩液用pH为3.0的柠檬酸-磷酸氢二钠缓冲溶液稀释至一定倍数,备用。分别准确称取2 g预处理过的XDA-6、LX-16、LX-41、LX-180S、LK825、DM21型大孔树脂于锥形瓶中,取50 mL稀释过的花色苷粗提液于锥形瓶中,摇床振荡24 h,温度设为25 ℃,转速为110 r/min,吸附完全后停止振荡,取出过滤,取50 mL pH值为3、体积分数为60%的乙醇溶液加入到吸附饱和的大孔树脂中,封口,继续振荡24 h,温度为25 ℃,转速为110 r/min,待树脂解吸完全后过滤[15-17]。吸附率和解吸率计算公式如下:
吸附率(%)=A0-A1A0×100%。
解吸率(%)=A2A0-A1×100%。
式中:A0为稀释过的花色苷粗提液于520 nm处的吸光值;A1为吸附完全后的液体于520 nm处的吸光值;A2为解吸完全后的液体于520 nm处的吸光值。
1.3.7 静态吸附和解吸试验
1.3.7.1 树脂吸附平衡时间的确定
取50 mL稀释后的提取液加入装有2 g预处理过的LK825型大孔树脂的锥形瓶中,封口,摇床振荡,温度为25 ℃,转速为110 r/min,每隔1 h对上清液进行一次采样,于520 nm处检测吸光值,计算不同时间下的吸附率,绘制静态吸附曲线。
1.3.7.2 提取液pH值对吸附效果的影响
用柠檬酸-磷酸氢二钠缓冲液稀释提取液,将pH调节为1.0,2.0,3.0,4.0,5.0,各取50 mL至装有2 g预处理过的LK825型大孔树脂的锥形瓶中,封口,摇床振荡7 h,温度为25 ℃,转速为110 r/min,过滤取上清液,于波长520 nm处检测吸光值,计算吸附率。
1.3.7.3 树脂解吸平衡时间的确定
取50 mL pH为3.0、体积分数为60%的乙醇溶液,加入裝有2 g吸附饱和的LK825型大孔树脂的锥形瓶中,封口,保持振荡,温度为25 ℃,转速为110 r/min,每隔30 min对上清液进行一次采样,于520 nm处检测吸光值,计算不同时间下的解吸率,绘制静态解吸曲线。
1.3.7.4 解吸液pH对解吸效果的影响
以柠檬酸-磷酸氢二钠缓冲液作为溶剂配制体积分数为60%的乙醇溶液,将pH调节为1.0,2.0,3.0,4.0,5.0,各取50 mL至装有2 g吸附饱和的LK825型大孔树脂的锥形瓶中,封口,摇床振荡5 h,温度为25 ℃,转速为110 r/min,过滤取上清液,于520 nm处检测吸光值,计算解吸率。
1.3.7.5 乙醇体积分数对解吸效果的影响
配制pH为3.0、体积分数分别为40%、50%、60%、70%、80%的乙醇溶液,各取50 mL至装有2 g吸附饱和的LK825型大孔树脂的锥形瓶中,封口,摇床振荡5 h,温度为25 ℃,转速为110 r/min,过滤取上清液,于520 nm处检测吸光值,计算解吸率。
1.3.8 动态吸附和解吸试验
1.3.8.1 上样浓度对吸附效果的影响
将预处理过的LK825型大孔树脂湿法装入层析柱中,配制pH为3.0、浓度分别为0.5,1.0,1.5,2.0,2.5 mg/mL的提取液,流速为1.0 mL/min,测定流出液在520 nm处的吸光度,计算吸附率。
1.3.8.2 上样流速对吸附效果的影响
将pH为3.0、浓度为1.0 mg/mL的花色苷提取液流过树脂,流速分别设为0.5,1.0,1.5,2.0,2.5 mL/min,检测流出液在520 nm处的吸光值,计算吸附率。
1.3.8.3 泄漏曲线的测定
将pH为3.0、浓度为1.0 mg/mL的提取液加入层析柱中,流速为1.0 mL/min,流出液按每1 BV收集一次,于520 nm处测其吸光值,绘制泄漏曲线。一般认为,流出液的吸光值不能超过上样液吸光值的1/10,否则即认为花色苷发生泄漏[18],即刻停止上样。
1.3.8.4 洗脱流速对解吸效果的影响
将一定体积、pH为3.0、浓度为1.0 mg/mL的提取液以1.0 mL/min的流速流过树脂,使树脂达到饱和状态,然后用蒸馏水反复冲洗,目的是将树脂表面残留的杂质清洗掉。继续加入pH为3.0、体积分数为60%的乙醇溶液于层析柱中,控制其流速分别为0.5,1.0,1.5,2.0,2.5 mL/min,于520 nm处检测流出液的吸光值,计算解吸率。
1.3.8.5 洗脱曲线的测定
将一定体积、pH为3.0、浓度为1.0 mg/mL的提取液以1.0 mL/min的流速流过树脂,使树脂达到饱和状态,然后用蒸馏水反复冲洗。将pH为3.0、体积分数为60%的乙醇溶液加入层析柱中,控制其流速为1.5 mL/min,流出液按每1 BV收集一次,于520 nm处检测吸光值,绘制洗脱曲线。
1.3.9 蓝莓花色苷色价的测定
取纯化后的蓝莓花色苷粉末,用pH为3.0的柠檬酸-磷酸氢二钠缓冲液稀释,于520 nm处检测吸光值[19],按下式计算色价:
E1%1 cm=AR。
式中:A为样品溶液的吸光值;R为稀释倍数。
2 结果与分析
2.1 提取工艺条件对蓝莓果渣花色苷提取效果的影响
由图1中A可知,提取液中花色苷的含量在料液比增加时的变化趋势为先增加后减少。原因是随着乙醇溶液的增加,花色苷的扩散速率提高,当料液比达到1∶30 (g/mL)时,花色苷分子在提取液中的浓度达到平衡状态,此时提取效率达到最大值,花色苷含量为1.197 mg/g。之后再增加料液比可能会使花色苷分子在提取液中的浓度降低,从而导致提取效率降低,花色苷含量下降。同时过量添加乙醇溶液,不仅造成了浪费,而且为后续过程中的浓缩处理增加了负担。所以,选择料液比1∶30 (g/mL)进行提取。
由图1中B可知,提取液的pH值在2.0~3.0之间,随着pH值的增大,花色苷含量显著增加;提取液pH值在3.0~4.0之间,随着pH值的增大,花色苷含量呈下降趋势。这是因为强酸条件会导致花色苷的糖基键发生水解反应,使花色苷的稳定性受到影响;而增大pH值会干扰花色苷的稳定性,所测得的吸光值也会下降。所以,提取液的最佳pH值为3.0。
由图1中C可知,乙醇体积分数在30%~50%范围内,花色苷含量与乙醇浓度呈正相关,这是因为乙醇溶液浓度和极性大小密切相关,适宜的极性条件能够增加溶剂的穿透力,加快花色苷从原料中溶出的速度。乙醇体积分数在50%~70%时,花色苷含量与乙醇溶液浓度呈负相关,这是因为乙醇溶液浓度过高,极性的大小发生了变化,超出了一定限值,阻碍了花色苷的溶出。所以,选择乙醇体积分数为50%。
由图1中D可知,提取液中花色苷含量随着超声时间的延长呈现先增加后减少的趋势。这是因为超声波的辅助作用有利于细胞壁的破碎,随着超声时间的延长,花色苷的浸出率增大;超声时间超过30 min后花色苷含量开始下降,可能是因为超声波的高能量会破坏花色苷分子,导致花色苷分子结构发生改变,使其难以被提取液萃取。所以,选择30 min为最佳超声时间。
2.2 正交试验设计优化蓝莓果渣花色苷提取工艺
2.2.1 正交试验设计
在单因素试验的基础上,选择A(料液比)、B(pH值)、C(超声时间)作为工艺优化的主要因素进行L9(33)正交试验,以花色苷含量为评价指标,正交试验因素与水平设计见表1,正交试验结果见表2。
2.2.2 正交试验结果
由表2和表3可知,以花色苷含量为考察指标,各因素对蓝莓果渣花色苷提取效果的影响由大到小为B(pH值)>A(料液比)>C(超声时间)。A(料液比)和B(pH值)对花色苷含量具有显著性影响,C(超声时间)对花色苷含量无明显影响。最佳的提取条件为A2B2C2,即料液比为1∶30 (g/mL),pH值为3.0,超声时间为30 min,在此基础上测得的花色苷含量为1.294 mg/g。
2.3 大孔树脂的筛选
大孔树脂主要依靠其表面和有机分子形成的范德华力或氢键等弱相互作用力对有机分子进行吸附,吸附和解吸效果不仅受到树脂的极性和颗粒大小的影响,而且受到比表面积、孔径等空间结构的影响[20]。由表4可知,不同类型的大孔树脂对花色苷的吸附、解吸效果有所不同,其中LX-41和LK825这两种类型的大孔树脂具有较好的吸附效果,原因是LX-41和LK825树脂的极性分别是弱极性和非极性,能够与弱极性成分为主的花色苷发生反应形成氢键,进而增大了树脂对花色苷的吸附量。从解吸效果来看,LK825和DM21这两种大孔树脂的解吸率均达到了90%以上。综合考虑吸附率和解吸率这两个重要参数,选取LK825型大孔树脂进行下一步研究。
2.4 树脂的静态吸附和解吸
2.4.1 静态吸附条件对蓝莓果渣花色苷吸附效果的影响
由图2中A可知,LK825型大孔树脂在2 h内吸附率的增长速率大幅增加,在7 h后吸附率的增长速率趋于平缓,达到动态平衡。造成这种现象的原因是前期树脂未吸附饱和,大量的花色苷吸附在树脂上,后期LK825型大孔树脂中的疏水基开始排斥有效物质或者粗提液中花色苷吸附完毕,导致吸附率达到最高并处于动态稳定。所以,选定7 h为静态吸附饱和点。
由图2中B可知,LK825型大孔树脂的吸附率随着提取液pH值的增加而升高,当pH值为3.0时吸附率达到最高,再增加pH值吸附率变化不大。在酸性条件下花色苷吸附率较低的原因可能是大孔树脂失水导致孔径增大,不利于花色苷的吸附。因此,选择提取液pH值为3.0进行吸附。
2.4.2 靜态解吸条件对蓝莓果渣花色苷解吸效果的影响
由图3中A可知,LK825型大孔树脂的解吸率随时间的延长而逐渐增加,于5 h时达到峰值,时间继续增加,解吸率相差不大,处于动态稳定。所以,选择5 h为最佳静态解吸时间。
由图3中B可知,随着pH值的增加,解吸率逐渐降低。解吸液pH值在1.0,2.0,3.0时,解吸率均在90%以上,但在酸性较强的条件下以糖基键为主的花色苷会发生水解反应,花色苷的稳定性较差。所以,选择解析液pH值为3.0。
由图3中C可知,随着乙醇体积分数不断增大,LK825型大孔树脂的解吸率呈先逐渐增加后趋于平缓的趋势,当乙醇体积分数为60%时解吸率达90%以上,继续增加乙醇体积分数,测得的解吸率增大幅度甚微。因此,从降本增效的角度考虑,选定60%为最佳解吸液乙醇体积分数。
2.5 树脂的动态吸附和解吸
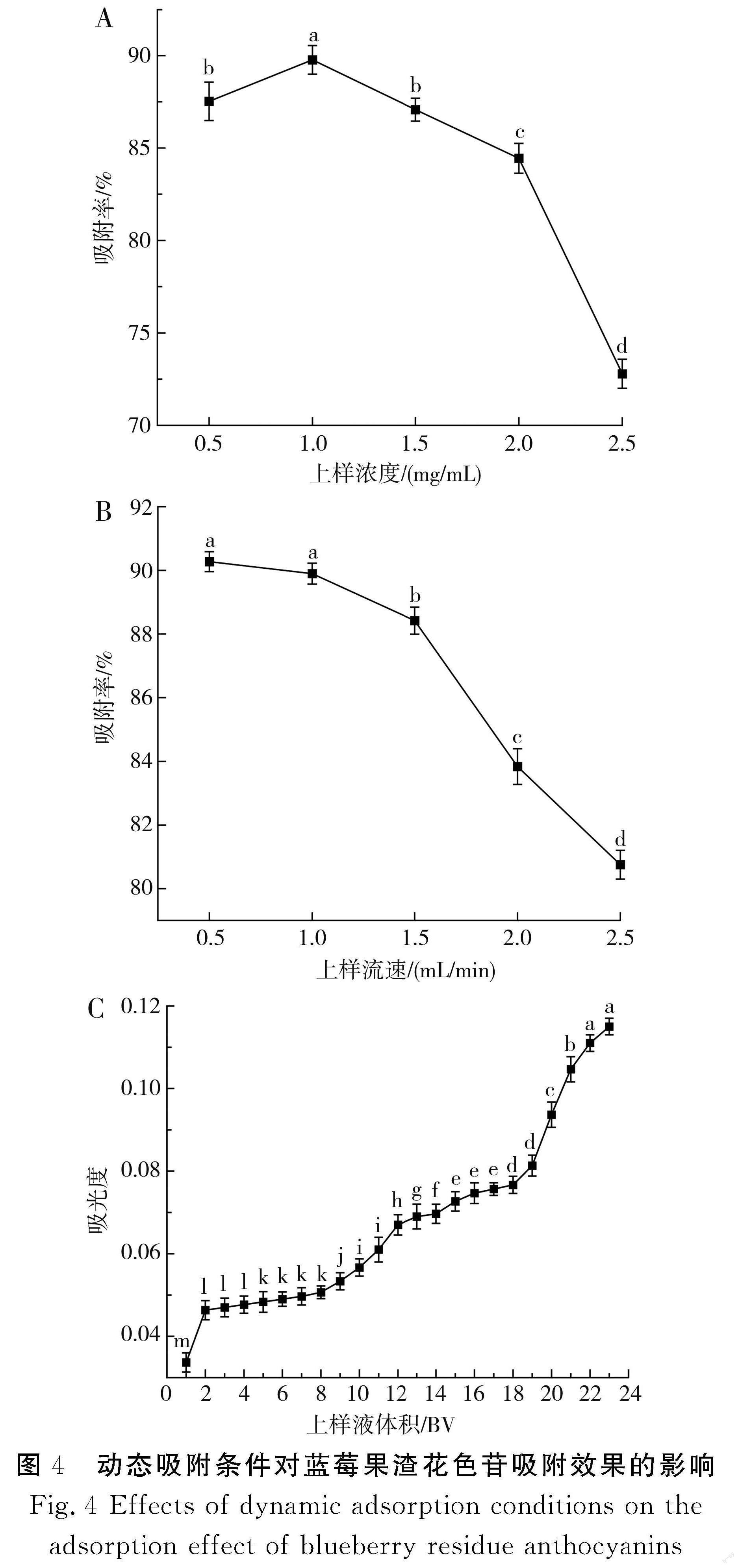
2.5.1 动态吸附条件对蓝莓果渣花色苷吸附效果的影响
由图4中A可知,随着上样浓度不断增大,LK825型大孔树脂的吸附率呈现先增大后减小的趋势,在上样浓度为1.0 mg/mL的条件下测得的吸附率最大,为89.76%。原因是较低浓度的花色苷流过树脂会增加其吸附在树脂上的时间,效率较低;吸附较高浓度的花色苷会导致泄露点提前出现,同时会将一些杂质吸附上去,影响了大孔树脂的吸附效果。所以,选择1.0 mg/mL为最佳上样浓度。
由图4中B可知,LK825型大孔树脂的吸附率随着上样流速的增快而降低,原因是上样流速过快会使提取液与树脂相互作用的时间缩短,提取液中的花色苷未能被充分吸附,造成样液损失;同时,流速过快会使树脂在吸附不饱和的状态下形成的分子键遭到破坏,导致吸附效果较差。上样流速越慢,提取液中的花色苷分子与大孔树脂越充分接触形成范德华力,分子间的扩散速率逐渐加快,吸附效果明显提高。在上样流速为0.5,1.0 mL/min的条件下测得的吸附率虽然相差不大,但流速太低,将导致试验周期延长。所以,选择1.0 mL/min为最佳上样流速。
由图4中C可知,前期树脂吸附不饱和,开始大量吸附花色苷,流出液中不含花色苷;随着上样量不断增加,树脂逐渐达到饱和状态,流出液的吸光值持续增大,花色苷发生泄漏。上样溶液的吸光值为1.131,上样量达22 BV时,流出液的吸光值为0.111,为上样液吸光值的1/10,出现泄漏点。所以,上样液体积应不超过22 BV。
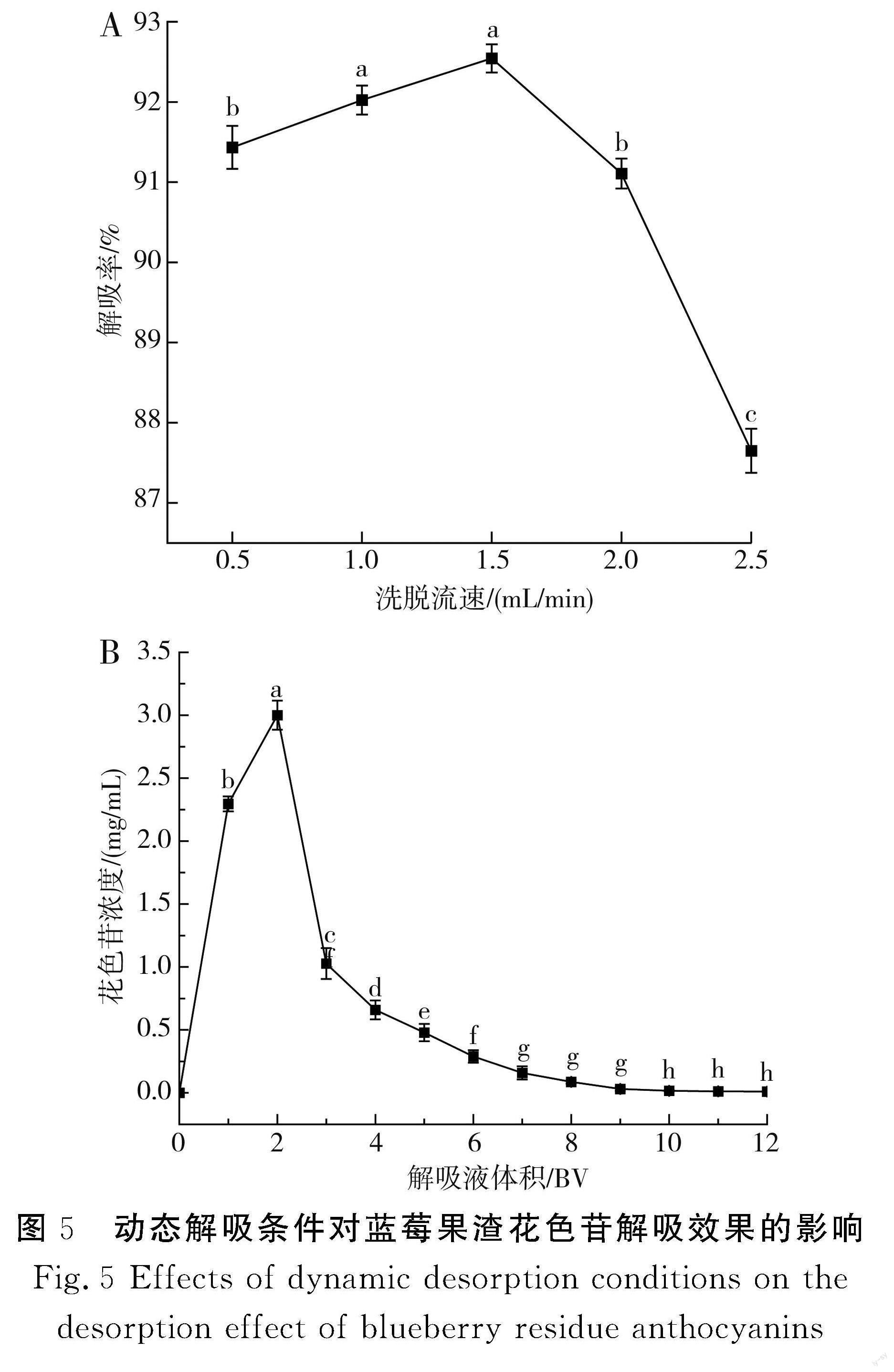
2.5.2 动态解吸条件对蓝莓果渣花色苷解吸效果的影响
由图5中A可知,洗脱流速在0.5~1.5 mL/min范围内,解吸率与之呈正相关;洗脱流速在1.5~2.5 mL/min范围内,解吸率与之呈负相关。分析其原因为洗脱流速越快,解吸液与大孔树脂越难充分接触,导致大孔树脂表面吸附的花色苷没有完全被洗脱下来,解吸液就已经流出,解吸效果不好;洗脱流速过慢,解吸液在层析柱中停留时间过长,造成解吸液解吸饱和,解吸效率降低。所以,选择1.5 mL/min为最佳洗脱流速。
由图5中B可知,随着解吸液体积不断增加,被树脂紧密吸附的花色苷逐渐被解吸下来,当解吸液体积为2 BV时,大量的花色苷被洗脱下来,流出液中花色苷的浓度达到峰值,不断增大解吸液用量,花色苷的浓度逐渐降低,当解吸液体积达到9 BV时,流出液中基本不含花色苷,为了提高纯化效率,放弃后期洗脱液的收集。所以,解吸液体积应不超过9 BV。
2.6 纯化前后花色苷含量和色价的比较
由表5可知,经LK825型大孔树脂纯化后的花色苷含量和色价均得到了显著提高,分别为纯化前的12.8倍和17.9倍,说明LK825型大孔树脂对花色苷的纯化效果明显。
3 结论
本文采用超声波辅助乙醇溶液提取的方法对蓝莓果渣花色苷进行提取,经单因素试验比较了不同料液比、pH值、乙醇体积分数和超声时间对提取效果的影响。通过正交试验进行优化,确定最优提取工艺为pH 3.0、料液比1∶30 (g/mL)、超声时间30 min、乙醇体积分数50%。
采取大孔树脂对蓝莓果渣花色苷进行纯化试验研究。首先,以吸附、解吸效果为指标,研究了6种大孔树脂的优劣势,确定了纯化蓝莓果渣花色苷的最优大孔树脂型号是LK825。其次,通过静态试验确定了最佳的吸附和解吸条件为吸附平衡时间7 h、提取液pH 3.0、解吸平衡时间5 h、解吸液pH 3.0、乙醇体积分数60%。最后,根据动态试验确定了最优的吸附、解吸工艺参数:上样浓度1.0 mg/mL,上样流速1.0 mL/min,上样液体积22 BV,洗脱流速1.5 mL/min,解吸液体积9 BV。纯化后蓝莓果渣花色苷的含量和色价分别为纯化前的12.8倍和17.9倍,纯化效果明显。该提取纯化工艺高效可行,为之后对蓝莓果渣花色苷产品的研发贡献了思路。
参考文献:
[1]张林,叶红玲,姚军,等.蓝莓加工废弃物中花青素提取工艺的优化[J].安徽科技学院学报,2018,32(4):45-49.
[2]张盼盼.蓝莓果渣花青素的提纯、特性及应用研究[D].滁州:安徽科技学院,2017.
[3]陈成花,张婧,陈海燕,等.蓝莓果渣花色苷超声提取工艺优化及组成分析[J].食品科技,2016,41(4):192-199.
[4]赵旭彤.蓝莓加工废弃物中花青素提取纯化及抗氧化活性研究[D].长春:吉林大学,2015.
[5]JOS A G M, CARRERA C, BARBERO G F, et al. A comparison study between ultrasound-assisted and enzyme-assisted extraction of anthocyanins from blackcurrant (Ribes nigrum L.)[J].Food Chemistry:X,2022,13:100192.
[6]张晓圆.黑豆红花色苷提取纯化、结构鉴定及稳定性研究[D].天津:天津科技大学,2017.
[7]GUO L, LI X M, ZHANG J, et al. Optimization of extraction and macroporous resin purification processes of total triterpenoid from Boletus edulis Bull.:Fr[J].Journal of Food Processing and Preservation,2021,45(4):15292.
[8]ZHOU P, FANGMA Y J, JIN W F, et al. Response surface optimization of the water immersion extraction and macroporous resin purification processes of anhydrosafflor yellow B from Carthamus tinctorius L.[J].Journal of Food Science,2020,85(10):3191-3201.
[9]葉红玲,姚军,刘冬,等.蓝莓果渣花青素的超声提取及组成分析[J].食品研究与开发,2019,40(10):105-108,130.
[10]谢丹,毕远林,裴璞花,等.响应曲面法优化超声辅助乙醇提取蓝莓花青素的工艺研究[J].河南工业大学学报(自然科学版),2018,39(6):60-64.
[11]董翠芳,闫晓燕,李煦,等.超声-微波协同辅助提取桑葚花色苷及抗氧化性研究[J].中国调味品,2020,45(12):172-178.
[12]崔丽霞,张志军,李会珍.黑玉米籽粒花色苷降解动力学及稳定性[J].中国调味品,2022,47(11):178-183.
[13]崔丽霞,张志军,李晓君,等.紫苏花色苷纯化工艺研究[J].食品科技,2017,42(5):204-208.
[14]唐璐.黑果腺肋花楸花色苷提取分离纯化及微胶囊化的研究[D].长春:吉林农业大学,2019.
[15]王晓婷,康明丽,宋丽君,等.大孔吸附树脂法纯化黑玉米花青素工艺[J].食品工业,2022,43(5):19-24.
[16]马义虔.桑椹花色苷的提取、纯化、微胶囊化及应用[D].贵阳:贵州大学,2016.
[17]邓红梅,黄润霞,高珑华,等.红肉火龙果中花色苷的提取纯化及结构分析[J].中国食品添加剂,2021,32(10):75-81.
[18]栾浩,周剑丽,屈午,等.蓝莓果渣花色苷大孔树脂纯化工艺研究[J].中国酿造,2021,40(12):138-143.
[19]代文清,张福娟,纪秀凤,等.大孔树脂-聚酰胺联用纯化桑葚花色苷[J].包装工程,2021,42(19):63-68.
[20]白茹,冯颖.大孔树脂纯化紫玉米花色苷的工艺及产品表征研究[J].农业科技与装备,2022(3):53-56.

