淫羊藿苷通过上调SLC7A11/GPX4轴减轻铁死亡改善心力衰竭
唐文静 ,罗亚丹 ,朱尽染 ,文 丹 ,杨丹莉
(1.遵义医科大学 贵州省基础药理重点实验室,基础药理教育部重点实验室、特色民族药教育部国际合作联合实验室,贵州 遵义 563006;2.遵义医科大学 药学院,贵州 遵义 563006)
心力衰竭(heart failure,HF)是由各种心脏疾病导致的心脏结构与功能紊乱的综合征,是众多心血管疾病的终末期,给家庭及社会造成了严重的负担[1]。虽然β受体拮抗药、ACEI类药、AT1拮抗药、醛固酮拮抗药、利尿药等在HF临床防治中得到广泛应用,但HF的死亡率仍然很高[2]。因此,寻找新的防治HF药物是亟待解决的问题。铁死亡是一种铁依赖程序性细胞死亡方式,其中SLC7A11/GPX4轴下调介导的脂质过氧化物过度积累是铁死亡发生的关键调控因素[3]。铁死亡通过促进心肌细胞肥大、炎症及心肌纤维化等心室重构的发生,进而促进HF的发生、发展[4-5]。因此,上调SLC7A11/GPX4轴,减少脂质过氧化物生成,抑制心肌细胞发生铁死亡,是治疗HF的重要策略。
淫羊藿苷( icariin,ICA)是传统中药淫羊藿的主要活性成分之一,具有降低血压、抗心律失常、抗氧化应激、抗炎等多种药理作用,对心肌缺血性疾病、高血压心脏病、心律失常等具有潜在治疗效应[6]。异丙肾上腺素(isoproterenol,ISO)是一种非选择性儿茶酚胺β-肾上腺素能受体激动剂,是公认的制备心室病理性重构和心功能障碍动物模型的工具药[7]。值得注意的是,ICA 干预 ISO 诱导的小鼠心力衰竭是否通过抑制铁死亡而发挥保护作用尚不清楚。因此,本项目以C57BL/6小鼠为研究对象,用ISO制备心力衰竭动物模型,基于SLC7A11/GPX4轴、脂质过氧化及铁死亡研究ICA抗ISO所致小鼠心力衰竭的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 7周龄C57BL/6小鼠、SPF级,购买于湖南斯莱克景达实验动物有限公司,该公司的许可证号:SCXK(湘)2019-0004,并饲养于SPF级动物房(遵义医科大学),自由饮食。
1.1.2 药物与试剂 淫羊藿苷(编号:FY1742-B;南通飞宇生物科技有限公司);异丙肾上腺素(编号:HY-B0468;MCE公司);普鲁士蓝染色试剂盒(编号:GL428;SolarBio公司);GAPDH兔多克隆抗体(编号:10494-1-AP;Proteintech公司);GPX4鼠多克隆抗体(编号:67763-1-Ig;Proteintech 公司);SLC7A11兔多克隆抗体(编号:26864-1-AP;Proteintech公司);DMT1兔多克隆抗体(编号:AF302536;艾方生物公司);ACSL4兔多克隆抗体(编号:22401-1-AP; Proteintech公司);TFR1兔单克隆抗体(编号:R08-9V6;ZENBIO公司);LPCAT3鼠单克隆抗体(编号:67882-1-lg;Proteintech公司);4-HNE兔多克隆抗体(编号:BC07253787;北京博奥森生物科技有限公司);HRP标记山羊抗兔IgG(编号:SA+00001-2;Proteintech公司);HRP标记山羊抗鼠IgG(编号:SA00001-1;Proteintech公司)。
1.2 方法
1.2.1 动物分组及造模给药 小鼠适应性喂养1周后,随机分为5个组:①空白组(Control):灌胃双蒸水;②ISO模型组(ISO):经颈背部皮下注射ISO(15 mg/kg)制备心力衰竭动物模型,并灌胃双蒸水,连续7 d;③淫羊藿苷低剂量组(ICA-L)和高剂量组(ICA-H):制备动物模型同②,并且分别灌胃给予ICA(15、60 mg/kg,qd),连续7 d;④阳性药氯沙坦组(Los):制备动物模型同②,并且灌胃给予Los(9 mg/kg)。以上各组动物每组均为12只。符合动物福利伦理要求(伦理编号:ZMU22-2203-580)。
1.2.2 左心功能检测 最后1次给药结束后,将小鼠麻醉后脱去其左胸部皮毛,并将其固定在检测台,涂抹适量耦合剂,采用小动物超声检测仪进行检测并获取超声心动图,分析左心室射血分数(EF%)与短轴缩短率(FS%)的变化。
1.2.3 样本收集 给药结束后称取小鼠重量,腹腔注射浓度为2%的戊巴比妥钠并以剂量为4.0 mg/kg麻醉小鼠后处死,取出小鼠心脏,剥离右心室,分别进行称重,并取小鼠左心室部分组织置于中性甲醛中固定,用于病理检查以及普鲁士蓝染色,其余心脏组织置于EP管中,并于-80 ℃条件下保存备用。
1.2.4 小鼠心脏质量指数 称取小鼠体重(g)、心脏及左心室+室间隔的质量(mg),计算小鼠心脏质量指数(HMI)和左心质量指数(LVMI)。
1.2.5 小鼠心脏病理检测 利用中性甲醛(10%)固定、流水冲洗、梯度乙醇脱水、石蜡包埋、切片等操作后,采用不同染色方法,观察小鼠左心组织病理变化以及铁离子沉积情况。
1.2.6 蛋白免疫印迹法(Western blot)检测蛋白表达 取小鼠左心室组织30~50 mg,1 mg组织加入10 μL组织裂解液(PMSF:RIRA裂解液∶蛋白磷酸酶抑制剂=1∶100∶1),并利用组织匀浆机裂解组织,在冰上静置30 min,最终在4 ℃、1.2 ×104r/min条件下离心15 min收集上清;采用BCA定量检测并计算样本浓度,蛋白上样量为30 μg/10 μL;电泳分离蛋白,并利用半干转法进行转膜,7%牛奶进行封闭2~3 h,一抗GAPDH(1∶5 000)、GPX4(1∶2 000)、SLC7A11(1∶1 000)、ACSL4(1∶5 000)、LPCAT3(1∶2 000)、4-HNE(1∶1 000)、TFR1(1∶1 000)、DMT1(1∶1 000),4 ℃孵育过夜,二抗(1∶5 000)4 ℃孵育1 h,ECL显色。

2 结果
2.1 检测小鼠左心功能的变化 超声结果显示,与空白组相比,ISO模型组的左心室射血分数(EF%)和短轴缩短率(FS%)显著降低(P<0.05)。与ISO模型组相比,ICA低、高剂量干预组以及Los组的EF%、FS%均显著升高(P<0.05)。结果见图1。

A:超声代表图依次为Control组、LSO组、ICA-L组、ICA-H组、LOS组;B:射血分数(%);C:短轴缩短率(%); *:与空白组比较, P <0.05; #:与 ISO 组比较,
2.2 小鼠心脏质量指数及左心质量指数的变化 与空白组相比,ISO模型组的HMI、LVMI均显著升高(P<0.05);与ISO模型组相比,ICA低、高剂量组及 Los组的HMI、LVMI均显著降低(P<0.05)。结果见图2。

A:左心室质量指数;B:心脏指数; *:与空白组比较, P <0.05; #:与 ISO组比较,
2.3 病理检测 HE染色结果显示,空白组心肌细胞具有正常的组织结构,心肌细胞排列整齐,无炎症细胞浸润;与空白组相比,ISO模型组心肌细胞排列紊乱,炎性细胞浸润明显;与ISO模型组相比,ICA低、高剂量组以及Los组心肌细胞排列趋于整齐,无明显的炎性细胞浸润(图3)。

A:Control;B:Model;C:ICA-L;D:ICA-H;E:Los;标尺= 50 μm。
2.4 普鲁士蓝染色 染色结果显示,空白组左心室心肌组织中未见明显棕色颗粒,仅有极微量铁的沉积;与空白组相比,ISO模型组左心室心肌组织中可见明显棕色颗粒,铁沉积明显。与ISO模型组相比,ICA低、高剂量组以及Los组左心室心肌组织中棕色颗粒减少,铁离子沉积明显改善(图4)。
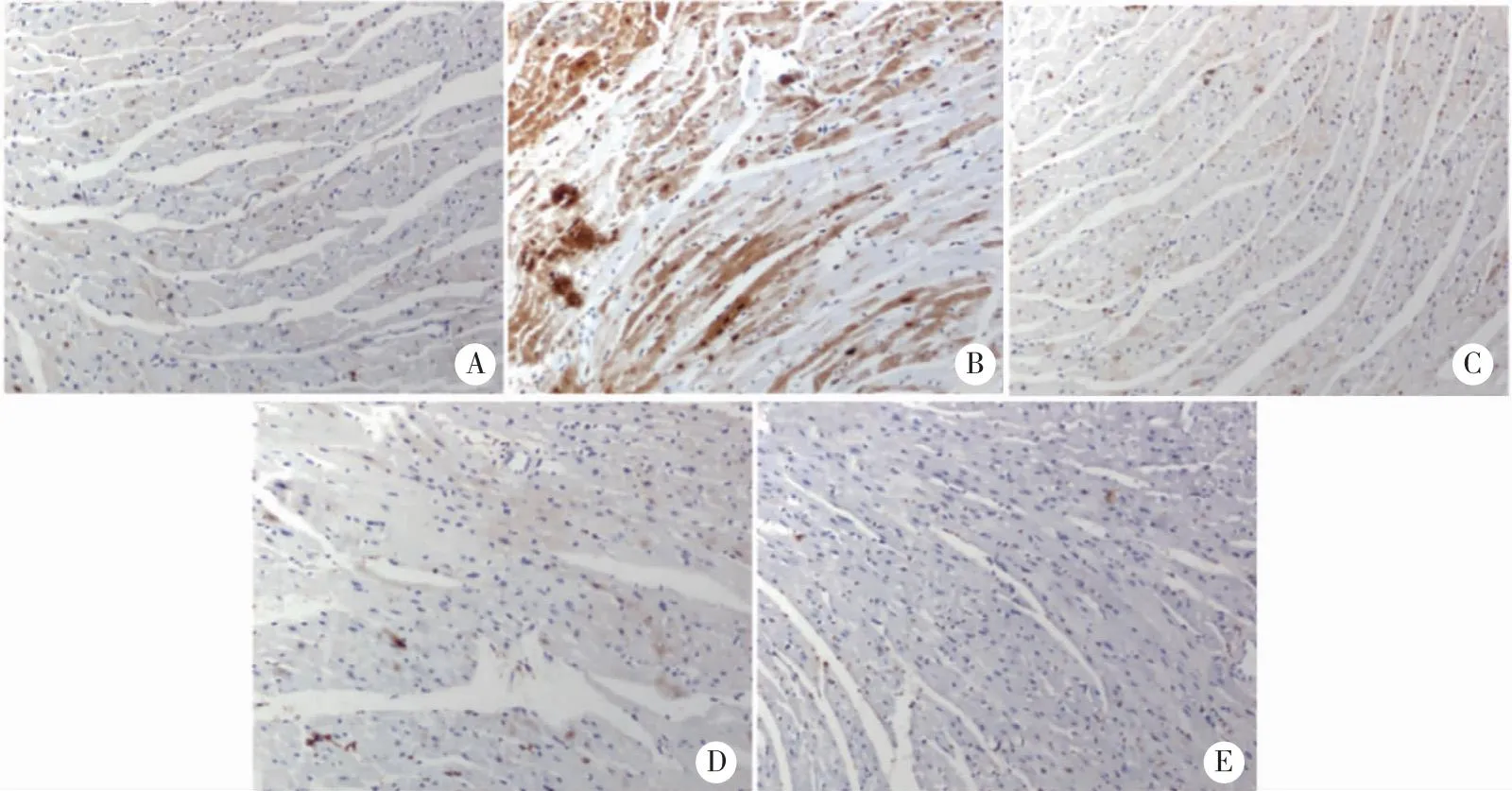
A:Control;B:Model;C:ICA-L;D:ICA-H;E:Los;标尺= 50 μm。
2.5 小鼠左心室组织中铁死亡相关蛋白的表达
2.5.1 小鼠左心室组织中4-HNE蛋白的表达 Western blot结果显示,与空白组相比,ISO模型组小鼠左心室组织中4-HNE蛋白表达明显上调48.3%(P<0.05)。与ISO模型组比较,ICA低、高剂量组及Los组左心室组织中4-HNE蛋白表达分别下调39.6%、84.3%、94.9% (P<0.05,图5)。

*:与空白组比较,P<0.05;#:与ISO组比较,
2.5.2 小鼠左心室组织中SLC7A11、GPX4蛋白的表达 Western blot结果显示,与空白组相比,ISO模型组小鼠左心室组织中SLC7A11、GPX4蛋白表达分别下调57.4% 、 40.3%(P<0.05)。与ISO模型组比较,ICA低、高剂量组及Los组左心室组织SLC7A11分别上调148.8%、228.6%、292.0% (P<0.05);GPX4分别上调38.8%、81.7%、134.5% (P<0.05,图6)。

*:与空白组比较,P<0.05;#:与ISO组比较,
2.5.3 小鼠左心室组织中ACSL4、LPCAT3蛋白的表达 Western blot结果显示,与空白组相比,ISO模型组小鼠左心室组织中ACSL4、LPCAT3蛋白表达分别上调41.5% 和40.0% (P<0.05)。与ISO模型组比较,ICA低、高剂量组及Los组左心室组织中的ACSL4分别下调31.1%、40.2%、39.1% (P<0.05);LPCAT3分别下调25.7%、59.3%、43.9% (P<0.05,图7)。
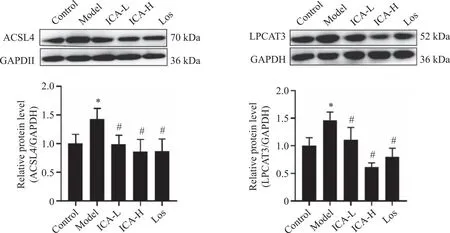
*:与空白组比较,P<0.05;#:与ISO组比较,
2.5.4 小鼠左心室组织中TFR1、DMT1蛋白的表达 Western blot结果显示,与空白组相比,ISO模型组小鼠左心室组织中的TFR1、DMT1蛋白表达分别上调114.0%和43.8%(P<0.05)。ICA与ISO模型组比较,低、高剂量组及Los组左心室组织中的TFR1分别下调140.3%、166.5%、141.3%(P<0.05);DMT1分别下调32.5%、46.5%、39.7%(P<0.05,图8)。
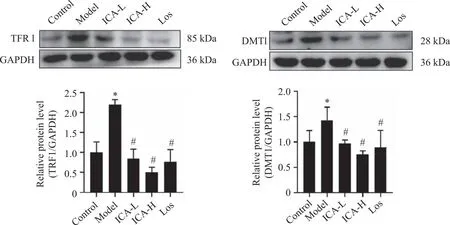
*:与空白组比较,P<0.05;#:与ISO组比较,
3 讨论
HF是大多数心血管疾病的终末期,临床表现主要为肺水肿、呼吸困难以及乏力等[8]。本研究中ISO模型组小鼠的LVEF、LVFS明显降低,而HMI、LVMI明显升高;同时ISO模型组病理结果显示心肌细胞形态排列紊乱,炎性细胞浸润明显。提示本实验条件下成功制备小鼠心力衰竭模型。而给予ICA、阳性药Los干预后,明显改善ISO所致小鼠LVEF、LVFS、HMI、LVMI及左心室病理的变化。提示ICA能够抑制ISO引起小鼠心室重构,改善心力衰竭。
铁死亡是一种铁依赖性细胞死亡形式[9]。本研究通过普鲁士蓝染色发现,在ISO组小鼠心肌组织中棕色颗粒明显增多,铁沉积含量显著增加;然而给予低、高剂量ICA以及Los干预后,左心室组织的棕色颗粒明显减少,铁沉积含量显著降低。提示低、高剂量ICA以及Los能抑制ISO所导致的左心组织的铁离子增多。
三价铁离子与细胞膜上的转铁蛋白(TF)结合形成复合物,由转铁受体蛋白1(TFR1)转运到细胞内还原为二价铁离子,并由二价金属离子转运体(DMT1)转运后通过Fenton reaction导致脂质自由基生成增多引起脂质过氧化,引起铁死亡[10-11]。本研究发现ISO组左心室组织中TFR1、DMT1蛋白表达上调;然而给予低、高剂量ICA以及Los干预后,左心室组织中TFR1、DMT1蛋白表达降低。提示ICA改善心衰小鼠左心室功能减退与病理损伤可能与其下调左心室组织TFR1、DMT1蛋白表达,抑制细胞铁离子过载,减轻铁死亡有关。
脂质过氧化标志物4-羟壬二酸酯(4-HNE)是由脂肪酸过氧化产生的有害代谢产物。研究证明,在心肌缺血/再灌注模型中其表达增多可导致心功能障碍[12]。本研究发现ISO组左心室组织中4-HNE蛋白表达上调;然而给予低、高剂量ICA以及Los干预后,左心室组织中4-HNE蛋白表达降低。谷胱甘肽过氧化物酶4(GPX4)具有催化脂质氢过氧化物的还原作用[13]。值得注意的是,溶质载体家族7成员11(SLC7A11)介导的胱氨酸/谷氨酸转运体(System Xc-)是谷胱甘肽(GSH)合成中重要的转运载体,GSH作为细胞内的抗氧化剂,具有很强的抗氧化作用。抑制SLC7A11的表达时会导致GPX4的活性和稳定性被破坏以及GSH的合成减少,从而引起细胞脂质过氧化物的积聚促使细胞发生铁死亡[14-15]。此外,长链脂酰辅酶A合成酶4(ACSL4)和溶血卵磷脂酰基转移酶3(LPCAT3)是脂质代谢的两种关键代谢酶,可调控细胞膜中多种不饱和脂肪酸的生物合成,但其蛋白表达的过度上调可促使细胞脂质过氧化物生成增多,导致细胞膜通透性增强,促进细胞发生铁死亡[16]。因此,SLC7A11、GPX4、ACSL4、LPCAT3常常被认为是铁死亡发生的关键调控性蛋白。本研究中,ISO组左心室组织中SLC7A11、GPX4的蛋白表达降低;ACSL4、LPCAT3的蛋白表达上调,给予低、高剂量ICA以及Los干预后,左心室组织中SLC7A11、GPX4的蛋白表达上调;ACSL4、LPCAT的蛋白表达下调。表明ICA改善心衰小鼠左心室功能与病理变化可能与其上调SLC7A11/GPX4轴及抑制ACSL4、LPCAT3蛋白的表达,减轻脂质过氧化改善铁死亡有关。
综上所述,ICA能够改善ISO诱导的小鼠心力衰竭,其机制至少可能与抑制铁离子过载以及上调SLC7A11/GPX4轴抑制铁死亡有关。

